CFDI最新分享了核查中发现的常见问题总结,探讨了新形势下申办方的应履职责
从药物临床试验数据核查看申办者的职责履行情况 作者:高荣王安娜唐静方翔王佳楠 国家药品监督管理局食品药品查验中心 来源:中国新药杂志 2019 年第 28 卷第 8 期摘要:申办者作为药物临床试验的发起组织者、经费提供者和试验监查者
网络 - 药物临床试验,药物临床试验质量管理规范,数据核查,申办者,职责 - 2019-06-09
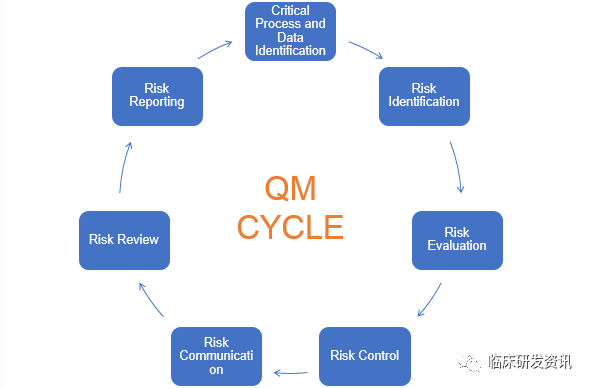
临床试验中的风险识别及风险管理
临床试验中不好的一面--风险,临床试验中处处都有坑。对待未知的事物,我们都会感觉莫名的恐惧和消极,但是对待任何未知事物人们的处理流程都是相似的,先认识,理解,再在这个认知的基础上去想办法应对,并加以利
MedSci原创 - 风险管理,临床试验 - 2020-03-29
中国医疗器械正进入GCP时代(收藏版)--《医疗器械临床试验质量管理规范》的深度解读
核心提示:CFDA于2016年3月23日在网上公布了新版医疗器械临床试验质量管理规范GCP。从最早2004年的5号令到2012年的征求意见稿,作为一名从事医疗器械法规和临床试验15年的技术男,深知该新版规范将对于医疗器械行业的影响。笔者认为,该《医疗器械GCP》将与《新版医疗器械监督管理条例》、即将发布的《医疗器械产品分类目录》形成影响中国医疗器械接下来5-10年最重要的三份文件。 前言
龙德医疗器械资讯 - 器械,GCP - 2016-04-03
中成药全生命周期价值评估核心指标专家共识
该共识将在高质量的中药新药创制、中成药科学定价与合理补偿、中医药临床路径制订及临床合理用药等领域发挥重要作用。
中国中药杂志 - 中成药 - 2023-05-19
陈峰教授详解iDMC
关于临床试验数据监查委员会,药审中心于2009年6月组织翻译了FDA在2006年3月发布的《临床试验数据监查委员会的建立与工作技术指导原则》。FDA在2015年进行了修订,国内目前参考的也是2015版
普瑞盛医药 - iDMC,陈峰 - 2020-05-06
CRA,你会逻辑核查吗?
这种误解不在少数,也是导致临床监查员的工作沦为二流的一个重要原因(因为这是一个中学生都可以做的事情,不需要5年甚至8年医学专业知识的积累)。如果你看到一个临床监查员甲在做SDV时很认真地从
网络 - 逻辑核查 - 2019-12-26
临床研究:具有中国特色的主要研究者(PI)
主要研究者的英文是Principal Investigator,缩写为PI。根据ICH-GCP的定义,Principal Investigator 同Investigator实际上是一回事。如果一个药物临床研究机构(国外称为Site)只有一个研究者,就称为Investigator,如果一个机构有多位研究者,那么主要负责的研究者就称为PI,其他称为Sub-investigator(辅助研究者),
MedSci原创 - 临床研究,研究者 - 2014-05-19
临床试验有关SOP汇总
临床试验方案修改SOP1. 申办者(包括药厂、CRO等)向中心药物临床试验办公室提出修改申请,填写“药物临床试验修改申请表”。2. 提供资料,包括:药物临床试验前研究资料,含试验药物的化学、药学、毒理学、药理学和临床的(包括以前的和正在进行的试验)资料和数据、研究者手册、试验药品药检报告、申办者资质证明、SFDA药物临床试验批文、试验方案和知情同意书(可以是初稿)。3. 药物临床试验办公室根据
MedSci原创 - 临床试验,SOP - 2014-03-28
临床研究:无论大小,关键在于专业与否
国际多中心试验通常由跨国制药公司发起,是在多个国家的研究中心进行的临床研究。它的特点概括一下就是:钱多、资源足和专业。 通常的国际多中心试验最大的特点就是“不差钱儿”,这是很多国内药厂最英雄气短的地方。钱多就可以变着法儿地花:用的是跨国CRO科文斯的中
医药经济报 - 临床研究,专业化 - 2014-04-10
临床研究的专业化发展趋势
在 20 年前,我刚开始做临床研究监察员(CRA)的时候,去试验中心只需要带一本方案加上一个笔记本就可以。那时候的笔记本不是现在的电脑笔记本,那时的笔记本是纸做的。 随着科技的发展,临床研究这个产业也发生了翻天覆地的变化。不但产生了许多专业工具、派生了更多专业部门,而且对于从业人员的要求也逐渐改变
泰格医药 - 临床研究,专业化 - 2014-03-28
新药临床试验设计中的基础问题解读
1新药临床试验管理规范1.1受试者权益安全性保障(即伦理性) 1.临床试验必须获得国家药品监督管理局的批准 2.为确保受试者的权益,并为之提供公众保证。必须经伦理委员会批准 3.中国GCP规定参加临床试验的研究单位必须是国家药品临床研究基地 4.中国GCP规定,负责临床试验的研究者(investigator)必须具备的条件 5.
MedSci原创 - 新药,临床试验,设计 - 2012-12-25
新药临床试验中遇到的100个问题(下)
51、什么是原始资料? 指与试验相关的原始数据被第一次记录的文件,它可以是 CRF(这种直接记录的方法须在试 验方案中注明)、试验专用的病例本、患者病例、输入计算机的数据、实验室报告、检查仪器自 动打印的图表等等,甚至是记录有试验数据的一个小纸片都应称做原始资料。重要的是应妥善 保管所有原始资料以便对 CRF 上的数据进行原始资料的核对
佰荣泰华 - 临床试验,新药 - 2017-04-25
为您找到相关结果约160个