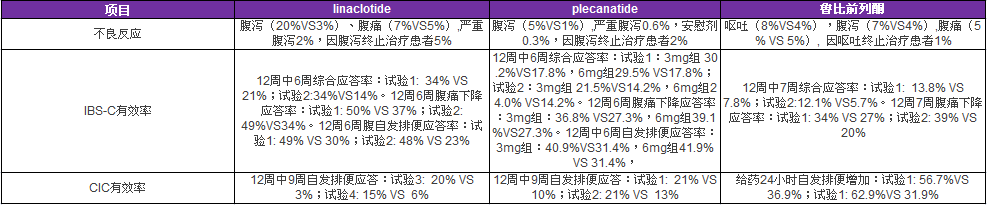
FDA批准首个狼疮肾炎口服新药
1月22日,Aurinia制药公司宣布FDA批准Lupkynis(voclosporin,伏环孢素)上市,联合免疫抑制疗法治疗成人活动性狼疮肾炎(LN)。Lupkynis是FDA批准的首个狼疮肾炎口服
医药魔方 - 狼疮肾炎 - 2021-01-25
FDA:葛兰素史克HIV新药Tivicay获FDA批准
葛兰素史克(GSK)8月12日宣布,FDA已批准Tivicay(dolutegravir)50mg片剂。Tivicay新药申请(NDA)的提交,包括4个关键性III期临床试验(SPRING-2、SINGLE、SAILIN
生物谷 - 新药,FDA - 2013-08-15
科技日报:现在新药审评审批提速了,进医保进医院难怎么破
“国家鼓励创新,创新药更需要政策的扶持。”10月16日,浙江贝达药业有限公司董事长丁列明在接受科技日报记者采访时说。众所周知,新药研发有“两高一长”之说:高投入、高风险、长周期。一款新药从开始研发到获批上市,需要经过10到15年的时间,花费至少要10亿美元。“新药研发非常不容易,而获批上市后进入临床应用的路仍很长。”丁列明说,药品集中招标采购、进医院难、药占比考核等都成为横亘在我国新药研发企
科技日报 - 科技日报,新药审批,医保 - 2018-10-17
FDA:2021年共批准49个新药
2021年以来,美国食品药品监督管理局(FDA)下设的药审中心(Center for Drug Evaluation and Research, CDER)批准了49个新药(New Molecular
美柏医健 - FDA - 2021-12-29
吉利德丙肝新药Sovaldi获FDA批准
吉利德(Gilead)12月6日宣布,丙肝新药Sovaldi(sofosbuvir,400mg片剂)获FDA批准,作为抗病毒治疗方案的一部分,用于慢性丙型肝炎(HCV)的治疗。具体而言,FDA已批准sofosbuvir联合利巴韦林(ribavirin)
生物谷 - 新药,FDA - 2013-12-10
乳腺癌新药获美国FDA批准
在国庆长假前夕,美国FDA传来喜讯。今日,FDA宣布批准礼来(Eli Lilly)公司的Verzenio(abemaciclib)上市,与fulvestrant联用治疗HR阳性、HER2阴性的晚期或转移性乳腺癌成人患者。FDA也批准Verzenio单独使用,治疗接受过内分泌疗法与化疗,癌症却出现转移的同一患者群体。本款新药的获批上市,将为诸多患者带
“药明康德”微信号 - 乳腺癌,新药,FDA - 2017-09-29
2017年FDA批准的41个新药
截止目前,CDER已经批准了41个新分子实体,还有2个药物的PDUFA最后期限落在12月,如12月间FDA不加速批准新药,那么2017年获批的新分子实体可能是41-43个。当然本文所涉及的新药,均为 CDER 受理的 NDA 或 BLA,并不包括CBER审评的品种,如 CAR-T 产品。相对去年的20来个,今年算是一个丰收年。
科睿唯安生命科学与制药 - FDA,新药 - 2017-12-06
FDA对新药说“不”原因大解密
新药研发是一个漫长而昂贵的过程,从开展最初的临床测试到新产品通过审批上市平均要花费8年的时间。各国药监部门对新药上市有严格的审批标准,新药上市前新药开发人员必须提供充足的药物安全性和有效性数据。新药上市申请失败,对防止无效或有害新药进入市场、维护患者生命安全具有重要意义。但是,许多新药上市失败,并不是因为药物不安全或无效,而是由于厂商提供给FDA的新药信息不足以支持新药上市。由于新药上市申
新康界 - 新药研发,FDA审批 - 2015-07-16
2017上半年FDA批准的新药
2017上半年FDA共批准23个新药,包括16个新分子实体和7个新生物制品。这个数字已经超过2016年全年批准的新药数量总和。近20年来批准新药数量最多的年份是2015年的45个,上半年批准了14个新药。如果按此趋势持续下去,2017年批准的新药数量将创下历史新高。
新浪医药 - FDA,新药 - 2017-06-28
评审专家:国家自然基金上会评审若干情况介绍
这些天网上有不少老师就国家自然基金的各种情况作了介绍,也有不少朋友晒了自己的基金评语,可是还没有一个参加会评(自然基金会议评审)的朋友介绍有关情况,为 了减少疑问,我作为今年的上会评审专家介绍一些有关基金最后阶段评审的一些情况
科学网 - 国家自然基金,上会,评审 - 2015-09-14
FDA批准的抗癌新药74%没用
近日,美国密尔沃基一本叫做《Sentinel and MedPage Today》的杂志发表一篇文章分析过去10年FDA批准上市的抗癌药,结果发现在54个上市新药中有74%的药物没有证据显示能延长患者寿命在2004-2011年上市的26个新药中只有3个显示能延长患者寿命而且还不是很长。文章作者质疑是否患者和支付部门应该为疗效不确定但动辄10万美元一年的高药价买单。
美中药源 - 抗癌新药 - 2014-11-04
2014上半年FDA批准的新药
2014年已走过一半时间,仅从FDA的新药审批结果来看,医药行业吹来暖风。2014上半年FDA批准了18个新药,相比2013上半年有明显增长。由于2012年小型制药企业递交新药上市申请的数量激增,FDA的新药批准数量在2012年达到了39个的历史高点。随着2013年FDA批准的新药数量急剧下降至27个,人们也开始对全球新药研发
生物探索 - 新药,FDA - 2014-07-02
2012年1月FDA批准新药概况
从FDA网站获悉,2012年1月批出生物制剂新药1个,新分子实体(NME)药品3个,新剂型药品3个。涉及辉瑞、基因泰克、GILEAD等多家医药企业。表:2012年1月FDA批准新药 商品名 通用名(中文) 公司 规格 剂型 批准类型 批准日期 VORAXAZE GLUCARPIDASE
MedSci原创 - FDA,新药 - 2012-02-04
2012财年FDA共批准的35个新药
2012财年(2011年10月1日-2012年9月30日),FDA共批准了35个新药,和去年持平【FDA:2011财政年度批准的创新性新药】。其中,12个是优先药物,23个是常规药物[列表]。77%的药物是首轮评审即获批,75%的药物在美国得到第一个审核。这些新药中包括10个癌症药物,首个脐带血来源药物Hemacord,以及十年来首次获批的两个减肥药物:Qsymia 和Lorcaseri
MedSci原创 - FDA,新药 - 2012-12-09
为您找到相关结果约500个