吉利德丙肝新药Sovaldi获FDA批准
吉利德(Gilead)12月6日宣布,丙肝新药Sovaldi(sofosbuvir,400mg片剂)获FDA批准,作为抗病毒治疗方案的一部分,用于慢性丙型肝炎(HCV)的治疗。具体而言,FDA已批准sofosbuvir联合利巴韦林(ribavirin)
生物谷 - 新药,FDA - 2013-12-10
FDA:葛兰素史克HIV新药Tivicay获FDA批准
葛兰素史克(GSK)8月12日宣布,FDA已批准Tivicay(dolutegravir)50mg片剂。Tivicay新药申请(NDA)的提交,包括4个关键性III期临床试验(SPRING-2、SINGLE、SAILIN
生物谷 - 新药,FDA - 2013-08-15
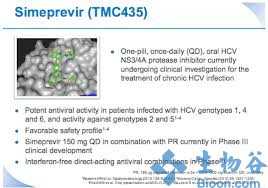
强生丙肝新药OLYSIO(simeprevir)获FDA批准
强生(JNJ)11月22日宣布,丙肝新药OLYSIO(simeprevir)已获FDA批准,联合聚乙二醇干扰素和利巴韦林(ribavirin),用于基因型1慢性丙型肝炎成人患者代偿性肝脏疾病(包括肝硬化此前,FDA已于今年5月授予simeprevir新药申请(NDA)优先审查资格,同时该药于今年10月获得了FDA顾问委员会建议批准的积极意见。 Simeprevir监管文件的提交
生物谷 - 新药,FDA - 2013-11-25
抗疟疾新药获FDA优先审评资格
近日,60 Degrees Pharmaceuticals(60P)宣布,美国FDA授予其预防成人疟疾药物Tafenoquine (TQ)优先审评资格。2018年1月,该药物获得FDA的快速通道资格。
药明康德 - Tafenoquine,FDA,优先审评 - 2018-02-12
FDA 上半年批准的新药汇总
今天汇总一下FDA上半年批准的新药,共26款,Q1和Q2各13款,要显著多于去年上半年的16款。其中辉瑞表现强劲,获得三款新药批准。
药研网 - 新药汇总 - 2023-07-14
这种新型降糖药有望开发成抗脂肪肝新药!
在2型糖尿病患者中,非酒精性脂肪性肝病(NAFLD)很常见,并可发展为严重肝脏疾病,即非酒精性脂肪性肝炎(NASH)。现在一项研究发现,empagliflozin是一种新型的2型糖尿病治疗药物,可减少NAFLD和糖尿病患者的肝脏脂肪。这项名为E-LIFT试验的随机对照研究的结果将在周一举行的内分泌学会第100届年会上在伊利诺伊州芝加哥举行,会议将在最新一期的摘要会议上公布。
来宝网 - 糖尿病,脂肪肝,新药 - 2018-03-20
乳腺癌新药获美国FDA批准
在国庆长假前夕,美国FDA传来喜讯。今日,FDA宣布批准礼来(Eli Lilly)公司的Verzenio(abemaciclib)上市,与fulvestrant联用治疗HR阳性、HER2阴性的晚期或转移性乳腺癌成人患者。FDA也批准Verzenio单独使用,治疗接受过内分泌疗法与化疗,癌症却出现转移的同一患者群体。本款新药的获批上市,将为诸多患者带
“药明康德”微信号 - 乳腺癌,新药,FDA - 2017-09-29
2017上半年FDA批准的新药
2017上半年FDA共批准23个新药,包括16个新分子实体和7个新生物制品。这个数字已经超过2016年全年批准的新药数量总和。近20年来批准新药数量最多的年份是2015年的45个,上半年批准了14个新药。如果按此趋势持续下去,2017年批准的新药数量将创下历史新高。
新浪医药 - FDA,新药 - 2017-06-28
FDA对新药说“不”原因大解密
新药研发是一个漫长而昂贵的过程,从开展最初的临床测试到新产品通过审批上市平均要花费8年的时间。各国药监部门对新药上市有严格的审批标准,新药上市前新药开发人员必须提供充足的药物安全性和有效性数据。新药上市申请失败,对防止无效或有害新药进入市场、维护患者生命安全具有重要意义。但是,许多新药上市失败,并不是因为药物不安全或无效,而是由于厂商提供给FDA的新药信息不足以支持新药上市。由于新药上市申
新康界 - 新药研发,FDA审批 - 2015-07-16
2012年1月FDA批准新药概况
从FDA网站获悉,2012年1月批出生物制剂新药1个,新分子实体(NME)药品3个,新剂型药品3个。涉及辉瑞、基因泰克、GILEAD等多家医药企业。表:2012年1月FDA批准新药 商品名 通用名(中文) 公司 规格 剂型 批准类型 批准日期 VORAXAZE GLUCARPIDASE
MedSci原创 - FDA,新药 - 2012-02-04
2012年4月FDA批准新药概况
2012年4月,FDA批出新分子实体药品2个,分别为用于诊断阿尔茨海默病的分子显影剂AMYVID和用于治疗勃起性功能障碍的STENDRA。表:2012年4月FDA批准新药 商品名 通用名(中文) 公司 规格 剂型
米内网 - 新药,FDA - 2012-05-24
FDA批准的抗癌新药74%没用
近日,美国密尔沃基一本叫做《Sentinel and MedPage Today》的杂志发表一篇文章分析过去10年FDA批准上市的抗癌药,结果发现在54个上市新药中有74%的药物没有证据显示能延长患者寿命在2004-2011年上市的26个新药中只有3个显示能延长患者寿命而且还不是很长。文章作者质疑是否患者和支付部门应该为疗效不确定但动辄10万美元一年的高药价买单。
美中药源 - 抗癌新药 - 2014-11-04
2012年5月FDA批准新药概况
2012年5月,FDA批出新分子实体药品1个,新剂型药品2个,新复方剂型药品1个。新分子实体药品为治疗罕见遗传疾病——戈谢病的ELELYSO。新剂型药品分别有他扎罗汀泡沫剂和异维甲酸胶囊。表:2012年5月FDA批准新药 商品名 通用名(中文) 公司 规格 剂型
米内网 - 新药,FDA - 2012-06-12
2012财年FDA共批准的35个新药
2012财年(2011年10月1日-2012年9月30日),FDA共批准了35个新药,和去年持平【FDA:2011财政年度批准的创新性新药】。其中,12个是优先药物,23个是常规药物[列表]。这些新药中包括10个癌症药物,首个脐带血来源药物Hemacord,以及十年来首次获批的两个减肥药物:Qsymia 和Lorcaseri
MedSci原创 - FDA,新药 - 2012-12-09
为您找到相关结果约500个