FDA 指南:人体处方药和生物制品--根据重量或可使用容器的体表面积对剂量进行标记--"剂量带"
本指南中的建议和例子与以下情况有关:申请人(1)提议为可注射药物产品开发具有各种不同长处的现成容器,以及(2)试图将剂量段幅信息纳入根据先前核准的药物产品的剂量信息而根据重量或BSA提供的处方信息。
FDA官网 - 生物制品,人体处方药 - 2023-10-08
2015获批上市新药哪些会成“重磅炸弹”?
2015年早些时候,汤森路透Cortellis竞争情报对“值得期待的药物”(Drugs To Watch)做出预测,预计2015年进入市场、有望成为“重磅炸弹”的药物超过2014年。2015年获批/上市药物中,2019年销售额预计超过10亿美元的共11种(2014年仅有3种)。而就目前情况看,除了预期所列药物外,还有其他几种2015年获批和(或)进入市场的药物有望在今后5年内跻身“重磅炸弹”药
汤森路透 - 汤森路透,新药 - 2016-01-07
CDE新增14条常见一般性技术问题解答:化学药品仿制药能否直接申报上市许可申请?
CDE官网更新了“常见一般性技术问题解答”,新增了14条,目前常见一般性技术问题解答共计114条,以下为此次新增的解答。
医谷网 - 化学药品,上市许可,问题解答 - 2020-12-05
耳眼科药Eylea再度刷新记录——DR市场将赶超罗氏Lucentis
导读:自2011年上市以来,拜耳眼科药物Eylea适应症个数及全球销售一再刷新。今年7-8月,Eylea先后获FDA和欧盟批准,用于糖尿病性黄斑水肿(DME)适应症,是该药在欧美市场收获的第3个适应症。近日,Eylea再次刷新记录,获全球第3大市场——日本批准,用于病理性近视继发脉络膜新生血管(mCNV)适应症。 日本获批mCNV适应症 拜耳(Bayre)和Regeneron制药本周一宣布,眼
生物谷 - 耳眼科药,Eylea - 2014-09-26
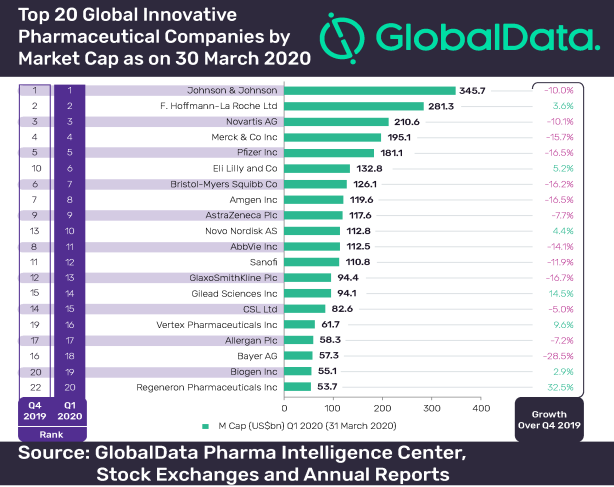
2020 Q1各大药企收入排名,强生,罗氏,诺华,默沙东,辉瑞,礼来,阿斯利康......
4月份,强生,礼来,GSK,辉瑞、诺华、默沙东相继发布了2020年第一季度财报。在疫情的笼罩之下,今年注定是不平凡的一年。而对于跨国药企而言,其开年业绩就上演了“王座更迭”的戏
MedSci原创 - 辉瑞,罗氏,药企,阿斯利康,强生,诺华 - 2020-05-03
医改40年巡礼:药审改革为患者用上新药好药持续发力
改革开放以来,伴随着从“富起来”到“强起来”的前进脚步,人民群众的用药水平也实现了从“有药治病”到“尽快用上新药好药”的历史性转变。党的十八大以来,人民群众用得上、用得起新药好药的获得感快速提升。
中国医药报 - 药审改革,新药好药 - 2018-11-30
礼来公司发布2021年第二季度财报
与2021年第一季度相比,礼来加快了全球最新药物的使用,实现了连续增长。
MedSci原创 - 心衰,新药,阿尔茨海默病,礼来,新冠抗体,新冠变异体 - 2021-08-05
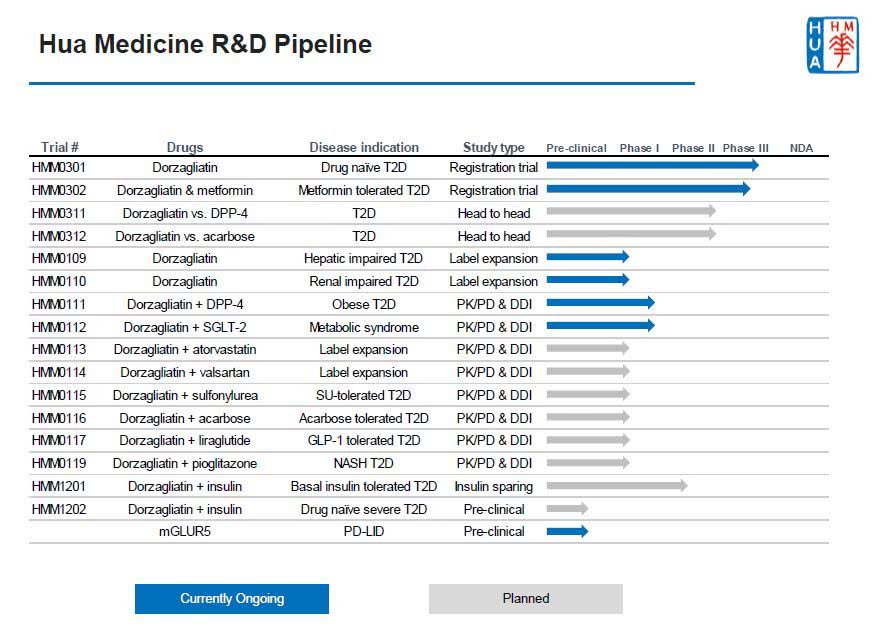
中国糖尿病创新药Dorzagliatin达到3期临床主要疗效终点,可降低HbA1c 1.07%
Dorzagliatin是基于葡萄糖激酶(glucokinase,GK) 作为血糖传感器,在血糖稳态调控中发挥核心作用的全球领先科学概念而开发。通过修复成年2型糖尿病患者下降的GK功能,重塑血糖稳态,而实现治疗2型糖尿病。Dorzagliatin分子结构式(图片来源:durgbank.ca) 华领医药在中国同时开展2项52周的3期注册临床研究,此次公布的是在从未接受过糖尿病药物治疗的
华领 - 糖尿病,Dorzagliatin - 2019-11-12
欧盟批准诺华的IL-17单抗Cosentyx,用于治疗非放射线轴性脊柱关节炎
此次批准使Cosentyx(secukinumab)成为首个获准用于非放射线轴性脊椎关节炎的全人源IL-17A单抗。
MedSci原创 - 非放射线轴性脊柱关节炎,IL-17单抗Cosentyx - 2020-05-01
CD47单克隆抗体初露锋芒!天镜生物多项研发管线产品齐头并进
2020年11月,天境生物被《麻省理工科技评论》评选为“50家最聪明的公司”之一。
MedSci原创 - 美国FDA,艾伯维,CD38单抗 - 2021-04-09
吉利德和默沙东双双出手,ADC领域四年后有望诞生超10亿美金新药
近日,两家药企完成了两项重磅交易,均涉及(抗体偶联)ADC药物领域——一项是吉利德以210亿美元收购以肿瘤学为重点的Immunomedics;另一项则是默沙东以45亿美元与Se
亿欧 - 默沙东,吉利德,ADC - 2020-09-15
肝药物获批上市 艾伯维开始逆袭
对于全球1.8亿丙肝患者来说,2014年12月19日有一则消息值得庆贺:美国FDA批准药物 Viekira Pak用于治疗一型丙肝治疗,包括有肝硬化的患者。这结束了此前吉利德旗下Harvoni独占丙肝市场的格局。 这一则以《颤抖吧!吉利德》为题的新闻,在短短一天内迅速覆盖了中国的社交网站。
中国财经网 - 肝药,艾伯维 - 2015-01-06
FDA指南:以电子格式提交——上市后安全报告
本指南是一系列指导文件中的一份,旨在帮助行业以电子格式向 FDA 药物评价与研究中心 (CDER) 和生物制品评价与研究中心 (CBER) 提交某些监管文件。本指南根据以下规定提供了关于以电子方式提交
FDA - 上市后安全报告 - 2022-08-06
JAMA:FDA审批新药速度过快或存在安全隐患
FDA药物研究与评估中心负责人指出,医学团体和公众敦促FDA加快新药审批流程,而不是更谨慎地评估一种新药。 两位药物安全专家表示,FDA致力于加快审批预防中风、癌症和多发性硬化症新药上市,但这些新药没有经过全面的安全分析。
网络 - FDA,新药,安全隐患 - 2012-09-20
欧洲药监机构就替格瑞洛临床试验问题向阿斯利康进行询问
欧洲药品监管机构已经写信给阿斯利康,要求阿斯利康提供更多有关美国调查其心脏病新药替格瑞洛的信息。阿斯利康正依靠替格瑞洛作为近期销售与利润增长的一个关键驱动因素,美国司法部(DOJ)对这款药物发起一项调查的不同寻常决定增加了人们对这款产品未来的担忧。位于伦敦的欧洲药品管理局(EMA)于11月7日表示,在阿斯利康于10月31日披露了DOJ的调查之后,该机构已与该英国第二大制药商进行了接触。“EMA重视
丁香园 - 替格瑞洛,欧洲药监,临床试验,阿斯利康 - 2013-11-11
为您找到相关结果约500个