颠覆性创新直线下降,科学家开始“谨小慎微”了?
近年火热的人工智能,或许能提供帮助,让科学家从平庸的重复中解放出来,有更多时间和精力思考更重要的问题。
深究科学 ID: deepscience - 创新,人工智能 - 2023-01-29
FDA有望在2023年内批准第一款癌症疫苗上市——黑色素瘤疫苗
上个月,美国FDA授予一款黑色素瘤疫苗“突破性”地位,这意味着它有望在几个月内就获得批准。这款疫苗可降低44%的死亡率,是人类医疗史上又一里程碑!事实上,2022年报道的2b研
MedSci原创 - 癌症疫苗,个体化癌症疫苗,黑色素瘤疫苗 - 2023-03-24
Alnylam的RNAi疗法Vutrisiran获得FDA快速通道指定,治疗hATTR淀粉样变性
RNAi疗法vutrisiran靶向和沉默特定的信使RNA,从而阻止野生型和突变型甲状腺素转运蛋白(TTR)的产生。
MedSci原创 - hATTR淀粉样变性,FDA快速通道指定,RNAi疗法vutrisiran - 2020-04-15
FDA 行业指南草案:实时肿瘤学审查 (RTOR)
本指南的目的是就提交选定的新药申请 (NDA) 和生物许可申请 (BLA) 的流程向申请人提供建议,并在实时肿瘤学审查 (RTOR) 下进行审查。
FDA官网 - 实时肿瘤学审查 - 2022-08-10
图表分析:话说2014年度FDA批准的那些药物
2014年,FDA药物评价和研究中心(CDER)审批通过了41个新药(Novel New Drugs),包括新药申报(NDAs)批准的新分子实体(NMEs)和生物制品申报(BLAs)批准的新生物药,数量是自1996年以来最多的。2014年FDA批准的新药有几个特点:治疗罕见病的孤儿药的批准比往年都多;今年批准的一半以上药物为“优先审查”(Priority Review),比现有的药物有了改善;FD
创药网 - FDA,2014年度,药物 - 2015-03-31
重磅发布:烯旺科技热垫式治疗仪获得国内首张石墨烯二类医疗器械注册证
9月25日,石墨烯行业领军企业烯旺科技在北京清华科技园发布了最新石墨烯医疗成果,正式宣布其自主研发的热垫式治疗仪获得国内首张石墨烯二类医疗器械注册证书,引发行业震动。
医谷 - 签,石墨烯医疗器械,注册证书,热垫式治疗仪,烯旺科技 - 2019-09-25
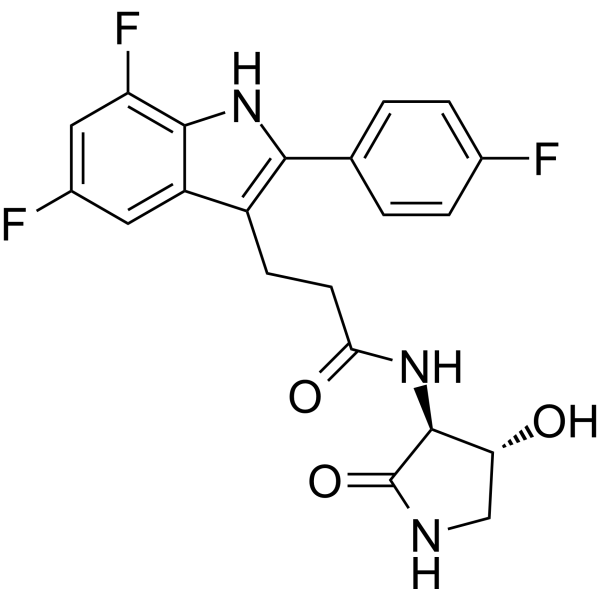
NEJM:Inaxaplin治疗两种 APOL1 变异体的蛋白尿肾病(VX19-147-101研究)
APOL1介导性肾病是一种由APOL慢性肾病是由基因突变引起的。遗传功能增益性肾病(gain of function)APOL由基因突变产生的蛋白质会导致足细胞损伤。这种损伤破坏了正常的肾脏过滤功能,
网络 - inaxaplin,蛋白尿肾病 - 2023-03-16
君实生物完成向美国FDA滚动提交特瑞普利单抗治疗鼻咽癌的上市申请
北京时间2021年9月1日,君实生物(1877.HK,688180.SH)宣布,公司已完成向美国食品药品监督管理局(FDA)滚动提交关于特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一
君实生物 - PD-1单抗 - 2021-09-01
FDA指南:实时肿瘤学评论(RTOR)行业指南
本指南不涉及FDA的加速项目,如快速通道指定,突破性治疗指定或优先审查指定。关于这些加速项目的更多信息可以在2014年5月的《严重疾病加速项目行业指南-药物和生物制品》中找到。
FDA指南 - 肿瘤学 - 2023-11-10
对症遗传病,第一例基因治疗来得晚了些
12月19日,美国食品和药物管理局(FDA)批准第一例基因疗法治疗遗传性疾病。相较于此前获批的癌症基因疗法——美国8月和10月批准的两种CAR—T细胞免疫疗法,此次针对遗传性疾病的基因治疗虽然早在理论上被证实可行,但在实践中却慢了一步。
科技日报 - 遗传病,基因疗法 - 2017-12-26
FDA授予罗氏抗癌药Alecensa第2个突破性药物资格,一线治疗ALK+NSCLC领域即将上演巅峰对决
美国食品和药物管理局(FDA)已授予口服靶向抗癌药Alecensa(alectinib)第2个突破性药物资格(BTD),用于之前未接受ALK抑制剂治疗的晚期间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌(NSCLCAlecensa是一种ALK抑制剂,之前,FDA于2013年首次授予该药突破性药物资格,用于既往
生物谷 - 罗氏,Alecensa,Alectinib,间变性淋巴瘤激酶,非小细胞肺癌,ALK,NSCLC - 2016-10-06
FDA授予AAV基因疗法PBGM01"孤儿药"称号,治疗婴儿GM1神经节苷脂贮积症
PBGM01是一种AAV基因疗法,通过将编码β-gal的GLB1基因递送到大脑,来降低GM1神经节苷脂的积累,从而逆转神经元毒性。
MedSci原创 - GM1神经节苷脂贮积症,基因疗法PBGM01,"孤儿药"称号 - 2020-06-03
FDA警告:Keytruda和Tecentriq疗效并不优于化疗 | 杨森精神分裂症药物获批上市..
来自监督委员会的早期审查中的两项分别对两种药物的单独研究发现,接受低水平PD-L1抑制剂免疫疗法患者的生存几率低于选择正常铂化疗的患者。
药研发 - 精神分裂症 - 2018-05-25
FDA授予CAR-T癌症疗法CLBR001 + SWI019“快速通道称号”
美国FDA已授予Calibr研发的新型“可切换”CAR-T细胞疗法CLBR001 + SWI019“快速通道称号”,以加快药物开发和审查。
MedSci原创 - CAR-T疗法,CAR-T细胞,CLBR001 + SWI019,快速通道称号,Calibr - 2020-10-02
为您找到相关结果约500个