原创新药加速赛跑,生物医药创制的上海进行时
中国的新药的研制,一直是我们国家重大战略的需求,也是我们国家重要的研究计划。加强原创新药的研发,是中国从医药大国向医药强国发展的必由之路。 5月24日,由上海市科协、新民晚报和中国科学院上海药物研究所联合主办的新民科学咖啡馆上海科技节特别专场在上海科学会堂成功举办。会议特邀中国科学院院士、中国科学院上海药物研究所研究员蒋华良和上海市药品监督管理局副局长张清作报告,聚焦生物医药创制的上海进
美通社 - 生物医药,研发 - 2019-05-29
Arthritis Rheumatol:需要研发治疗幼年特发性关节炎的新药
尽管目前已批准将bDMARD用于JIA,但仍然需要其他药物来控制JIA的体征和症状。
MedSci原创 - JIA,幼年特发性关节炎,bDMARD - 2020-06-17
Kineret(anakinra)在英国批准用于罕见炎症性疾病的治疗
已被推荐用于治疗类风湿关节炎,但该药的半衰期短,需要每天注射,与抗TNF的药物相比,Anakinra的临床疗效中等,因此其临床使用较局限。但是,继欧洲药品管理局(EMA)授权后,Kineret®(anakinra)在英国和爱尔兰共和国(RoI)已被批准用于治疗患有系统性青少年特发性关节炎(SJIA)和成人发病的静脉疾病(AOSD)的英
MedSci原创 - anakinra,IL-1,炎症 - 2018-07-16
FDA批准Buntanetap治疗帕金森病的3期临床试验
阿尔茨海默病(AD)和帕金森病都是老年人中最常见的神经退行性疾病,它困扰全球上千万患者和他们的家人。有没有一种药物同时能治疗这两种疾病的?2021年5月,Annovis Bio公司宣布,该公司的在研疗
MedSci原创 - 帕金森病 - 2022-08-05
EMA支持批准Amgen的Neulasta的第一个生物仿制药版本
欧洲药品管理局人用医疗产品委员会(CHMP)周五(2018年7月27日)公布了积极意见,建议将Accord Healthcare的Pelgraz和Coherus BioSciences的Udenyca列为Amgen's Neulasta(pegfilgrastim)的生物仿制药。Accord和Coherus都指出,如果获得批准,这些产品可能是首批进入欧盟市场的Neulasta生物仿制药
MedSci原创 - Neulasta,聚乙二醇化非格司亭,EMA - 2018-07-28
Pharmacoepidemiol Drug Saf:FDA和EMA重点审查药品批准的差异性
背景:美国食品和药品监督管理局(FDA)优先审查适用于目前有显著改善作用的替代品药品。欧洲药品管理局(EMA)加速批准适用于重大公共卫生健康的药品。本研究的目的是评估FDA和EMA批准的重点审查的新分子实体和新治疗效果生物制品的不同特点。方法:本研究包括1999 - 2011年期间FDA和EMA的新药申请,审批,适应症,孤儿药所有优先审查药物的监管信息。采用描述性统计、t-检验
MedSci原创 - FDA,EMA,重点审查药品 - 2015-05-29
Urovant Sciences宣布提交Vibegron治疗膀胱过度活动症的新药申请
Urovant Sciences今天宣布,已向美国FDA提交了新药申请(NDA),以寻求批准Vibegron治疗膀胱过度活动症(OAB)患者的急迫性尿失禁、尿急和尿频症状。
MedSci原创 - Vibegron,膀胱过度活动症,Urovant - 2019-12-31
CANCER DISCOV:面对不断进化的肿瘤,我们该如何设计新药?
对于肿瘤治疗来说,一个关键性的难题是患者会产生耐药性。肿瘤适应药物并最终产生耐药性的过程称之为肿瘤进化。肿瘤进化的能力源自于肿瘤的多样性,每位患者体内的不同肿瘤,甚至同一肿瘤中的癌细胞都可能带有不同的基因或表观遗传学改变。在抗肿瘤药物的压力下,带有特定突变的癌细胞会具有生存上的优势,这些细胞便能以牺牲其它细胞为代价继续扩张,这就是肿瘤进化的过程。
药明康德 - 肿瘤,新药,治疗 - 2017-07-25
首款iPSC衍生的CAR-T细胞疗法:IND已获FDA批准
Fate Therapeutics是一家临床阶段的生物制药公司,致力于开发抗癌症和免疫疾病的细胞免疫疗法,今日宣布,美国FDA已批准FT819的研究性新药申请(IND)。
MedSci原创 - iPSCs,慢性淋巴细胞性白血病,Car-T细胞疗法 - 2020-07-11
“时代楷模王逸平的新药记忆”档案展在沪举行
中国科学院上海药物研究所于2019年6月10日举行“时代楷模王逸平的新药记忆”主题档案展,为期一周。据悉,此主题档案展旨在结合国际档案日、中国科学院“新药梦想?
科学网 - 时代楷模,王逸平,档案展 - 2019-06-11
FDA批准的PD-1适应症及使用剂量总览
PD-1/PD-L1免疫疗法(immunotherapy)是当前全世界备受瞩目、广为研究的新一类抗癌免疫疗法,旨在充分利用人体自身的免疫系统抵御、抗击癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,实质性改善患者总生存期。目前,全球最热门的两大PD-药物KEYTRUDA(pembrolizumab)”、“Opdivo(nivolumab)”自2014年以来,一路
全球肿瘤医生网 - PD-1,适应症,FDA - 2017-09-28
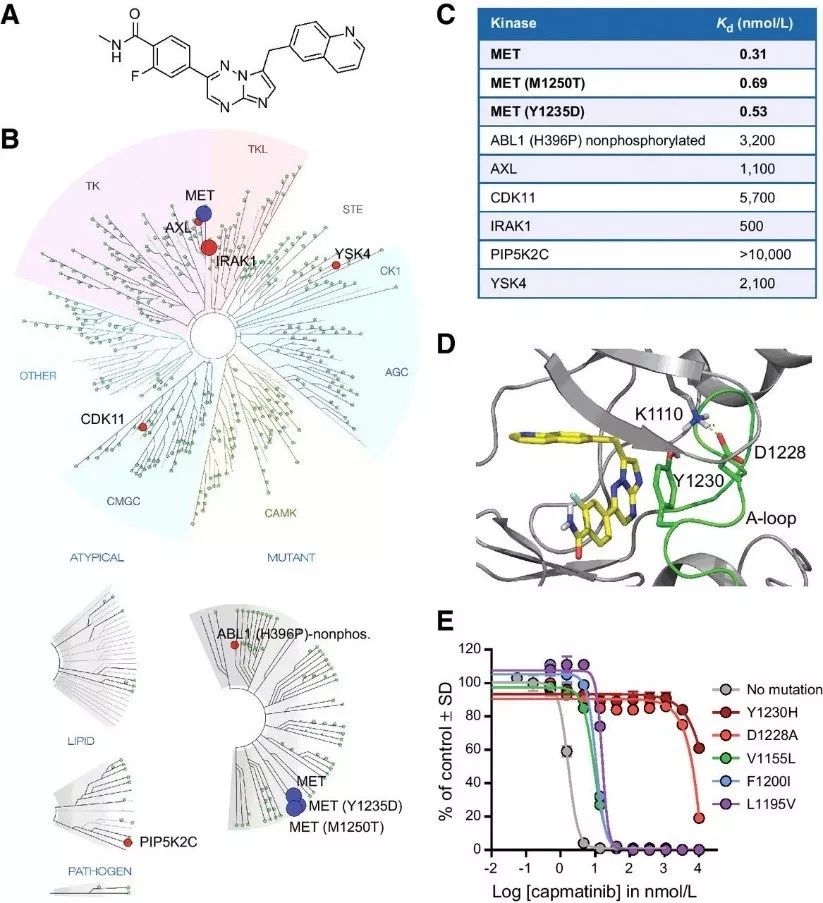
FDA:批准MET抑制剂capmatinib上市用于MET突变NSCLC的治疗
诺华(Novartis)公司宣布,美国FDA批准其MET抑制剂Tabrecta(capmatinib)上市,治疗携带MET基因外显子14跳跃突变的晚期非小细胞肺癌(NSCLC)患者。这些患者的基因突变
MedSci原创 - NSCLC,Capmatinib - 2020-05-07
Daiichi Sankyo的Turalio成为FDA批准的首个腱鞘巨细胞瘤治疗药物
美国食品和药物管理局周五宣布,已批准Daiichi Sankyo的CSF1抑制剂Turalio(pexidartinib)用于治疗对手术治疗无效、并伴有严重发病率或功能受限的症状性腱鞘巨细胞瘤(TGCT
MedSci原创 - Daiichi,Sankyo,Turalio,FDA,腱鞘巨细胞瘤 - 2019-08-05
开发一个新药的平均成本:最新数据26亿美元
开发一个新药到底需要花多少钱多年来一直是一个争论不休的话题。计算模式不同给出的结果会大相庭径,从少到5亿美元到福布斯的近50亿美元不等。引用最频繁的数字莫过于塔夫茨(Tufts)药物开发研究中心在2003年发表的数据8.02亿美元。然而新药开发越来越难,相应地开发成本也大幅度上升。这不仅是因为通货膨胀,监管的门槛也越来越高。比如自2000年以后血液指标逐渐成为临床开发的辅助数据,临床指标的改善
美中药源 - 新药,数据 - 2014-11-21
默沙东失眠药Belsomra终于获FDA批准——如何突围成新的挑战
默沙东(Merck & Co)失眠药物Belsomra(suvorexant)终于获得了FDA的批准。此前,FDA于2013年曾因安全性问题拒绝批准该药的新药申请(NDA),但为低剂量Belsomra打开了大门。然而,即便现在获得FDA批准,但目前失眠市场已被大量仿制药充斥,如何突围是摆在默沙东面前的新挑战。 默沙东8月13日宣布,FDA批准Belsomra(suvorexant)用
生物谷 - FDA,失眠药 - 2014-08-15
为您找到相关结果约500个