FDA批准了Intellipharmaceutics的文拉法辛盐酸缓释胶囊
Intellipharmaceutics制药是一家专注于研究、开发和制造新型和通用型控释和缓释口服固体药物的制药公司,该公司近日宣布,美国食品和药物管理局已经批准了该公司的37.5、75和150毫克剂量强度的文拉法辛盐酸缓释胶囊
MedSci原创 - 文拉法辛盐,缓释胶囊,Intellipharmaceutics - 2018-11-28
中国NMPA批准Chipscreen Bioscience的Chidamide(Epidaza)用于乳腺癌
深圳市奇普生物科技有限公司(Chipscreen Bioscience)宣布,该公司的Epidaza®(Chidamide)是一种口服选择性组蛋白脱乙酰基酶(HDAC)抑制剂,先前已批准用于复发性和难治性外周血近日被NMPA批准用于治疗激素受体(HR)阳性、HER2阴性晚期乳腺癌(ABC)患者。
MedSci原创 - Chidamide(Epidaza),NMPA,乳腺癌 - 2019-11-30
EMA:Aegerion高胆固醇血症新药Lojuxta获EMA批准
美国生物制药公司Aegerion制药今天宣布,欧洲药品管理局(EMA)已批准将Lojuxta(lomitapide)硬胶囊作为低脂肪饮食及其他降脂药用产品的一种辅助药物,用于纯合子家族性高胆固醇血症(HoFH
生物谷 - 新药,EMA - 2013-08-07
FDA批准Lenvatinib+依维莫司联合治疗晚期肾癌
FDA基于一项纳入了153名晚期或转移性肾癌患者的多中心研究结果的基础上,扩大了Lenvatinib的使用,批准该药物联合依维莫司治疗既往接受抗血管生成治疗的晚期肾细胞癌患者。
MedSci原创 - 依维莫司,lenvatinib,肾癌 - 2016-05-17
FDA批准Humira生物类似物Hulio(adalimumab-fkjp)
美国FDA已批准了Humira(adalimumab)生物类似物Hulio(adalimumab-fkjp)。
MedSci原创 - 阿达木单抗(Humira),Hulio,adalimumab-fkjp - 2020-07-10
CHMP建议有条件批准强生结核病药物Sirturo
上周五,强生(JNJ)结核病药物Sirturo(bedaquiline,双芳基喹啉类抗结核药)获得了欧洲药品管理局(EMA)人用医药产品委员会(CHMP)的积极意见。CHMP建议授予Sirturo有条件上市许可(conditional marketing authorisation),将该药作为组合疗法的一部分,用于因耐药性或耐受性使得一种有效治疗方案不能用于其临床治疗的耐多药结核病(multid
生物谷 - 新药,FDA - 2013-12-26
NMPA批准中国首个曲妥珠单抗生物仿制药
曲妥珠单抗生物仿制药HLX02成为首个在欧洲获批的“中国籍”单抗生物仿制药。
MedSci原创 - 乳腺癌,胃癌,复宏汉霖,曲妥珠单抗生物仿制药HLX02 - 2020-08-20
13款药物获欧洲CHMP推荐批准 GSK独占3席
欧洲药品管理局(EMA)人用医药产品委员会(CHMP)近日召开9月份评审会议,推荐批准13款新药在欧盟上市
新浪医药 - CHMP,新药,上市 - 2017-09-19
FDA批准首个诊断脆性X综合征的基因测试
日前,美国FDA批准了首个用于检测遗传性疾病——脆性X综合征(FXS)的基因检测工具AmplideX® Fragile X Dx和载体筛选试剂盒。
新浪医药新闻 - FDA,脆性X综合征 - 2020-02-27
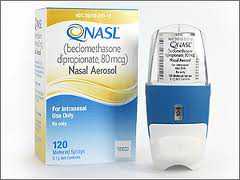
梯瓦(Teva)抗过敏喷鼻剂Qnasl获FDA批准
2012年3月26日,梯瓦(Teva)公司周一宣布,FDA批准其药物Qnasl用于鼻过敏症(nasal allergy symptoms)的治疗。Qnasl是处方药,将于4月份上市,该药已被批准用于12岁及以上患有季节性过敏或常年过敏患者。 梯瓦(Teva)公司的股票价格在今晨早盘交易中上涨50美分
生物谷 - 新药,FDA - 2012-04-16
ACADIA制药宣布FDA批准NUPLAZID(Pimavanserin)的新剂量和配方
ACADIA制药公司于2018年6月29日宣布FDA批准了NUPLAZID(pimavanserin)的新剂量和配方,以帮助治疗患有幻觉和与帕金森病精神病相关的妄想症患者
MedSci原创 - Pimavanserin,帕金森,ACADIA - 2018-06-30
日本厚生劳动省批准Vadadustat治疗慢性肾病引起的贫血
生物制药公司Akebia Therapeutics今日宣布,日本厚生劳动省已批准缺氧诱导因子脯氨酰羟化酶抑制剂vadadustat用于治疗慢性肾脏疾病(CKD)引起的贫血。
MedSci原创 - 贫血,慢性肾病,vadadustat - 2020-06-30
FDA批准新型胆固醇药物(PCSK9抑制剂)
美国FDA近日批准了新型降胆固醇药物。赛诺菲公司的Praulent (alirocumab)获得了FDA的批准,此外安进公司的Repatha(evolocumab)将在8月27日得到FDA的最终决议。
MedSci原创 - 胆固醇,新药,低密度脂蛋白 - 2015-07-27
FDA批准Marqibo治疗罕见急性淋巴细胞白血病
2012年8月9日,美国食品与药物管理局(FDA)通过加速审批程序批准了“孤儿药”Marqibo (硫酸长春新碱脂质体注射液)用于治疗罕见的成人费城染色体阴性(Ph-)的急性淋巴细胞白血病。
医学论坛网 - FDA,Marqibo,急性淋巴细胞白血病,费城染色体,硫酸长春新碱脂质体注射液 - 2012-08-14
Gabapentin口服液仿制药新药申请获得美FDA批准
Acella医药公司Gabapentin口服液仿制药申请(ANDA)获得美国食品药监局(FDA)批准。 FDA发现Acella仿制药申请的生物等效性上和治疗效果,和推荐药的是一样的。
中国医药123网 - 新药,FDA,Gabapentin - 2012-05-06
为您找到相关结果约500个