药审中心:临床试验缺失数据的统计学考量
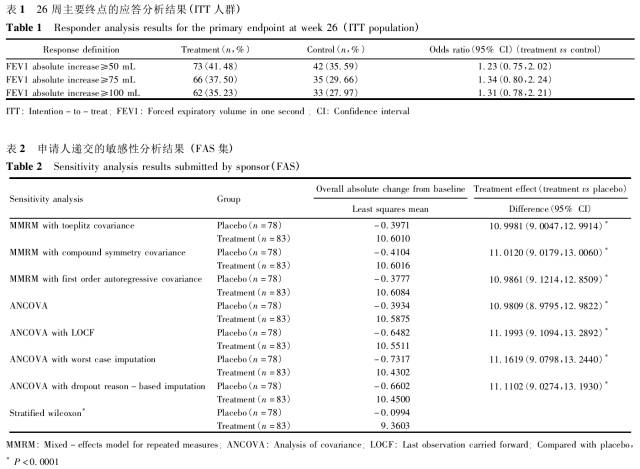
缺失数据是临床试验中常见的重要问题,可能引起试验结果难于解释,甚至影响整个试验的推断和结论,但目前在国内临床研究中尚未引起足够的重视。本文针对三个实际案例进行深入地阐述和分析,探讨对缺失数据的预防、估训一量的选择、缺失数据的统训一分析方法以及敏感性分析等,以期有助于申请人在临床试验中加强
中国临床药理学杂志 - 临床试验,缺失数据 - 2016-06-18
重磅:药品临床试验造假入刑《司法解释》已通过
最高法审委会全体会议审议并原则通过《最高人民法院、最高人民检察院关于办理药品、医疗器械注册申请数据造假刑事案件适用法律若干问题的解释》。
临床研究大汇 - 药品临床试验,造假,入刑 - 2017-04-11
上海开展子宫移植临床试验,为子宫性不孕患者圆梦!
据数据显示,我国目前大约有5000万不孕不育人群,10年前全国的不孕不育率大约在3%,现如今上升至了12%。
MedSci原创 - 子宫性不孕 - 2023-04-12
美国一款新冠病毒疫苗进入临床试验
目前,全球多种疫苗路线正齐头并进,中国沿着5条技术路线加速疫苗攻关工作。而北京时间3月5日,据美国生物技术公司Moderna官方宣称,美国食品药品监督管理局(FDA)已完成对该公司研制的新型冠状病毒m
科技日报 - 新冠病毒,疫苗 - 2020-03-11
Merimepodib治疗COVID-19的II期临床试验:即将开始
ViralClear制药公司已向美国FDA提交了新药研究(IND)申请,以开始Merimepodib治疗COVID-19的II期临床试验。
MedSci原创 - Covid-19,Merimepodib - 2020-04-26
临床试验中的核查/检查需要注意的关键要点
临床试验在CFDI审核之前需要经历一场大考,就是我们所说的临床试验核查。如果核查通过了,就等于之前所做的一切努力没有白费,团队的经验得到认可,能力也有质的飞越(感觉),投资人的来电响个不停...假如核
临床研发资讯 - 2020-03-29
抗肿瘤药联合治疗临床试验技术指导原则(2020年)
为鼓励抗肿瘤创新药研发,进一步规范抗肿瘤药联合用药临床试验设计,在国家药品监督管理局的部署下,药审中心组织制定了《抗肿瘤药联合治疗临床试验技术指导原则》(见附件)。根据《国家药监局综合司关于印发药品技
NMPA - 肿瘤 - 2021-02-09
药物临床试验富集策略与设计指导原则(征求意见稿)
为更精准的定义药物临床试验的目标人群,提高药物临床试验的研发效率,我中心组织起草了《药物临床试验富集策略与设计指导原则(征求意见稿)》,现在中心网站予以公示,以广泛听取各界意见和建议,欢迎各界提出宝贵
CDE - 临床试验,指导原则 - 2020-09-01
抗急性淋巴细胞白血病药物临床试验中检测微小残留病的技术指导原则(征求意见稿)
在急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)诊治过程中,微小残留病(Minimal residual disease,MRD)(或称可检测残留病 [Meas
CDE - 急性淋巴细胞白血病 - 2021-06-27
临床试验用药物生产质量管理规范(征求意见稿)
为落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,鼓励研究和创制新药,规范临床试验用药物的生产,国家药品监督管理局组织起草了《临床试验用药物生产质量管理规范(征
NMPA - 生产质量管理规范,生产质量 - 2022-08-09
针刺临床试验干预措施报告标准的修订:CONSORT声明的扩展
针灸临床试验报告干预标准 (STRICTA) 于 2001 年和 2002 年发表在五份期刊上。 这些指南以清单和解释的形式供作者和期刊编辑使用,旨在改进针灸试验的报告,尤其是干预措施,从而促进其解释
PLoS Med . 2010 Jun 8;7(6):e1000261 - 针灸,报告规范 - 2021-09-01
药物临床试验适应性设计指导原则(征求意见稿)
为了促进药物临床试验各相关方对临床试验适应性设计的理解与合理应用,经广泛调研和讨论,我中心组织起草了《药物临床试验适应性设计指导原则(征求意见稿)》。
CDE - 指导原则 - 2020-10-03
为您找到相关结果约500个