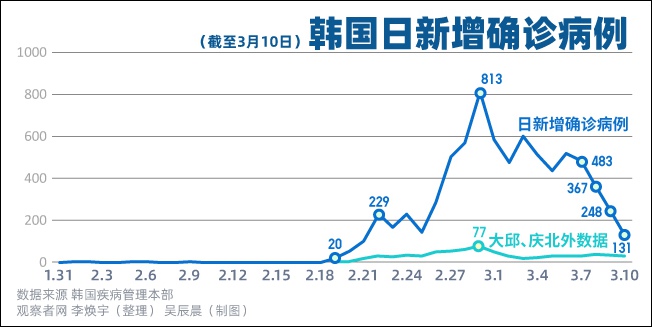
Nature:境外新增病例数首超中国境内!
据媒体报道,目前美国新冠肺炎(COVID-19)确诊病例数已达60例,韩国新增334例,总共确诊1595例病例,日本累计确诊891例(包括“钻石公主”号邮轮),伊朗累计确诊139例病例,意大利累计确诊470例病例。
生物探索 - 新冠病毒 - 2020-02-27
药监局发布进口医疗器械产品在中国境内企业生产相关公告
日前,国家药监局发布了关于进口医疗器械产品在中国境内企业生产有关事项的公告,适用范围为,进口医疗器械注册人通过其在境内设立的外商投资企业在境内生产第二类、第三类已获进口医疗器械注册证产品的有关事项。
药监局 - 医疗器械,中国境内,相关公告 - 2020-10-02
全球新冠肺炎病例数达9.3万,涉及中国境外76国
数据还显示,在中国境外,病例数达到12668例,死亡病例数214例。与前一日相比,新增阿根廷、智利、波兰、乌克兰4个国家报告确诊
新华社 - 病例,肺炎,9.3万 - 2020-03-06
境外抗癌新药审批提速 促境内同步上市
新华社北京2月11日电 国务院总理李克强2月11日主持召开国务院常务会议,听取2018年全国两会建议提案办理工作汇报,推进提升政府施政水平;要求狠抓今年脱贫攻坚任务落实,为打赢脱贫攻坚战奠定坚实基础;部署加强癌症早诊早治和用药保障的措施,决定对罕见病药品给予增值税优惠;决定支持商业银行多渠道补充资本金,增强金融服务实体经济和防风险能力。
中国妇女报 - 境外,抗癌新药,境内同步 - 2019-02-13
已在境内上市的境外生产药品转移至境内生产的药品上市注册申请申报资料要求(预防用生物制品)(征求意见稿)
国家药品监督管理局药品审评中心起草了《已在境内上市的境外生产药品转移至境内生产的药品上市注册申请申报资料要求(预防用生物制品)(征求意见稿)》,现通过中心网站公示并征求意见。
国家药品监督管理局药品审评中心 - 药品 - 2024-05-17
Epidemiol Infect:新冠病毒自2019年12月起已在挪威境内传播
挪威阿克舒斯大学附属医院的研究人员发现,新冠病毒抗体出现可追溯到2019年12月,这比欧洲公布的首例确诊病例早一个月。
MedSci原创 - 新冠病毒 - 2022-01-28
已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(化学药品)
按照国家药品监督管理局的部署,药审中心组织制定了《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(化学药品)》。
国家药品监督管理局药品审评中心 - 药品 - 2024-05-12
境内第三类医疗器械注册质量管理体系核查工作程序
国家局组织修订了《境内第三类医疗器械注册质量管理体系核查工作程序》,现予印发,自发布之日起施行。
国家药品监督管理总局官网 - 第三类医疗器械 - 2023-05-07
关于发布境内生产药品再注册申报程序和申报资料要求的通告(征求意见稿)
国家药监局组织拟定《关于发布境内生产药品再注册申报程序和申报资料要求的通告(征求意见稿)》。现向社会公开征求意见。
国家药品监督管理局官网 - 药品 - 2024-05-16
已获进口医疗器械注册证的产品转移中国境内企业生产有关事项公告(征求意见稿)
已获进口医疗器械注册证的产品转移中国境内企业生产有关事项公告(征求意见稿)
NMPA - 进口医疗器械 - 2022-08-09
境外已上市境内未上市药品临床技术要求
境外已上市药品境内上市或仿制,是解决我国患者对临床迫切需求领域药品的可获得性和可及性的重要手段。为加快此类药品研发上市进程,加强科学监管,依据《药品注册管理办法》(总局令第27号)及其配套文件,药审中
CDE - 药品 - 2021-06-27
境外已上市境内未上市化学药品药学研究与评价技术要求(试行)
为进一步指导企业开展药品研发,加快境外已上市境内未上市化学药品研发上市进程,提供可参考的技术标准。在国家药品监督管理局的部署下,药审中心组织制定了《境外已上市境内未上市化学药品药学研究与评价技术要求(
CDE - 化学药品 - 2021-05-13
为您找到相关结果约500个