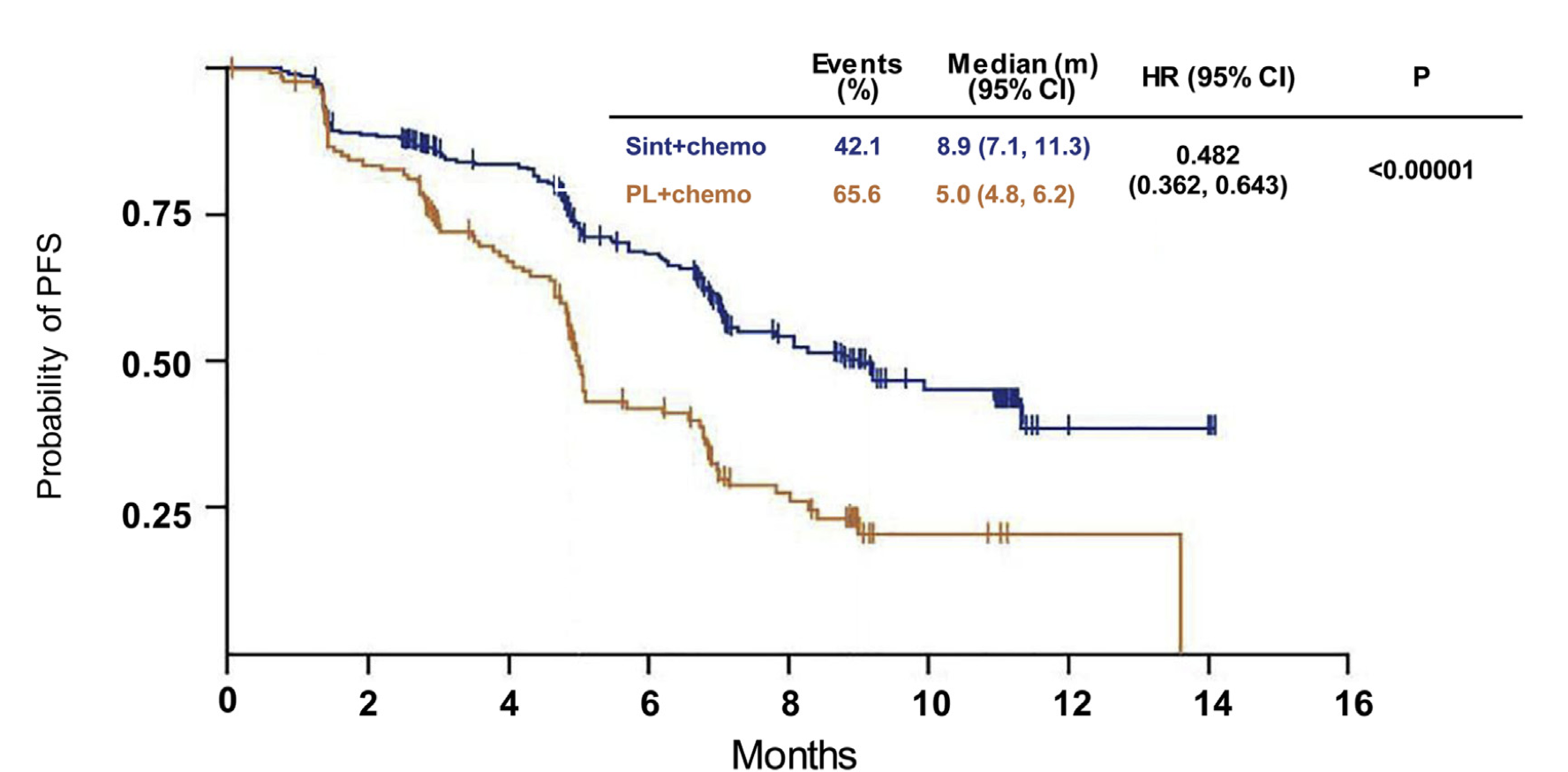
国产PD-1抗体药信迪利单抗注射液获批,治疗霍奇金淋巴瘤
近日,国产抗肿瘤创新药再传喜讯,由信达生物制药(苏州)有限公司研发生产的PD-1单抗——信迪利单抗注射液(Sintilimab Injection)注册申请获得国家药品监督管理局批准,用于治疗经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤信迪利单抗注射液属于我国企业自主研发并拥有完全自主知识产权的1类创新药,获得国家重大新药创制和重点研发计划项目支持,通过优先审评审批程序获准上市。霍奇金淋巴瘤
国家药监局网站 - 抗体药,单抗注射液,霍奇金淋巴瘤 - 2018-12-28
抗PD-1单克隆抗体达伯舒®(信迪利单抗注射液)在中国正式获批
2018年12月27日,信达生物制药(香港联交所代码:01801)与礼来制药共同宣布,双方共同开发的创新肿瘤药物达伯舒®(重组全人源抗PD-1单克隆抗体,国际商标:Tyvyt®,化学通用名:信迪利单抗注射液
美通社 - 达伯舒,单抗注射液 - 2018-12-27
FDA拒绝信迪利单抗用于治疗NSCLC
FDA 咨询委员会投票决定礼来公司及其合作伙伴信达生物公司应该对信迪利单抗(Sintilimab)进行更多试验。
MedSci原创 - NSCLC,信迪利单抗 - 2022-03-27
利妥昔单抗注射液生物类似药临床试验指导原则
本文为国家药品监督管理局药品审评中心发布的《利妥昔单抗注射液生物类似药临床试验指导原则》。
国家药品监督管理局药品审评中心 - 利妥昔单抗 - 2024-02-08
礼来制药与信达生物共同宣布达伯舒®(信迪利单抗注射液)非鳞状非小细胞肺癌一线治疗新适应症正式上市
2021年3月21日,中国健康促进基金会2021肺癌免疫高峰论坛暨达伯舒®(信迪利单抗注射液)一线治疗非鳞状非小细胞肺癌新适应症上市会在上海召开。
medsci - 肺癌,达伯舒 - 2021-03-21
信达生物的利妥昔单抗注射液HALPRYZA,获NMPA批准治疗恶性淋巴瘤
信达生物宣布其与礼来共同开发的重组人/鼠嵌合单克隆抗体HALPRYZA(利妥昔单抗注射液)获得中国国家药品监督管理局(NMPA)的正式批准上市。
MedSci原创 - 非霍奇金淋巴瘤,信达生物,HALPRYZA(利妥昔单抗注射液) - 2020-10-10
达利珠单抗注射液或损伤肝脏,欧洲药管局建议进一步限制使用
欧洲药品管理局10月27日公布了对达利珠单抗的肝脏安全性评估结果,建议进一步限制该药品的使用。
澎湃新闻 - 达利珠单抗,注射液,损伤肝脏,欧洲药管局,限制使用 - 2017-10-30
我国首个自主研发上市的抗PD-1单抗特瑞普利单抗注射液纳入国家医保药品目录
君实生物宣布其研发的抗PD-1单抗药物特瑞普利单抗注射液纳入新版《国家基本医疗保险、工伤保险和生育保险药品目录(2020版)》
君实生物 - PD-1,君实生物,国家基本医疗保险 - 2020-12-29
「美泊利珠单抗注射液」在中国获批用于治疗重度嗜酸粒细胞性哮喘
这一获批是基于在中国患者中进行的独立的三期临床试验的积极结果,美泊利珠单抗在中国人群中的有效性巩固了其在广泛人群中的现有数据,显示了美泊利珠单抗能够减少重度哮喘患者病情加重。
GSK - 2024-01-10
第三款国产阿达木单抗注射液获批上市
日前,据国家药监局官网信息显示,信达生物阿达木单抗注射液获批上市,用于治疗强直性脊柱炎、类风湿性关节炎和银屑病等自身免疫疾病,这也是继百奥泰、海正药业之后的国产第3家阿达木单抗获批企业。
医谷网 - 阿达木,获批,注射液 - 2020-09-03
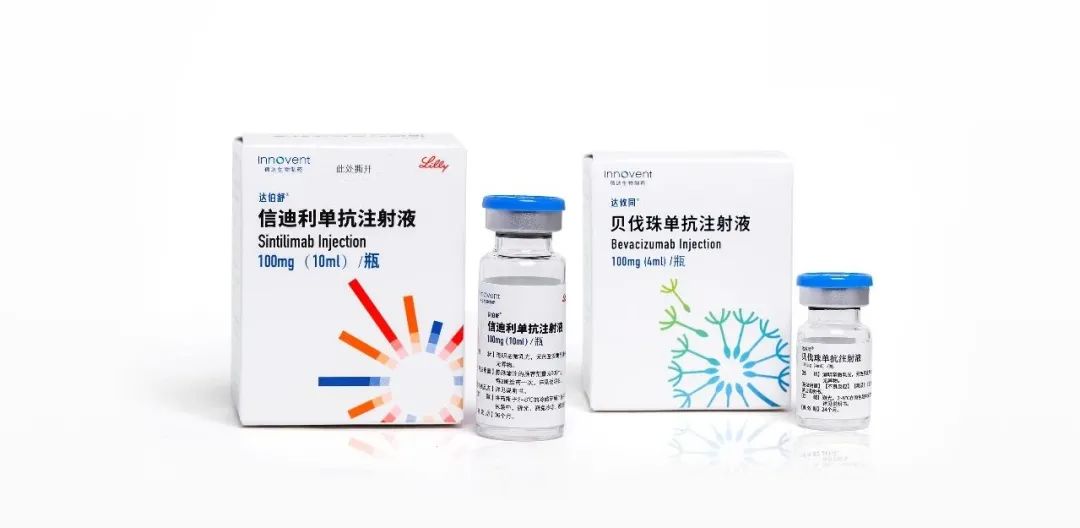
信迪利单抗联合达攸同(贝伐珠单抗)用于一线治疗肝癌获批准
6月28日,美国旧金山和中国苏州——信达生物制药(香港联交所股票代码:01801),一家致力于研发、生产和销售用于治疗肿瘤、代谢疾病、自身免疫等重大疾病的创新药物的生物制药公司
网络 - 信迪利单抗 - 2021-06-28
阿达木单抗注射液生物类似药临床试验指导原则
本文为国家药品监督管理局药品审评中心发布的《阿达木单抗注射液生物类似药临床试验指导原则》。
国家药品监督管理局药品审评中心 - 临床试验 - 2024-02-12
托珠单抗注射液生物类似药临床试验指导原则
为鼓励生物类似药研发,进一步规范和指导托珠单抗生物类似药的临床试验设计和终点选择,提供可参考的技术规范,在国家药品监督管理局的部署下,药审中心组织制定了《托珠单抗注射液生物类似药临床试验指导原则》(见
国家药品监督管理局药品审评中心 - 托珠单抗,指导原则 - 2021-05-13
帕妥珠单抗注射液生物类似药临床试验指导原则
为鼓励生物类似药研发,进一步规范和指导帕妥珠单抗生物类似药的临床试验设计和终点选择,提供可参考的技术规范,在国家药品监督管理局的部署下,药审中心组织制定了《帕妥珠单抗注射液生物类似药临床试验指导原则》
国家药品监督管理局药品审评中心 - 帕妥珠单抗 - 2021-05-13
为您找到相关结果约500个