浅谈IND申请的那些事
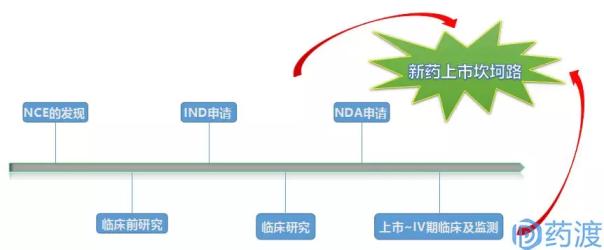
在这里,如果将立项比作“撒种子”,那IND过程则犹如“开花”,NDA过程就类似于“结果”。项目在立项之初,撒下千万颗种子,最终能长出果实的,绝对凤毛麟角。而在现实工作中,如能真正成长到开花阶段的IND,就已经让人超级敬佩、超级羡慕了。因为,
药渡 - IND,FDA,新药研发 - 2018-02-14
FDA指南:IND下研究药物的收费:问题和答案
本指南解决了与实施 FDA 关于在研新药申请 (IND) 下为临床试验或扩大治疗使用目的而对研究药物收费的法规相关的常见问题。
FDA官网 - 药物 - 2024-02-20
Allogene与Servier宣布FDA批准ALLO-501的IND
)合作,率先开发了一种抗CD19的同种异体CAR-T(ALLO-501)癌症治疗药物,Allogene与Servier近日宣布美国食品和药品监督管理局(FDA)已批准ALLO-501的研究性新药申请(IND
MedSci原创 - Allogene,ALLO-501,同种异体CAR-T,CD19 - 2019-01-29
大麻药物治疗亨廷顿病的IND申请
MMJ国际控股公司是目前通过患者临床研究推进医用大麻科学的首屈一指的医学科研公司,2018年8月4日宣布已向美国食品药品监督管理局(FDA)提交了一份研究前新药(IND)申请,以开始治疗与亨廷顿病相关的临床试验
MedSci原创 - 大麻,IND,亨廷顿病 - 2018-08-05
FDA接受TR1801-ADC(MT-8633)的IND申请
TRL近日宣布,美国食品和药品监督管理局(FDA)接受了该公司的首个研究性新药(IND)申请,以启动其抗体药物偶联物TR1801
网络 - FDA,TR1801-ADC,cMet - 2019-02-18
FDA已接受ONC206的研究性新药申请(IND)
Oncoceutics制药公司近日宣布,美国FDA已接受该公司的ONC206的研究新药申请(IND),允许对该化合物进行首次人体试验。
MedSci原创 - ONC206,研究性新药申请,FDA - 2019-08-27
ONM-100已获得FDA的IND和快速通道资格
OncoNano医疗公司近日宣布,美国食品和药品管理局(FDA)已接受其ONM-100的研究性新药申请(IND),这是一种在实体瘤手术期间用于检测的静脉注射成像剂。
MedSci原创 - ONM-100,IND,快速通道资格 - 2019-01-06
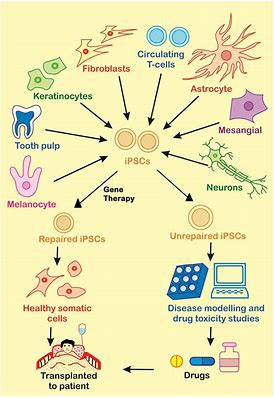
CRISPR编辑的iPSC衍生细胞疗法FT538:FDA已批准IND
FT538是一种自然杀伤细胞(NK)癌症免疫疗法,其衍生自诱导多能干细胞(iPSC),且经过工程改造。
MedSci原创 - iPSCs,CRISPR编辑,FT538 - 2020-05-21
美国FDA已批准抗体-药物偶联物(ADC)OBI-999的IND
OBI制药公司近日宣布,美国FDA已批准其抗体-药物偶联物(ADC)OBI-999的研究性新药申请(IND),将进行I/II期临床研究。
MedSci原创 - 抗体-药物偶联物(ADC),OBI-999,FDA - 2019-09-04
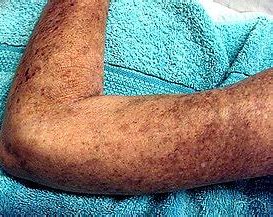
异源细胞疗法FCR001治疗重度硬皮病:IND已获FDA批准
美国FDA已批准该公司的研究性新药申请(IND),以开展新型细胞疗法FCR001治疗弥漫性全身性硬化症(SSc)的I/IIa期临床试验。
MedSci原创 - 硬皮病,FCR001 - 2020-07-09
首款iPSC衍生的CAR-T细胞疗法:IND已获FDA批准
Fate Therapeutics是一家临床阶段的生物制药公司,致力于开发抗癌症和免疫疾病的细胞免疫疗法,今日宣布,美国FDA已批准FT819的研究性新药申请(IND)。
MedSci原创 - iPSCs,慢性淋巴细胞性白血病,Car-T细胞疗法 - 2020-07-11
Epizyme表观遗传药物IND申请被FDA受理
今天美国生物技术公司Epizyme的表观遗传药物、EZH2抑制剂tazemetostat的IND申请被FDA受理,将开始BAP1缺失间皮瘤的临床开发。每年IND有很多,但是因为表观遗传药物虽然可能有很大潜力但目前还处于艰难的爬坡阶段,所
美中药源 - 表观遗传,FDA - 2016-05-07
FDA罕见病:早期药物开发和 IND 前会议的作用
美国食品和药物管理局(FDA 或机构)宣布了一份题为“罕见疾病:早期药物开发和研究前新药申请会议的作用”的行业指南草案。 本指南草案的目的是协助治疗罕见病的药物和生物制品的申办
FDA - 罕见病 - 2021-10-25
9只中药在FDA申请研究药物申报(IND) 中药逐渐获认可
目前,我国已有9个中药品种在美国食品和药物管理局(FDA)申请IND(Investigational New Drug),并有多个品种已经进入Ⅲ临床试验;同时,还有10余项中药循证医学研究获得国际高度认可
医药经济报 - 中药,FDA - 2014-03-26
FDA行业指南:IND 安全报告的电子提交技术一致性指南
本技术一致性指南(指南)提供了有关如何向药物评估和研究中心 (CDER) 或生物制品评估和研究中心 (CBER) 提交电子研究性新药申请 (IND) 安全报告的规范、建议和一般注意事项 )。 本指南补
FDA - 安全报告 - 2022-08-06
为您找到相关结果约500个