阿斯利康中国2019年同比强劲增长35%!
2020-02-17 GBI GBI
GBI获悉,近日,英国制药巨头阿斯利康公布了2019年全年业绩,总收入243.84亿美元,同比增长13%(按固定汇率计算,下同),产品销售收入达235.7亿美元,同比增长15%,核心营业利润增长13%至64.4亿美元。 报告期内,中国市场收入48.80亿美元,同比增长35%,约占阿斯利康全球总收入的21%;第四季度收入同比增长28%至11.89亿美元。值得一提的是,新上市
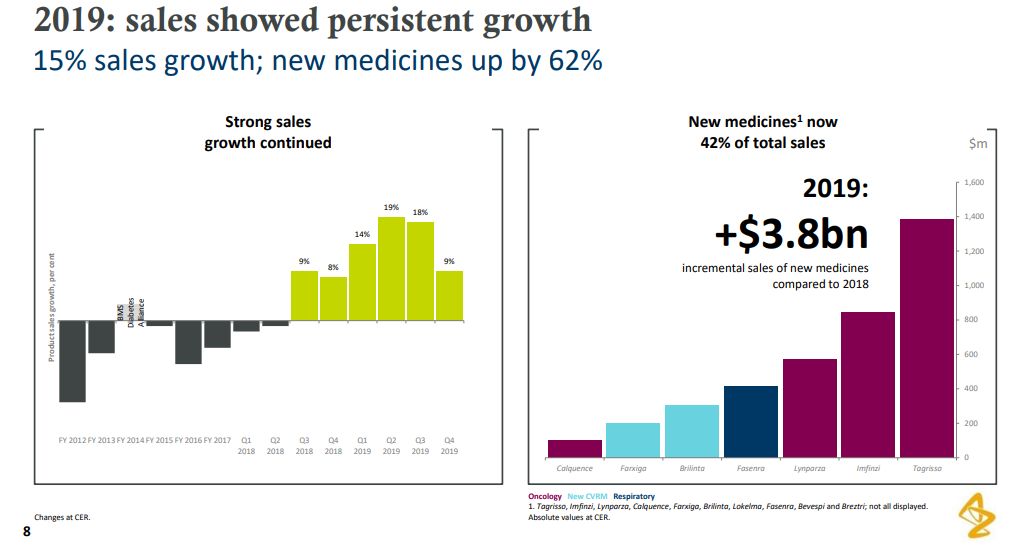
报告期内,中国市场收入48.80亿美元,同比增长35%,约占阿斯利康全球总收入的21%;第四季度收入同比增长28%至11.89亿美元。值得一提的是,新上市药品的中国地区销售额占比从2018年的11%提高到19%,其中包括抗癌药物泰瑞沙(奥希替尼)和利普卓(奥拉帕利),心脏病发作和卒中药物倍林达(替卡格雷)以及2型糖尿病药物安达唐(达格列净)。
此外,新兴市场(包括中国)收入达81.65亿美元,同比增长24%;美国市场增长13%至77.5亿美元;而欧洲相对稳定,收入达43.5亿美元,同比增长2%;日本同比增长26%至25.5亿美元。产品销售收入
阿斯利康肿瘤产品是全球收入增长的驱动因素,销售额同比增长47%至86.7亿美元。其中,业绩表现最亮眼的产品包括肺癌药物泰瑞沙,PARP抑制剂利普卓和PD-L1免疫抑制剂英飞凡(度伐利尤单抗);白血病药物阿卡替尼(acalabrutinib),与第一三共合作共同开发的抗HER2 ADC药物Trastuzumab Deruxtecan上市后,表现也不俗。
泰瑞沙本年度全球销售收入达31.89亿美元,同比增长74%。2019年,该药在中国获批用于一线治疗EGFR突变晚期非小细胞肺癌(NSCLC);其用于二线治疗NSCLC在2019年进入国家医保(2020年起开始生效)。财报显示,纳入医保后,泰瑞沙的新兴市场收入同比增长130%至7.62亿美元。在财报电话会议上,公司首席执行官帕斯卡尔·索里奥特(Pascal Soriot)表示,公司计划今年将泰瑞沙一线治疗NSCLC纳入医保,不出意外的话,将在明年生效。
重磅药物PD-L1免疫抑制剂英飞凡2019年度销售额同比增长133%,达14.69亿美元(主要受在美国三线治疗晚期NSCLC适应症的推动)。2019年12月,该药在中国首次获批三线治疗NSCLC。
由阿斯利康和默沙东联合开发,用于治疗卵巢癌和乳腺癌的PARP抑制剂利普卓也突破了10亿美元大关,收入达11.98亿美元,同比增长89%。该药在2019年11月被纳入医保目录,推动新兴市场销售收入至1.33亿美元,同比增长177%。
呼吸产品收入占全球销售额的23%,且在普米克令舒(布地奈德)和信必可都保(布地奈德福莫特罗粉吸入剂)的驱动下,中国市场继续保持强劲增长。这些疗法现在得到全国17500个雾化中心网络的支持。三联疗法Breztri(布地奈德+福莫特罗+格隆溴铵)于2019年12月在中国获批用于治疗慢性阻塞性肺疾病(COPD),大大增强了公司呼吸产品组合的实力。
VBP带来的影响
“4+7”带量采购的扩面毫无疑问对公司的业绩带来了一定影响。阿斯利康的吉非替尼和瑞舒伐他汀都是首批带量采购品种,吉非替尼以超过70%的降幅中标,但瑞舒伐他汀落标。结果,这两种产品销售额均有下降;其中瑞舒伐他汀第四季度新兴市场收入为1.85亿美元,同比下降了10%;泰瑞沙当季销售额也下滑28%至8000万美元。今年1月,第二轮全国带量采购开标,阿斯利康没有产品入围。
医保目录产品
2019年下半年,国家医保局(NHSA)公布了新版医保常规目录,并开始了医保准入价格谈判。目录调整后,糖尿病药物安立格(沙格列汀二甲双胍缓释片)直接进入了医保;治疗哮喘和COPD的信必可都保和反流性食管炎药物耐信(奥美拉唑)不再是“限二线用药”的药品。此外,卵巢癌药物利普卓、2型糖尿病药物安达唐和贫血新药爱瑞卓(罗沙司他)在2019年12月通过价格谈判进入了医保目录。乳腺癌药物芙仕得(氟维司群)被调出医保目录。阿斯利康表示,自2012年以来,公司已有15种产品被纳入了国家基本药品目录(EDL)。 医新冠肺炎对公司的影响
根据新闻稿,在提到突发新型冠状病毒感染的肺炎疫情对中国产生的影响时,阿斯利康表示,所有的收入指引均认为,新冠肺炎疫情对中国产生的负面影响将持续好几个月。公司将密切关注疫情的发展,并计划在2020年第一季度财报中提供相关最新信息。考虑到新冠肺炎疫情影响,公司预计将总收入以高个位数到较低的两位数百分比增长,核心每股收益增幅将落在15%到19%之间。
阿斯利康全球执行副总裁、国际业务及中国总裁王磊表示,疫情“正在向好的方面发展”,但对公司运营产生了重大影响:“公司销售团队无法进入医院”,也无法接触到医生。不过王磊强调,国内患者现在可以直接从药房买药,在线复诊续方。阿斯利康扩大了对“社区医院,零售市场”的覆盖,加大了“数字化推广,零售药店市场推广以及与线上药房合作”的力度,加上近期内多种药物被纳入医保目录,这意味着公司有能力度过市场的动荡时期。在疫情期间,公司的物流部门、供应链部门、运营、生产和总部人员等职能部门已经从上周伊始全面复工,说明阿斯利康是“一个适应力非常强的公司”。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言