Lancet子刊发表belantamab mafodotin的3期DREAMM-3研究结果
2023-10-16 聊聊血液 聊聊血液 发表于上海
近日《The Lancet Haematology》报道了DREAMM-3 研究,现对文章进行简单整理,或许可以有新的认识。
belantamab mafodotin
Belantamab mafodotin是一款 BCMA 靶向 ADC 疗法,2020 年 8 月获 FDA 加速批准用于治疗先前经过四线治疗失败的复发难治多发性骨髓瘤(RRMM)患者。2022年 11 月 7 日GSK公司宣布DREAMM-3 研究(Belantamab mafodotin单药对比泊马度胺和低剂量地塞米松[PomDex])失败,未达到无进展生存期(PFS)的主要疗效终点(HR=1.03,但中位PFS稍长,分别为11.2和7个月),此外客观缓解率(ORR)分别为41%和36%,完全缓解率(CR)分别为25%和8%,缓解持续时间(DOR)分别为未达到和8.5个月,12个月DOR率分别为76.8%和48.4%。
但在研究失败消息释出后的 15 天后,belantamab mafodotin就迅速启动了撤市程序,2022年11 月 22 日GSK 宣布,该公司已经应美国 FDA 的要求启动了撤销belantamab mafodotin-blmf美国上市许可的程序。这一决定是基于先前公布的确证性 III 期DREAMM-3 研究的失败,该研究不符合FDA加速批准法规的要求。此外,欧洲EMA 9月发文,人用药品委员会 (CHMP)建议不更新belantamab mafodotin的有条件上市许可,该药或将不再在欧盟上市。
但是GSK宣布后续临床试验继续开展(例如DREAMM-7研究和DREAMM-8研究等),并未完全放弃该产品。GSK 认为,根据 DREAMM(DRiving Excellence in Approaches to Multiple Myeloma) 开发项目的总体数据,belantamab mafodotin在该难治性 RRMM 患者人群中的获益-风险特征仍然有利。
近日《The Lancet Haematology》报道了DREAMM-3 研究,现对文章进行简单整理,或许可以有新的认识。

研究方法
DREAMM-3研究是一项多中心、开放标签、随机、3期研究,纳入根据IMWG诊断的成人RRMM患者,此外ECOG PS 0-2、既往接受过≥2线治疗(包括来那度胺和一个蛋白酶体抑制剂),患者在研究治疗开始前超过100天接受过自体造血干细胞移植 (HSCT)(且无活动性感染)或不适合移植,并且在末次治疗时或治疗后60天内无反应或出现疾病进展。
合格患者按国际分期系统(I/II或III)、既往治疗线数(≤3或> 3)和既往抗 CD38 单克隆抗体治疗分层。使用中心交互式应答技术系统,以2:1的比例集中随机分配接受 belantamab mafodotin 或泊马度胺-地塞米松单药治疗。
患者接受belantamab mafodotin 2.5 mg/kg静脉给药,每3周一次;或口服泊马度胺4.0 mg每日一次(第1-21天)+口服地塞米松(40mg;年龄>75岁的患者为20mg,每周一次(第1、8、15和22天),28天为一个周期,直至疾病进展、死亡、出现不可接受的毒性、撤回知情同意、失访或研究结束,以先发生者为准。
主要研究终点为研究者评估的PFS,关键次要终点为总生存期(OS)。
研究结果
患者
共入组325例RRMM患者,随机分配至 belantamab mafodotin 组 (n=218) 或泊马度胺-地塞米松组(n=107;图1,表1)。
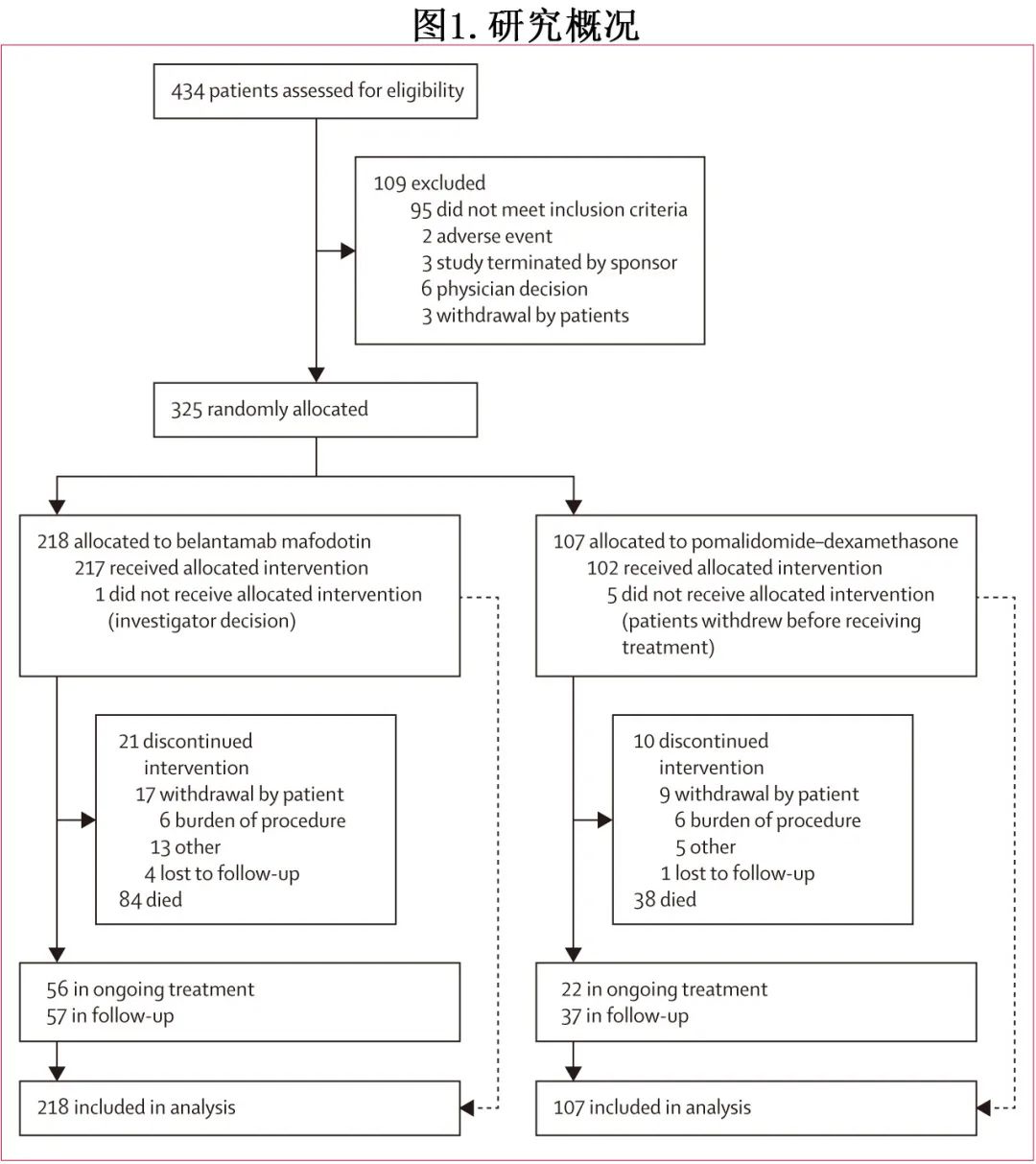
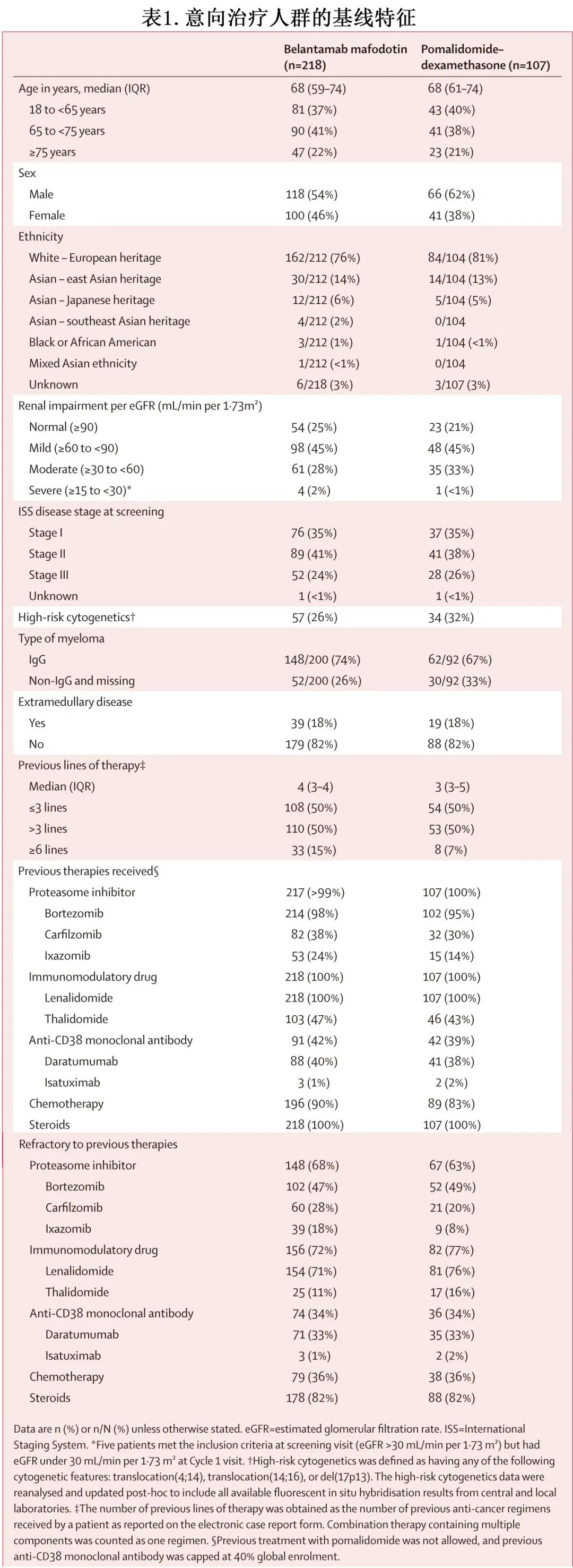
中位年龄为68岁,184例(57%) 为男性,141例(43%)为女性。belantamab mafodotin 组患者既往接受中位4线治疗,而泊马度胺-地塞米松组接受3线治疗。belantamab mafodotin 组(33/218例 [15%])既往接受过≥6线治疗的患者是泊马度胺-地塞米松组(8/107例 [7%])的2倍。两组CD38 mAb 的耐药率相似(74/218[34%] vs 36/107[34%]),对蛋白酶体抑制剂、免疫调节剂和抗 CD38 mAb的三重难治率也相似(46/218[21%]和22/107[21%])。
研究中方案违背发生率较高,包括研究程序(53%和50%)、有效性(37%和28%)、访视时间表(35%和27%)、患者依从性(35%和23%)和实验室评估(22%和33%);包括泊马度胺-地塞米松组未进行眼部检查,belantamab mafodotin组发生眼部不良事件后未调整剂量。
belantamab mafodotin 的中位随访时间为11.5个月,泊马度胺-地塞米松为10.8个月。belantamab mafodotin 组患者接受的中位治疗周期数为5。泊马度胺的中位剂量为4.0 mg/天。年龄<75岁的患者地塞米松中位剂量为40.0mg。总体而言,218例患者中有161例 (74%) 停用belantamab mafodotin,107例患者中有80例 (75%) 停用泊马度胺和地塞米松。在 belantamab mafodotin 和泊马度胺-地塞米松组治疗的前3个月内,217例患者中的35例 (16%) 和102例患者中的13例 (13%) 延迟给药,217例患者中的53例 (24%) 和102例患者中的24例 (24%) 减少剂量,217例患者中的101例 (47%) 和102例患者中的36例 (35%) 停药。大多数停药与疾病进展相关;在前3个月内,217例患者中的10例 (5%) 和102例患者中的9例 (9%)因不良事件而停药。
疗效
belantamab mafodotin 组104/218(48%) 和泊马度胺-地塞米松组48/107 (45%) 发生疾病进展或死亡,中位PFS分别为11.2个月和7.0个月(HR=1.03;p=0.56,图2),12个月PFS率分别为48%和35%。受限平均生存时间(restricted mean survival time,RMST)差异(belantamab mafodotin– [泊马度胺–地塞米松])为0.7个月,RMST比值(belantamab mafodotin/[泊马度胺–地塞米松])为1.07。
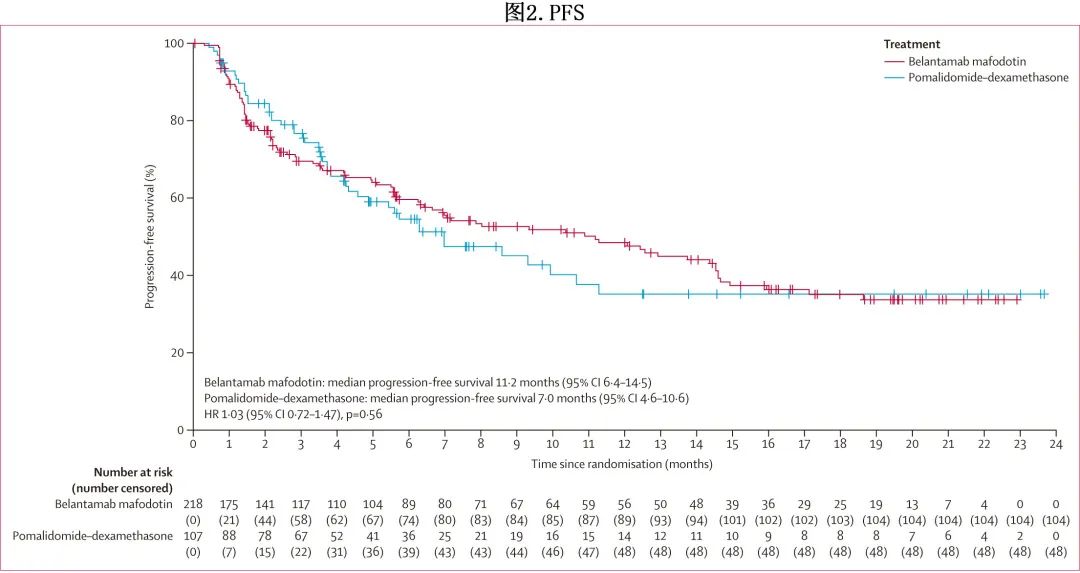
进行了预先规定的PFS亚组分析。除高危细胞遗传学亚组外,所有亚组 HR 的 95%CI 均包含1。
数据截止时OS数据尚不成熟(ITT人群中38%[122/325]):belantamab mafodotin组和泊马度胺-地塞米松组分别有39%(84/218) 和36%(38/107) 的患者死亡,主要死于疾病进展;中位OS分别为21.2个月和21.1个月(HR=1.14;p = 0.75;图3)。RMST 差异为–0.4个月,RMST比值为0.98。
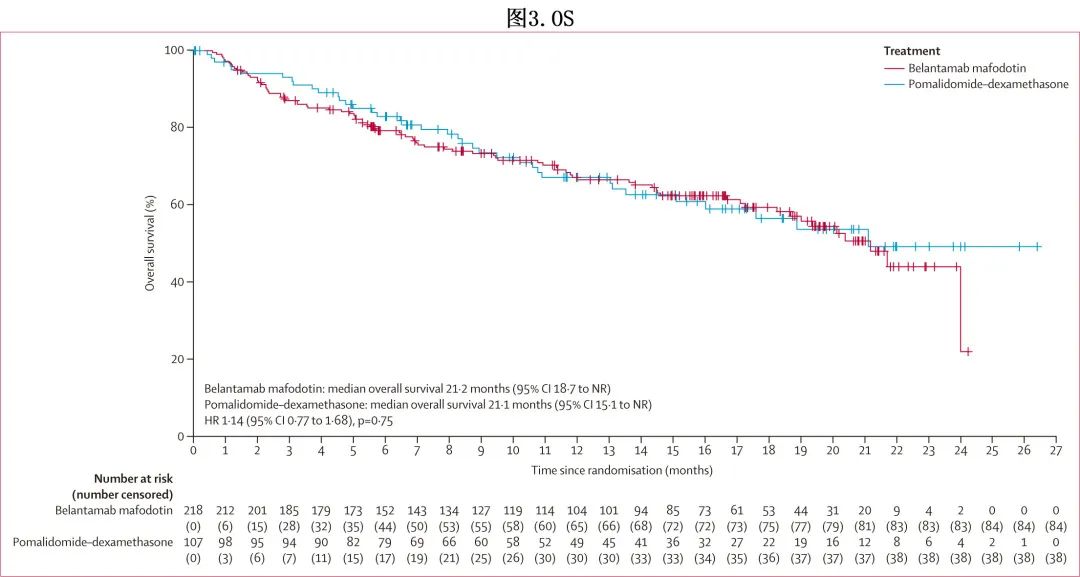
belantamab mafodotin 组和泊马度胺-地塞米松组的ORR(≥PR)分别为89/218(41%) 和38/107(36%)。belantamab mafodotin 组≥VGPR(25% vs 8%)、CR/sCR(10% vs 3%)和MRD阴性率(7% vs 0)均更高;临床获益(≥微小缓解)率分别为102/218(47%) 和50/107(47%)。
belantamab mafodotin 组和泊马度胺-地塞米松组的中位缓解持续时间为NR和8.5个月,缓解持续时间的 Kaplan-Meier 曲线显示,治疗组之间明显且早期分离,belantamab mafodotin更优;受限平均缓解持续时间 (RMDoR)分别为8.2个月和5.5个月,12个月缓解持续率分别为77%和48%,中位至缓解时间分别为2.1个月和1.5个月。
安全性
在安全性人群中,belantamab mafodotin组和泊马度胺-地塞米松组分别有97%(211/217) 和93%(95/102) 的患者发生不良事件(分别有84%[182例])和76%[78例]) 的患者发生与研究治疗相关的不良事件)。belantamab mafodotin 组最常见的不良事件为血小板减少 (74/217[34%])、视物模糊 (86[40%]) 和贫血(62[29%];表2),泊马度胺–地塞米松组最常见的不良事件为中性粒细胞减少 (39/102[38%])、血小板减少 (31 [30%]) 和贫血 (30 [29%])。两组间3-4级不良事件的总体频率相似(167例 [77%] vs 75 例 [74%];与研究治疗相关的3级或4级不良事件分别为123例 [57%]和55例 [54%])。belantamab mafodotin 组中最常见的3-4级不良事件为血小板减少(49例 [23%])和贫血(35例 [16%]),而中性粒细胞减少(34例 [33%])和贫血(18例 [18%])在泊马度胺-地塞米松组中最常见(表2)。
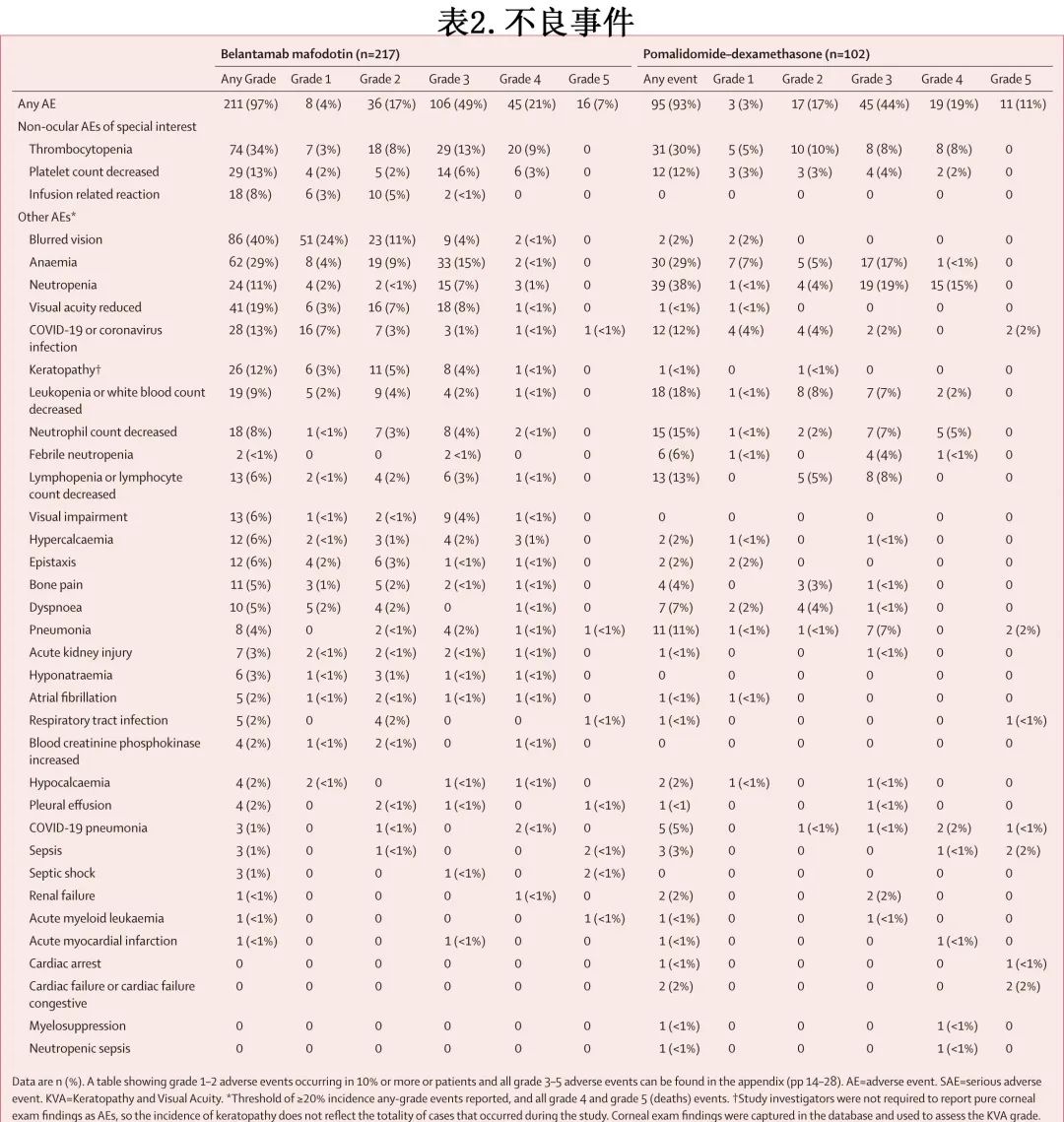
belantamab mafodotin 组的217例患者中有94例 (43%) 报告了严重不良事件 (SAE);最常见的是血小板减少(8例 [4%])、发热(7例 [3%])和感染性肺炎(6例 [3%])。泊马度胺-地塞米松组102例患者中的40例 (39%) 发生SAE;最常见的是感染性肺炎(8例 [8%])、COVID-19感染性肺炎(5例 [5%])和发热性中性粒细胞减少(5例 [5%])。belantamab mafodotin 组的10例 (5%) 患者和泊马度胺-地塞米松组的1例 (1%) 患者发生 SAE 出血事件,但均与治疗无关。belantamab mafodotin 组25例 (12%) 患者和泊马度胺-地塞米松组12例 (12%) 患者发生与研究治疗相关的SAE,分别有16例 (7%) 和11例 (11%) 患者发生导致死亡的SAE;泊马度胺-地塞米松组有1例 (1%)治疗相关死亡(由脓毒症引起),belantamab mafodotin 组则0例。不良事件导致 belantamab mafodotin 组33例 (15%) 患者停药,其中最常见的是血小板减少(4例 [2%])和视物模糊(3例 [1%]);泊马度胺-地塞米松组17例 (17%) 患者因不良事件停药,其中COVID-19(2例 [2%])和败血症(2例 [2%])最常见(表2)。belantamab mafodotin 组133例 (61%) 患者发生导致给药中断或延迟的不良事件,79例 (36%) 患者发生导致剂量降低的不良事件,相比之下泊马度胺-地塞米松组分别有52例 (51%) 和36例 (35%) 患者。
belantamab mafodotin 组90例 (41%) 患者和泊马度胺-地塞米松组41例 (40%) 患者发生感染及侵染类疾病,分别有29例 (13%) 和25例 (25%) 患者发生≥3级感染。belantamab mafodotin 组最常见的3级和4级感染为感染性肺炎(6例 [3%])和COVID-19(5例 [2%]),泊马度胺-地塞米松组为感染性肺炎(9例 [9%]/102例)、COVID-19和 COVID-19 感染性肺炎(各4例 [4%]/102例)。
belantamab mafodotin 组和泊马度胺-地塞米松组分别有66%(143/217) 和8%(8/102) 的患者报告眼部特别关注的不良事件(AESI);belantamab mafodotin 组64/217例 (29%) 患者报告≥3级眼部AESI,泊马度胺-地塞米松组无患者报告。
专家点评
杂志同期发表Paula Rodriguez-Otero教授等的点评,三位专家认为研究结果为阴性的原因可能多种多样,并且考虑到既往暴露于 CD38 单抗的患者比例较低(91/218例 [42%]),比较 belantamab mafodotin 单药治疗与传统两药方案的试验设计具有挑战性,常规治疗可能仍有良好结果。还应强调的是,尽管未进行统计分析,但在本试验中观察到的缓解持续时间差异突出了BCMA药物的缓解持续时间更长,可能与不同的作用机制有关。
虽然DREAMM-3研究获得阴性结果,引起了人们对单药 belantamab mafodotin 疗效的质疑,并导致该药从美国市场撤出,但DREAMM-7和DREAMM-8研究仍在进行中,这些研究评估belantamab mafodotin联合当下的标准治疗,或可阐述belantamab mafodotin联合方案在RRMM中如何最佳使用。
参考文献
1.https://www.gsk.com/en-gb/media/press-releases/gsk-provides-update-on-dreamm-3-phase-iii-trial-for-blenrep/
2.https://www.gsk.com/en-gb/media/press-releases/gsk-provides-update-on-blenrep-us-marketing-authorisation/
3.Dimopoulos MA,et al. Efficacy and safety of single-agent belantamab mafodotin versus pomalidomide plus low-dose dexamethasone in patients with relapsed or refractory multiple myeloma (DREAMM-3): a phase 3, open-label, randomised study.Lancet Haematol . 2023 Oct;10(10):e801-e812. doi: 10.1016/S2352-3026(23)00243-0.
4.Rodriguez-Otero P, et al.Single-agent belantamab mafodotin in patients with relapsed or refractory multiple myelomaSingle-agent belantamab mafodotin in patients with relapsed or refractory multiple myeloma.Lancet Haematol . 2023 Oct;10(10):e786-e787. doi: 10.1016/S2352-3026(23)00278-8.
5.https://www.ema.europa.eu/en/news/ema-recommends-non-renewal-authorisation-multiple-myeloma-medicine-blenrep
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言