【AJH】侵袭性T细胞淋巴瘤的诊断、风险分层和治疗(2024更新)
2024-02-05 聊聊血液 聊聊血液 发表于陕西省
《American Journal of Hematology》近日发表综述,阐述了侵袭性T细胞淋巴瘤的诊断、风险分层和治疗。
侵袭性T细胞淋巴瘤
外周 T 细胞淋巴瘤 (PTCL) 起源于胸腺后淋巴细胞,占所有侵袭性非霍奇金淋巴瘤 (NHL) 的15%-20%,具有异质性临床病理学表现,与侵袭性 B 细胞淋巴瘤相比,它们在标准化疗下预后较差。其中间变性大细胞淋巴瘤 (ALCL) 的生存率较高,PTCL(非特指型,NOS)和血管免疫母细胞淋巴瘤 (AITL) 的预后较差。在最近第五版(2022年)WHO血淋巴肿瘤分类 (WHO-HAEM5) 中,根据临床和病理学特征以及全基因组测序的分子学数据,将34种成熟 T 细胞和 NK 细胞肿瘤分为9种类型。基因表达谱 (GEP)的新进展也发现了不同的分子学特征,可以定义预后并引导更合理的治疗策略。
《American Journal of Hematology》近日发表综述,阐述了侵袭性T细胞淋巴瘤的诊断、风险分层和治疗,现翻译全文供参考,共1.3万字,水平有限如有错误敬请谅解。

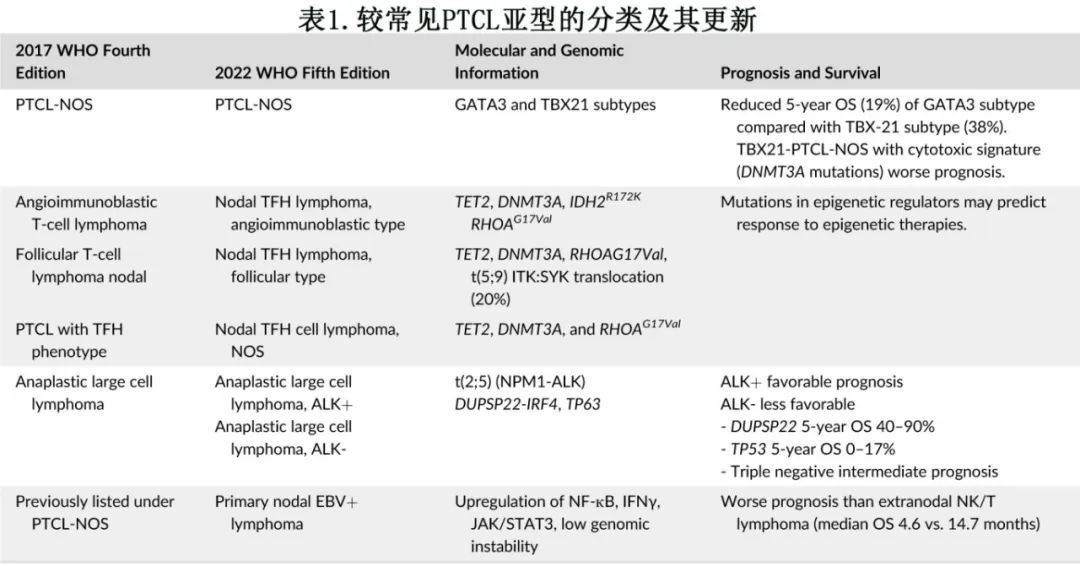
表1比较了第4版和第5版 WHO 的命名差异,并列出了在常见 PTCL 亚型中具有预后意义的基因组改变(genomic alterations)。该文还强调了最新的基因组结果及相关的治疗机会,且它们正在迅速被纳入 PTCL 的治疗范例中。
2.诊断和风险分层
应通过切除或切割活检诊断PTCL,以便采集足够的组织用于免疫表型分析和流式细胞术。免疫组化panel应包括 T 细胞标志物 (CD3、CD2、CD5、CD7、CD4、CD8)、滤泡辅助性 T 细胞亚型标志物 (CD10、BCL6、PD1/CD279、ICOS、CXCL13)、CD30、ALK、CD56、TCRβ、TCR δ、Ki67和 EB 病毒 (EBV) 编码区 (EBER) 原位杂交。
PTCL 中有多个结合实验室和临床特征的预后评分,包括经典国际预后指数 (IPI)、年龄调整的IPI、结外 NK/T 细胞淋巴瘤的 PINK-E 评分(包括年龄、分期、远处淋巴结受累、非鼻型疾病和EBV-DNA)和来自国际 T 细胞淋巴瘤项目的 T 细胞评分(包括年龄、分期、低白蛋白和高绝对中性粒细胞值)。分子学分析可改善风险分层,并有助于为 PTCL 患者量身定制治疗方案。
3.PTCL亚型的分子病理学
PTCL肿瘤发生是一个复杂的过程,包括恶性 T 细胞固有的 T 细胞受体 (TCR) 信号通路失调和与肿瘤微环境的相互作用,既往版本曾进行综述,以下是侵袭性 PTCL 和 NK 细胞淋巴瘤主要亚型的更新结果,或可精确定位靶向治疗的机会和支持治疗的数据。
3.1.PTCL-NOS
PTCL-NOS 是一组高度异质性的淋巴结淋巴瘤,通过排除特定亚型而诊断。形态学上,PTCL-NOS显示副皮质区浸润,正常淋巴结结构消失。表达CD3、CD4,丢失CD7 和 CD5。CD30在约58%-64%的病例中表达,30%存在 EB 病毒 (EBV)。但在第5个 WHO 分类中,细胞毒性标志物(TIA1、颗粒酶B、穿孔素)阳性和 EBV 阳性的 PTCL-NOS 现在称为淋巴结 EBV 阳性 NK/T 细胞淋巴瘤。
既往GEP分析通过无监督的分层聚类确定了 PTCL-NOS 中的两个主要组。第一组(PTCL-TBX21)的特征为表达转录因子T-box 21(TBX21),后者是 TH1 和细胞毒性 T 细胞分化的调节因子,该亚型存在NF-κB通路失调和JAK/STAT (Janus kinase–signal transducers and activators of transcription) 通路活化。另一组(PTCL-GATA3)的特征为GATA3 过表达,后者是TH2细胞分化中的转录调节因子,该亚型存在PI3K/mTOR通路富集、MYC过度活化和基因组不稳定。PTCL亚组还具有不同的形态学特征,PTCL-TBX21具有更多的多态性背景和反应性炎症细胞,而 PTCL-GATA3 具有中等大小的肿瘤细胞片,细胞质透明,缺乏炎症背景。使用四种市售的 GATA3 和 CCR4 染色(用于PTCL-GATA3)及 TBX21 和CXCR3染色(用于PTCL-TBX21)进行的免疫组化,可在约85%的患者中对两种分子亚型进行分类。GATA3签名(signature)的患者预后劣于 TBX21 签名的患者,5年 OS 分别为19%和38%。较差的结局归因于较高的基因组复杂性,其特征为频见可引起化疗耐药的 p53 相关基因(例如TP53、TP63、CDKN2A、WWOX和ANKRD11)。近期报告了 PTCL-TBX21 病例中的异质性,其中表观遗传修饰(最常见的为 TET2 和DNMT3A)突变存在活化的CD8+ T细胞毒基因签名(Gene signature)且OS 结局更差。
特有治疗策略
虽然不在常规临床实践中,但用于确定 GATA3 与 TBX21签名表达的突变分析和免疫组化 (IHC) 或有助于确定患者的预后。据推测,PI3K抑制剂治疗可能对 PTCL-GATA3 更有效,而 PTCL-TBX21 亚型患者可能从NF-κB 抑制剂和肿瘤微环境调节剂(如来那度胺)中获益,但仍需要进行临床评价。TP53信号通路存在异常或 GATA3 表达的患者在接受以蒽环类药物为基础的治疗方案后疗效不佳,应优先考虑进行临床试验。
3.2.淋巴结TFH淋巴瘤
第5版 WHO 分类引入该新术语,将具有滤泡辅助性T细胞 (TFH) 表型、重叠临床特征且具有共同突变特征(导致表观基因组和 TCR 信号传导失调)的 PTCL 归为一类。其特异性诊断标准包括原发性结内过程、CD4表达以及5种 TFH 标志物中的3种,即CD10、BCL6、CD279、CXCL13和诱导性 T 细胞共刺激因子 (ICOS)。3类淋巴结淋巴瘤可归为这一类——血管免疫母细胞亚型(以前称为血管免疫母细胞性 T 细胞淋巴瘤,AITL)、滤泡性亚型(以前称为滤泡性 T 细胞淋巴瘤)和NOS(以前称为具有滤泡辅助性T细胞表型的淋巴结外周 T 细胞淋巴瘤)。重要的是,基因组研究发现,淋巴结TFH 淋巴瘤中表观遗传调控因子TET2、IDH2 R172K、DNMT3A和 RHOA Gly17Val 的复发性突变与表观遗传修饰治疗的反应相关。
3.2.1.TFH淋巴瘤,血管免疫母细胞亚型
TFH 淋巴瘤AITL亚型常见于老年人,表现为弥漫性淋巴结肿大和易患自身免疫现象(皮疹、冷凝集素溶血性贫血)。可存在EBV+ B免疫母细胞,但肿瘤细胞不存在EBV。TFH-AITL的肿瘤发生涉及多个步骤,起始突变涉及表观遗传学调控基因(TET2、DNMT3A),随后为促进克隆性TFH细胞扩增的“双打击”驱动突变(RHOAG17Val和IDH2R172)。最后,突变的 TFH 细胞扩增并与缺陷的肿瘤微环境相互作用并促使肿瘤播散。形态学上,该淋巴瘤的特征为中等大小的非典型淋巴细胞弥漫性浸润,细胞质透明,滤泡树突状细胞增生,及分枝后毛细血管增生(高内皮小静脉)。在遗传学上,TFH-AITL亚型最常见表观遗传突变,如TET2(50%-90%)、DNMT3A(20–55%)、IDH2 R172 (20%-55%) 和RHOAG17Val (70%),因此使用去甲基化药物可能具有治疗优势,可直接对抗基础的DNA 超甲基化和基因沉默,且正在进行临床试验以进一步评估。TFH-AITL亚型也过度表达 CXCL12 和PD-1/PD-L1,或可作为治疗靶点。
3.2.2.滤泡型TFH淋巴结淋巴瘤
淋巴结TFH 淋巴瘤滤泡型具有滤泡间CD20+ B细胞的滤泡性生长模式。淋巴结TFH 淋巴瘤滤泡型中的TET2、DNMT3A和 RHOAG17Val突变频率与 AITL 亚型相似,但前者中IDH2R172突变并不常见。独特的是,20%-40%的患者报告t(5;9)ITK:SYK易位,导致SYK激酶活化,并驱动淋巴瘤基因。还报道了涉及 FER 和 FES 的易位可导致 STAT3信号活化。
3.2.3.淋巴结TFH淋巴瘤,NOS
淋巴结TFH,NOS亚型呈浸润性生长方式,缺乏滤泡生长方式或血管增生。临床症状与伴有自身免疫现象的 AITL 相似,突变特征与 AITL 相似,常发现TET2、DNMT3A和RHOAG17Val突变。IDH2突变罕见,而 TET2 突变可能略微更常见。
特有治疗策略
TFH 淋巴瘤的特征为表观遗传修饰因子(例如,TET2、IDH2、DNMT3A)的复发性突变,与肿瘤抑制基因沉默相关。包括组蛋白去乙酰化酶 (HDAC) 抑制剂(romidepsin、belinostat)和 DNA 甲基转移酶 (DNMT) 抑制剂(阿扎胞苷、地西他滨)在内的表观遗传学治疗正在一线和复发环境中进行评估。正在探索的其他策略包括针对 IDH2 突变 AITL 的 IDH2 抑制剂 enasidenib 和valemetostat(见下节表观遗传学治疗)。此外,HDAC抑制与其他通路抑制剂或免疫调节剂联合的多种策略正在进行中;而确定哪些患者从这些联合策略中获益最大的问题很关键。
3.3.间变性大细胞淋巴瘤
第5版 WHO 分类将间变性大细胞淋巴瘤定义为多形性CD30+间变性大细胞片状,且通常不表达T系标志物。有四种不同亚型:ALK- ALCL、ALK+ ALCL、乳房假体相关 ALCL 和皮肤ALCL。CD30的高表达为 CD30 靶向治疗(如具有高缓解率的维布妥昔单抗[BV])开辟了道路。
3.3.1.ALK+ ALCL
ALK+ ALCL见于年轻患者,诊断时的中位年龄为30岁,如果国际预后指数 (IPI) 较低则预后良好。IHC检测到 ALK 则预后较好,对含蒽环类药物方案有反应,ALK患者的5年生存率为79%,而ALK-患者为46%。最常见的染色体易位为t(2,5),其与2号染色体上的 ALKNPM1 结合,从而产生构成性活化激酶,构成性活化的 ALK 可通过激活信号通路(包括JAK/STAT、PI3K/AKT)来驱动细胞增殖和抑制凋亡,并通过 STAT3 介导的 PD-L1 表达促进免疫逃避。ALK+ ALCL的基因组研究也报告有 TP53(11%) 突变,及参与表观遗传修饰 (EP300,KMT2D)、TCR信号传导和 NOTCH1 通路的基因突变。特别重要的是,NOTCH通路激活是二线治疗的靶点,因为在 ALK 抑制剂耐药的 ALCL 细胞系中,用γ-分泌酶抑制剂抑制 NOTCH1 表达可导致细胞凋亡。
3.3.2.ALK- ALCL
除 ALK 表达外,ALK- ALCL具有ALK+ ALCL的所有形态学特征,多发生于较高年龄组,预后介于ALK+ ALCL和其他PTCL组织学之间。两种复发性且互斥的重排(DUSP22和 TP63)分别见于30%和2%的ALK- ALCL。DUSP-22重排ALK- ALCL 具有特征性的 GEP 签名,其特征为 JAK/STAT 通路基因下调、整体 DNA 去甲基化和免疫原性表型。在早期报告中,DUSP22重排与良好的预后相关,5年 OS 率为40-90%,与ALK+ ALCL相当,但最近的研究(包括来自 LYSA 组的大型研究)显示,具有较差体能状态的高危组的4年 PFS 和 OS 仅为17%和21%;但DUSP-22重排 ALCL 的结局仍优于伴TP63重排的 ALK-ALCL 或三阴性ALCL(缺失全部3种重排)。6%的ALK- ALCL存在JAK2 重排,或可提供治疗靶点;这些病例显示典型霍奇金淋巴瘤形态学特征伴CD15表达。
3.3.3 乳房假体相关ALCL
乳房乳房假体相关(Breast implant-associated,BIA) ALCL于1997年首次报道,出现于糙面纤维乳房植入体的囊内,可能与特定的细菌病原体相关,尤其是劳尔氏菌属(Ralstonia)。它通常仅限于植入体周围血清肿液或浅表囊,侵入辅助结构不常见,且与不良预后相关。20号染色体丢失是 BIA-ALCL 的特征。最近的分子学和基因组分析显示,均不存在ALK、DUSP22和 TP63 重排,以及STAT3、STAT5B、JAK1和 JAK2 体细胞突变(导致 JAK-STAT3 通路构成性活化)。超过50%的病例显示 PD-L1 表达,其中大部分伴随9p24.1 gain。治疗包括取出假体和切除所有相关肿块,并对可疑淋巴结进行活检。无相关肿块患者的预期5年 OS 和 PFS 为100%。仅当有包膜外扩散或残留肿块的证据时,才适合全身治疗和/或放疗。
特有治疗策略
BV 联合CHP(环磷酰胺、阿霉素、泼尼松)目前是推荐的一线治疗,因为 Echelon-2研究显示CHOP治疗ALK+ ALCL(IPI≥2) 和ALK- ALCL的5年PFS分别为60%和48%(HR=0.55,p=0.0009)。对于年轻患者,在 CHOP 基础上加用依托泊苷后缓解极高,12年 OS 超过70%,且不考虑ALK状态。一线治疗可治愈3/4的ALK+ ALCL患者,低IPI (0-1)患者不建议接受巩固性移植。对于复发患者,应考虑对化疗敏感的患者进行自体移植。对于ALK- ALCL,DUSP22和 TP63 重排可预测结局;鉴于与ALK+ ALCL的结局相似,DUSP22重排患者可能不需要巩固性移植,但需要更严格地评估。对于ALK+ ALCL,ALK抑制剂已用于治疗复发患者数年,ORR高达88%。Alectinib也是一种具有相似疗效的 ALK 抑制剂。
3.4.成人T细胞淋巴瘤/白血病(ATL)
成人T细胞淋巴瘤/白血病(ATL) 是一种淋巴瘤,在感染人T细胞白血病病毒1型(HTLV-1病毒)的人群中发生率约为5%,该病毒流行于日本、加勒比海、中南美洲部分地区、中东和非洲。有4种临床上不同的形式,临床过程各不相同,即冒烟型、慢性型(根据是否存在高尿素、高乳酸脱氢酶或低白蛋白,分为低危或高危)、急性白血病型和急性淋巴瘤型。急性白血病型、急性淋巴瘤型和高危慢性型患者归为侵袭性ATL,病程进展迅速,包括血液和皮肤受累、肝脾肿大、骨病变、高钙血症,中位生存期不足10个月;而冒烟型和低危慢性型较为惰性。ATL来源于CD4+辅助性 T 细胞,与Treg细胞具有相似的免疫表型。C-C趋化因子受体 4(CCR4) 在超过90%的 ATL 病例中表达,mogamulizumab是一种通过增强抗体依赖性细胞毒性 (ADCC) 杀死CCR4+细胞的去岩藻糖基化(defucosylated)抗体,已在日本获批用于治疗ATL。ATL的淋巴生成(lymphogenesis)既往已经进行总结,下文总结部分近期结果。
最近的 ATL 全基因组测序表明,CCR4功能获得突变与接受 mogamulizumab 治疗的患者生存期延长相关,而 CCR4 表达缺失和 CCR7 基因改变则为耐药机制。此外,超过1/3的 ATL患者还显示 CpG 岛超甲基化,导致肿瘤抑制基因沉默,因此可在临床试验中使用 HDAC 抑制剂(例如panobinostat和belinostat)和去甲基化药物。EZH2过表达在 ATL 中也很常见,可作为治疗靶点。
特有治疗策略
推荐多药化疗作为侵袭性 ATL 患者的一线治疗,包括 CHOP 和长春新碱、环磷酰胺、多柔比星和泼尼松 (VCAP)、多柔比星、ranimustine和泼尼松 (AMP) 以及长春地辛、依托泊苷、卡铂和泼尼松 (VECP)。缓解患者应考虑异基因干细胞移植巩固治疗,因为化疗不无法保持持续缓解。惰性患者可联合使用干扰素 (IFNα) 和叠氮胸苷 (AZT) 治疗。细胞毒化疗可与IFN α和 AZT 联合使用,因为与单独化疗相比的缓解率更高 (81% vs. 49%) 且OS 延长。对于R/R ATL,治疗包括mogamulizumab、来那度胺和valemetostat(基于 EZH2 高表达)(见新药章节)。
3.5.肠道T细胞淋巴瘤
其来源于肠上皮内淋巴细胞 (IEL),且表达粘膜归巢受体CD103。至少有3种临床病理学变体,其中两种侵袭性变体称为EATL(肠病相关T细胞淋巴瘤)和MEITL(单形嗜上皮性肠T细胞淋巴瘤);第三种亚型为胃肠道惰性T细胞淋巴组织增生性疾病,具有更惰性的病程。
EATL 与长期乳糜泻相关,更常见于北欧后裔患者。活检样本均显示存在绒毛萎缩伴隐窝增生和恶性病灶周围上皮内淋巴细胞 (IEL) 增加,即使接受无麸质饮食。虽然EATL也可能在乳糜泻患者中“新发”,但大多数来源于 II 型难治性乳糜泻中异常 IEL 的克隆扩增(RCDII),缺乏表面CD3、CD4、CD8,表达胞内CD3,并经常共表达CD30。最近的全外显子测序表明,JAK/STAT通路经常发生突变,出现STAT5B、JAK3、JAK1和 STAT3 的变化。MAP激酶通路异常(KRAS、NRAS突变)和抑癌基因SETD2的复发性突变也有报道(约30%)。
与之相反,MEITL与麸质敏感性无关,细胞通常为γ/δ亚型,表达CD8+、CD56+及异常CD20+ (20%),但CD30-及CD103+不确定,周围粘膜正常。与 EATL 相比,JAK3和 STAT5B 突变的发生频率更高,大多数 (60–90%) SETD2发生改变,而 JAK1 和 STAT3 突变的发生频率较低。
特有治疗策略
应用异环磷酰胺、长春新碱、依托泊苷 (IVE)/甲氨蝶呤(Newcastle方案)后行自体移植 (ASCT) 治疗,5年 PFS 为52%,OS为60%,与历史上的 CHOP 样治疗相比有所改善,特定的肠穿孔高危患者可考虑预防性肠切除。抗CD30治疗可能对表达 CD30 的 EATL 有效;EATL-001 研究在新诊断EATL 患者中评估了 BV-CHP,ORR 为79%,CR为64%;缓解患者接受巩固性移植,2年时没有患者复发。其他潜在的治疗选择包括JAK/STAT 抑制剂芦可替尼,已在 RCDII 细胞系中评估,可抑制进展为成熟EATL。此外,蛋白酶体抑制剂硼替佐米导致 RCDII 细胞系中 STAT3 磷酸化并抑制生长。
3.6.肝脾T细胞淋巴瘤 (HSTCL)
该罕见疾病来源于γ/δT细胞,发生于中位年龄为35岁的年轻男性。恶性细胞可为 CD4 和 CD8 均阴性,并以明显的窦状(sinusoidal)形式浸润肝、脾和骨髓。在10-20%的病例中,英夫利西单抗和硫嘌呤似乎与自身免疫性疾病和长期免疫抑制相关。预后较差,治疗尚无共识。HSTCL的全外显子组测序发现,表观遗传学修饰因子(约70%为SETD2)、JAK/STAT通路 (STAT5B、STAT3)、PI3K通路以及 TP53 和IDH2突变存在复发性改变。
特有治疗策略
目前尚无标准治疗,但获得缓解的患者采用异环磷酰胺、卡铂、依托泊苷 (ICE)、异环磷酰胺、美司钠、依托泊苷和阿糖胞苷 (IVAC) 进行强化诱导,然后考虑早期进行异基因干细胞移植是可靠的。欧洲登记研究报告该方案的3年 PFS 为48%,一项系统性审查报告的3年 PFS 和 OS 分别为42%和56%。鉴于潜在的化疗耐药性和最近发现的可靶向通路,多种药物正在进行中,包括靶向 SETD2 突变的 WEE1 抑制剂、STAT5B抑制剂和 PI3K 抑制剂idelalisib。
3.7.淋巴结EBV阳性T细胞和NK细胞淋巴瘤
既往作为PTCL,NOS的一个亚型,而第5版 WHO 将淋巴结EBV+ T/NK细胞淋巴瘤视为一种独特的临时亚型。它是一种基于淋巴结的疾病,可能播散至结外部位,但不累及鼻腔,占PTCL,NOS的5%-30%,在东亚人和老年人和/或免疫缺陷人群中更常见。与结外 NK/T 细胞淋巴瘤 (ENKTL) 的区别在于其较高的T 细胞来源的频率、免疫表型 (CD8+、CD56-)、缺乏血管中心性生长和坏死及预后较差,中位 OS 仅4.6个月。在分子水平上,EBV+ T/NK细胞淋巴瘤不像 ENKTL 那样表达高基因组不稳定性,且在 NF-κB和免疫相关通路(BIRC3、CD27和PDL1)的异常率较高。复发性突变包括TET2(约67%)、STAT3、DDX3X,TP53 改变不常见。
特有治疗策略
HDAC 抑制剂的表观遗传学治疗可以重新激活 EBV 裂解循环,并通过磷酸化将抗病毒前体药物转化为细胞毒性形式,从而能够特异性杀伤EBV+ 细胞。一项小型研究在EBV+淋巴瘤中联合使用nanatinostat(HDAC抑制剂)与缬更昔洛韦,ORR为60%,CR为27%。该联合方案正在 II 期试验(NCT05011058)中探索。
3.8.结外NK/T细胞淋巴瘤(ENKTL)
ENKTL在亚洲和中/南美洲普遍存在(占所有成熟 NK/T 淋巴瘤的20-25%),但在欧洲和北美罕见;多影响中年人,具有典型的侵袭性病程。ENKTL具有异质性,包括来源于NK(细胞质CD3+、CD56+、CD8-,缺乏T细胞克隆性)或 T 细胞(表面CD3+伴单克隆 TCR 基因重排)存在差异。几乎均出现于结外部位,最常见的是上呼吸消化道、皮肤、胃肠道和睾丸。均为 EBV 阳性。前瞻性国际 T 细胞项目报道,鼻腔病变患者的5年 OS 为54%,鼻外疾病患者的5年 OS 为34%,肿瘤对左旋门冬酰胺酶和放疗敏感。通过定量 PCR 测量 EBV-DNA 病毒载量具有诊断和预后价值,NCCN建议作为初始检查的一部分。
ENKTL 具有化疗耐药性,部分原因在于 P-糖蛋白基因的高表达及TP53 突变、抗凋亡蛋白(BCL-XL和BCL2)和 FAS 基因突变引起的细胞凋亡通路失调。较常见通过 PD-1 上调(由 CD274 扩增、3`非翻译区[UTR]或LMP1/STAT3驱动)来逃避免疫截断,免疫检查点阻断对 R/R有效。一项多组学研究定义了 ENKTL 中具有不同预后和潜在治疗的三种分子学亚型:TSIM亚型以JAK–STAT通路活化、NK细胞来源和 PD-L1 过表达为特征;MB亚型富集 MYC 过表达,并与不良结局相关;而 HEA 亚型与表观遗传学改变、NF-κB活化、T细胞起源相关,并具有最佳预后。这三种亚型在体外对 PD-1 抗体、MYC抑制剂和 HDAC 抑制剂表现出不同的治疗易损性。
特有治疗策略
局限期 ENKTL 可采用包括放疗和化疗在内的综合治疗方式进行治疗。对于晚期病变,含左旋门冬酰胺酶的治疗方案如SMILE(地塞米松、甲氨蝶呤、异环磷酰胺、左旋门冬酰胺酶和依托泊苷)和P-GEMOX(培门冬酶、吉西他滨和奥沙利铂)为首选一线治疗。巩固放疗可改善疾病控制。
R/R ENKTL 中的新药包括免疫检查点阻断药、CD38单克隆抗体(基于 CD38 表达)、使用自体 EBV 特异性细胞毒性 T 细胞的过继性细胞疗法和 HDAC 抑制剂(例如西达本胺),以及密切监测病毒再激活。
4.PTCL的治疗原则
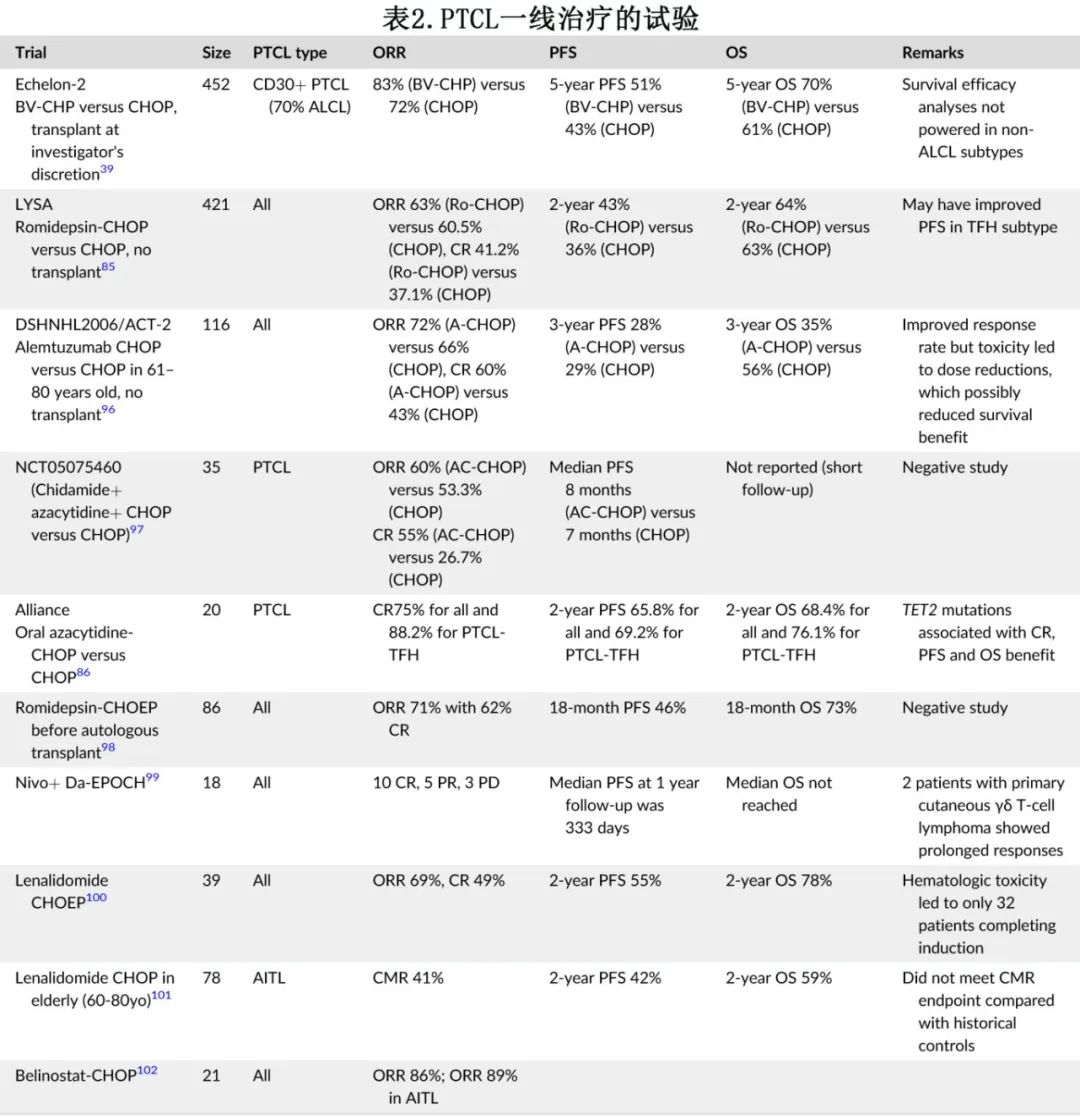
4.1.一线治疗
一般而言,回顾性和多项前瞻性登记研究均表明,PTCL患者的预后较差,以蒽环类药物为基础的治疗方案下ALK+ ALCL的预后显著优于ALK- ALCL、PTCL-NOS和AITL;ATL(14%)、EATL(20%) 和 HSTCL(7%) 的5年结局最差。根据NCCN,PTCL 一线治疗为含蒽环类的化疗方案(例如,年轻患者给予CHOP 或CHOEP),或ALCL 和其他表达CD30的亚型(CD30表达≥10%)给予BV-CHP(基于ECHELON-2研究)。在 CHOP 基础上加用依托泊苷改善ALK+ ALCL的生存期最明显,但在其他亚型中,未发现依托泊苷的显著 OS 获益。ECHELON-2随机分配226例 CD30 表达≥10%的新诊断 PTCL (70%为ALCL) 患者接受 BV-CHP 或 CHOP 治疗,并由研究者决定是否进行巩固ASCT;结果BV联合化疗优于单纯化疗,中位 PFS 分别为48个月和21个月,HR为0.71,表明复发风险降低29%。五年随访显示缓解的持久性,接受 BV-CHP 和 CHOP 的患者 PFS/OS 分别为51%/70%和43%/61%。在非 ALCL 亚型中,亚组分析报告 PFS对的HR 为0.96(95%CI 0.63–1.47),可能表明 BV-CHP 与 CHOP 相比缺乏获益,然而事实上在非 ALCL 亚型中疗效的效力不足。该关键研究导致FDA批准
BV+CHP作为所有CD30+ PTCL的一线治疗,尽管非 ALCL 亚型的患者代表性不足。值得注意的是,IHC检测的 CD30 表达无法预测维布妥昔单抗的临床获益,CD30≥10%或<10%的 ORR 或中位 DOR 无差异。
表2列出了近期部分纳入新药以改善一线治疗结局的研究,但还需要进一步的试验来验证。例如,虽然在未经治疗的 PTCL 患者中比较romidepsin (Ro)-CHOP 与 CHOP 的 LYSA III 期研究未达到主要终点,但在 TFH 亚型患者中进行的 PFS 探索性分析发现,Ro-CHOP 组相比 CHOP 组的中位 PFS 分别为20和11个月 (HR=0.69,p=0.046)。类似地,一项在 CHOP 前联合口服阿扎胞苷作为预激治疗的单臂 II 期研究,显示令人鼓舞的 ORR 为75%(均为CR),2年 PFS 率为69%,与单独使用 CHOP 的历史数据相比似乎有所改善。因此应在大型试验中进一步探索表观遗传学治疗在特定亚型中的应用。无化疗方法也正在不适合移植的患者中进行试验。最近的一项 II 期研究在23例新诊断≥60岁 PTCL 患者中检查了romidepsin和来那度胺的无化疗方案,发现有希望的 ORR 为65% (CR 26%),2年 PFS/OS 率为32%/50%,且AITL的缓解率更高 (ORR 79%,CR 36%)。
基于研究,大剂量化疗和 ASCT 已用作化疗敏感性适合移植患者的巩固治疗策略,可导致淋巴结组织学结局出现一定程度的改善,且移植前达到 CR 是 OS 改善的预后因素。美国一项前瞻性登记研究 (COMPLETE) 评价了 ASCT 在首次完全缓解期的作用及其对临床结局的影响,虽然对整个队列无益,但 ASCT 可能为晚期或中-高危IPI 患者提供生存获益。在 AITL 患者中,联合 ASCT 显著改善OS;国际 T 细胞项目中入组的 AITL 患者接受移植后 PFS 和 OS 也获得类似改善。一项评价自体与异基因移植作用的随机 III 期研究,在高危淋巴结 PTCL 患者中发现相似的 PFS 和 OS 结局,但失败模式不同,自体移植具有更高复发率,而异基因移植具有更高的非复发死亡率。ECHELON-2 试验的亚组分析中评价了 BV-CHP 后巩固 ASCT 对治疗结束时达到 CR 患者的影响,结果ASCT 的 PFS 优于无 ASCT 的患者(5年PFS 65.3% vs. 46.4%)。
NCCN 指南建议,初次治疗后达到 CR 或 PR 且适合移植(基于年龄和合并症)的淋巴结侵袭性 PTCL 患者应考虑ASCT;但HSTCL 和ATL除外,由于固有的化疗耐药性,它们具有非常侵袭性的临床病程。还需要进行研究以确定可通过单独化疗进行管理的低危患者。
4.2.复发和/或难治性疾病
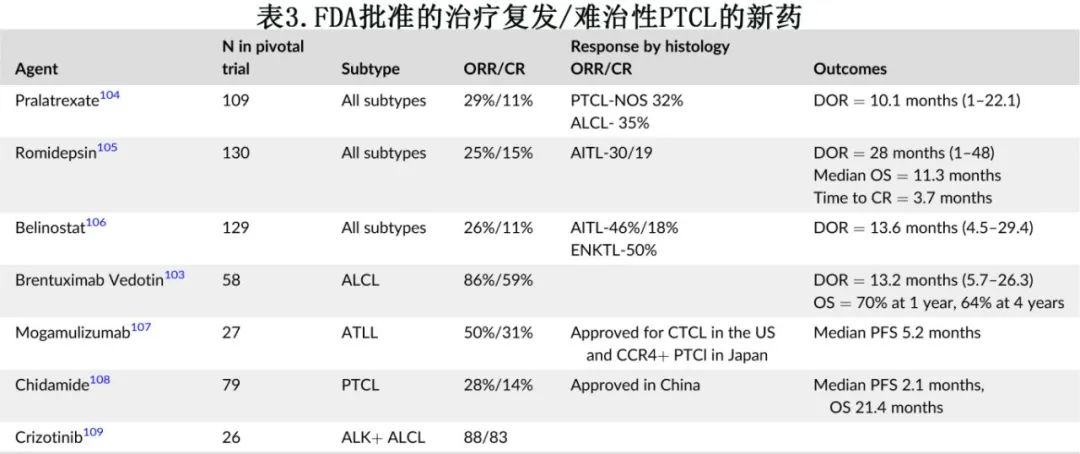
复发和/或难治性患者目前尚无标准疗法。建议在可能的情况下考虑进行临床试验。FDA批准了一些单药治疗复发性PTCL,总结见表3。大多数药物的缓解率较低,缓解持续时间不久,最终会复发。
挽救治疗应视为姑息治疗或移植的桥接。最近的大型系列研究报告,与历史数据相比,接受异基因移植的患者的结局更佳,突出了异基因移植的潜在治愈性质。ESBMT和 CIBMTR 之间的合作报告了1942例接受异基因移植的PTCL-NOS、AITL和ALCL患者,3年 PFS 和 OS 分别为48–52%和60–64%。一项纳入12家美国机构508例所有亚型 T 细胞淋巴瘤患者的大型回顾性研究也报告,5年 PFS 和 OS 率分别为40%和51%。
目前正在评估多种靶向表观基因组突变、细胞周期信号通路、肿瘤微环境和细胞表面受体的新药,期结果令人满意(图1)。
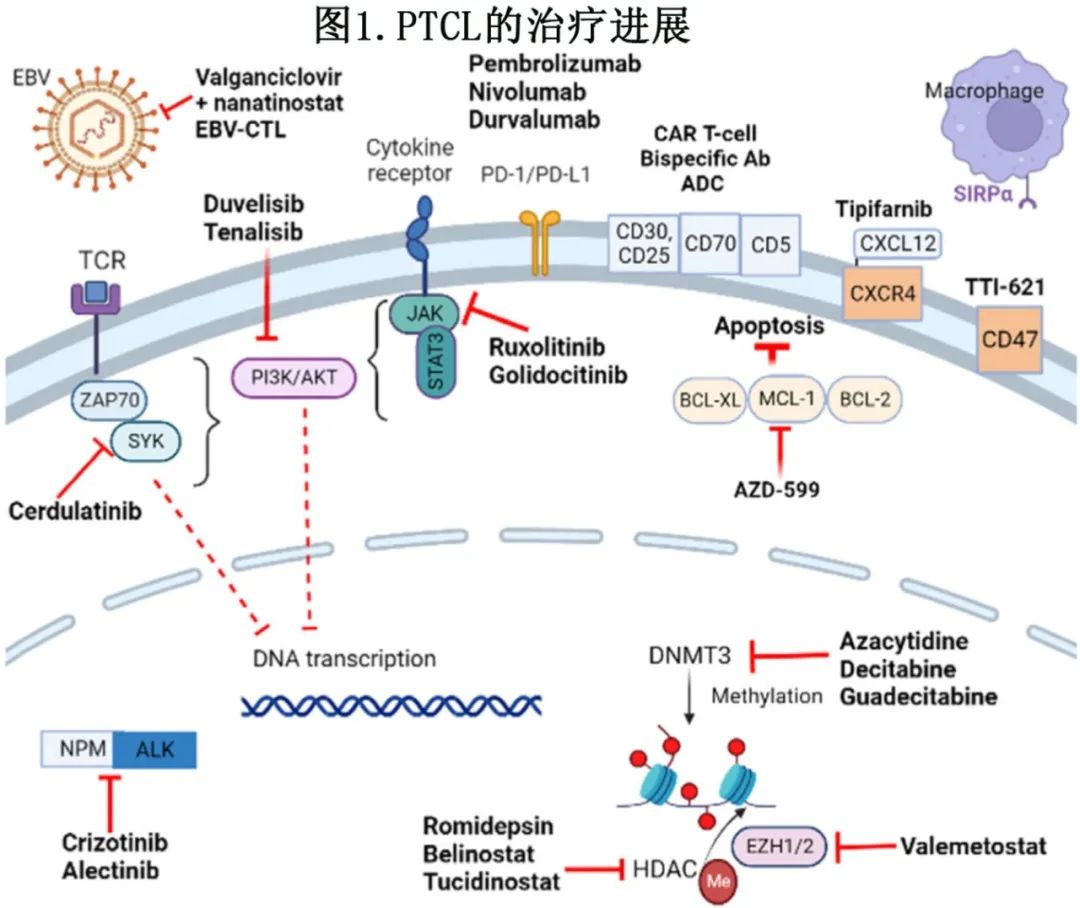
表4总结了临床试验中的一些潜在新药及其靶点,并在下文中详细讨论。靶向生物学驱动 PTCL 的联合治疗很有前景,因为其潜在的协同作用可能导致更深度的缓解,但目前研究的联合治疗的 PFS 结局仍不理想,表明需要做更多的工作来了解 PTCL 的耐药机制。
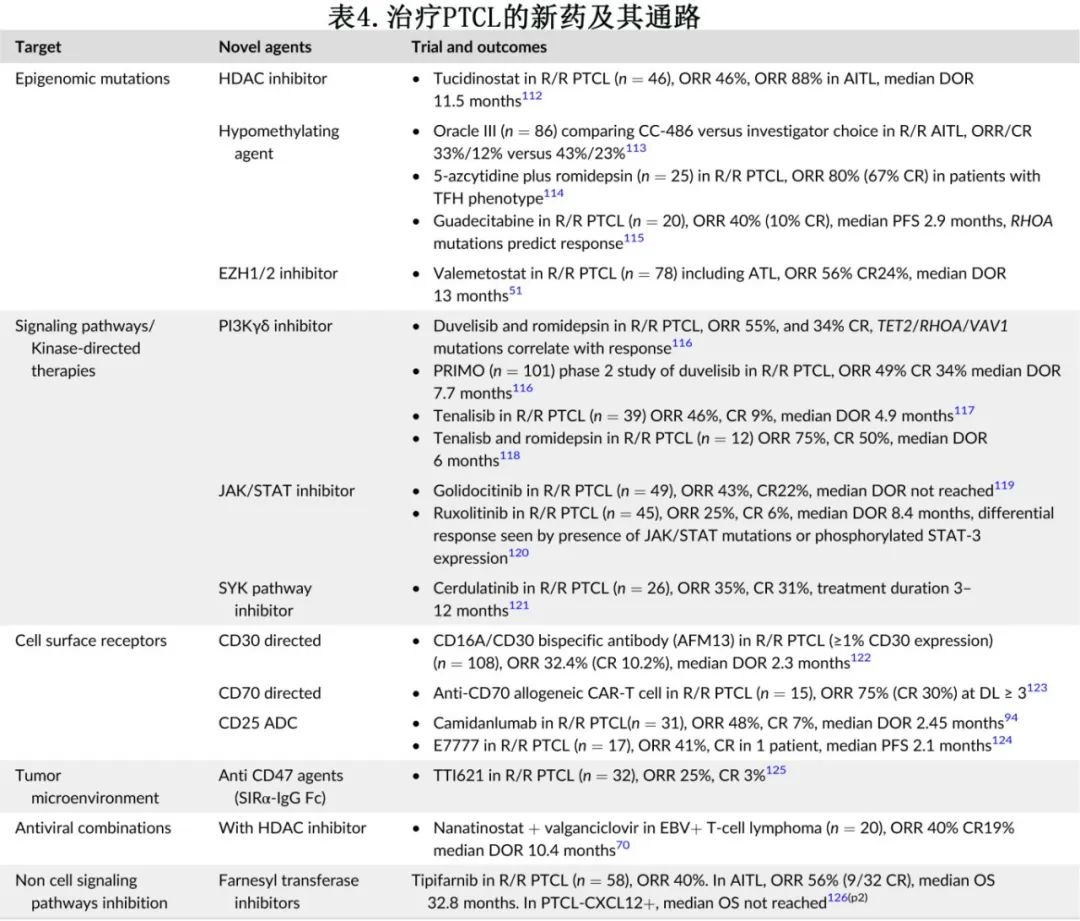
4.2.1.维布妥昔单抗
无论 ALK 状态如何,肿瘤坏死家族受体 CD30 在 ALCL 中均普遍表达,维布妥昔单抗在 R/R ALCL 中已证明其安全性和疗效,长期随访下可持续缓解 (ORR 86%,CR 66%),且ALK阴性和 ALK 阳性 ALCL 患者的缓解相似。接受维布妥昔单抗治疗后达到CR(即使未接受移植巩固治疗)的患者5年 OS 率较高(79% vs 25%),且5年 PFS 为48%。这些数据以及 REAL 联盟的数据显示,无论联合或不联合巩固性移植,接受新药(维布妥昔单抗、ALK抑制剂)治疗的R/R ALK+ ALCL患者的5年 OS 数据相似,表明在不联合移植巩固的情况下也可能获得长期疾病控制。维布妥昔单抗单药已获得 FDA 批准用于治疗 R/R 系统性 ALCL。还在R/R CD30+ (≥5%)PTCL患者中评估了维布妥昔单抗吉西他滨联合治疗,ORR 为47%,且缓解患者的 DOR 较长,为15个月。
4.2.2.获批的表观遗传学治疗
表观遗传学修饰和调节基因(例如TET2、IDH2、DNMT3A)异常引起的表观遗传学信号变化与肿瘤抑制基因沉默相关,在 AITL 和 TFH 淋巴瘤中尤其常见。表观遗传学介质EZH2(zeste同源物2的增强子)的异常表达或突变也可导致转录沉默,且已在 PTCL 的多种亚型中发现,包括 HSTCL 和ATL。在这类药物中,romidepsin和belinostat已获批用于治疗R/R PTCL。尽管一线romidepsin+CHOP对比CHOP 的试验未达到主要终点,后romidepsin在2021年被撤销加速批准,但NCCN仍考虑将其作为重要选择。HDAC 抑制剂治疗R/R PTCL 的真实世界数据显示,TET2、DNMT3A、RHOA突变的 TFH 表型对 HDAC 抑制的反应优于无 TFH 基因签名的患者(ORR为57% vs. 30%),可能与这些亚型的表观基因组功能障碍程度更大有关。
4.2.3.间变性淋巴瘤激酶抑制剂
克唑替尼是一种 ALK 抑制剂,FDA批准用于治疗R/R ALK+ ALCL儿童患者,其批准是基于克唑替尼在26例儿童患者中的单臂研究,显示 ORR 率为88%。一项 I 期研究评价了9例既往接受过多线治疗的R/R ALK+ ALCL成人患者,结果100% CR。还在10例患者中评价了二代 ALK 抑制剂Alectinib,结果8例缓解和6例CR。正在评价克唑替尼联合细胞毒化疗作为ALK+ ALCL患者一线治疗的一部分 (NCT01979536)。体外研究显示克唑替尼和维布妥昔单抗具有协同活性,目前正在设计临床试验以评价该联合方案。
5.超说明书用药和研究性药物
5.1.表观遗传学治疗
阿扎胞苷和地西他滨是 DNMT 抑制剂,正在R/R PTCL 中积极研究。一项在19例 R/R PTCL 患者中进行的阿扎胞苷研究显示,AITL患者的 ORR 为75%,而其他亚型患者为15%,且缓解患者携带 TET2 突变。真实世界数据显示,多线治疗的 R/R AITL患者中阿扎胞苷的 ORR 为40%。然而,ORACLE III 期研究纳入86例R/R AITL 或 TFH 淋巴瘤患者,比较口服阿扎胞苷与研究者选择的药物,在主要终点 PFS 方面未达到所需的p<0.025的显著性,中位 PFS 分别为5.6个月和2.8个月 (p=0.0421);研究者将结果归因于效力不足。Valemetostat是 EZH2 和 EZH1 的双重抑制剂,可通过改变组蛋白甲基化以增加促凋亡和抑癌基因的表达,导致细胞生长停滞。在一项 I 期研究中,45例 R/R PTCL 患者接受valemetostat 单药治疗,ORR为48%;副作用主要是血小板减少 (59%) 和味觉障碍 (51%)。Valemetostat目前在日本获批用于治疗R/R ATL,但尚未获得 FDA 批准,等待 II 期注册研究的结果。
试验和真实世界数据还表明,表观遗传学或HDAC 抑制剂与新药联合可能有希望改善缓解率,尤其是在 R/R TFH-PTCL 中。也正在试用。一项在25例 R/R PTCL 患者中评价romidepsin和阿扎胞苷的 II 期研究报告有希望的缓解率为61% (48% CR)。一项在26例患者(其中23例为 AITL 或 TFH 淋巴瘤)中评价romidepsin和阿扎胞苷的真实世界研究,ORR 为73%,CR为53%,且发现TET2、RHOA、IDH2和 DNMT3A 等常见突变。其他联合治疗包括romidepsin和来那度胺,ORR约为50%,中位 PFS 为5.7个月,且患者可桥接移植。基于在小鼠模型中的协同作用,romidepsin也可与普拉曲沙联合使用,在14例 PTCL 患者中显示 ORR 为71%,29%达到CR,中位 PFS 为4.4个月,中位 OS 为12.4个月。还研究了 HDAC 抑制剂panobinostat联合硼替佐米(可抑制NF-κB,后者在部分PTCL 中上调),显示 ORR 率为43%,中位 PFS 和 OS 分别为2.6和9.9个月。
5.2.PI3K抑制剂
PI3K/AKT/mTOR 信号通路的构成性激活在 PTCL 中很常见,PI3Kδ通路(影响淋巴细胞增殖、存活和分化)和PI3Kγ通路(促进微环境中免疫抑制性肿瘤相关巨噬细胞的迁移和活化)的双重靶向作用已成为 PTCL 中有前景的治疗选择。已在 R/R PTCL 患者中评价了 Duvelisib 和tenalisib(口服PI3Kγδ抑制剂)。基于 II 期 PRIMO研究,Duvelisib作为潜在二线药物被 NCCN 概要列出,该研究在101例既往多线治疗的 PTCL 患者中评价了Duvelisib,报告的 ORR 率为49%(CR 34%),中位缓解持续时间 (DOR) 为7.7个月;PTCL-NOS(ORR 48%) 和 AITL(ORR 67%) 患者的结局明显优于 ALCL 患者 (ORR 13%);≥2级毒性包括肝功能检查值升高、发热、咳嗽和血细胞减少。Tenalisib是PI3Kγδ和SIK3的试验性抑制剂,在28例多线治疗的 R/R PTCL 患者中进行评价,初步数据显示 ORR 为45%,中位 DOR 为4.1个月。但鉴于 PI3K 抑制剂的毒性,还需要进一步了解各种基因突变与不同亚型缓解和耐药的相关性,以做出合理决策。
基于体外协同作用,一项早期研究评价了 duvelisib 和 romidepsin 联合用药,结果AITL 与其他亚型相比 ORR 高达71%,且TET2、RHOA、LOF和 VAV1 突变与缓解相关。与 duvelisib 单药 (40%) 相比,该组合的≥3级转氨酶升高的发生率较低 (8%),表明romidepsin对 PI3K 抑制剂相关的肝炎具有潜在的免疫调节作用。另一项 I/II 期研究报告称,R/R PTCL患者接受romidepsin联合tenalisib(PI3Kγδ和SIK3抑制剂)治疗后缓解率较高 (ORR 75%,CR 50%)。
5.3.免疫调节剂
来那度胺通过诱导细胞凋亡具有免疫调节活性,在R/R PTCL (ORR 22–30%) 中显示出一定单药活性。单药来那度胺纳入NCCN纲要列表中 PTCL 姑息治疗。
5.4.检查点抑制剂
抗 PD1 免疫检查点阻断策略在早期临床试验的结果混淆,最佳结果似乎是在与 EBV 相关的组织学中,可能是由于 EBV 病毒蛋白上调 PD-1 受体水平。作为单药,抗 PDL1 抗体(包括avelumab、纳武利尤单抗和帕博利珠单抗)在未经选择的 R/R PTCL 患者中显示出中度应答。但观察到过度进展的病例,因为 PD-1 在某些亚型中作为肿瘤抑制因子发挥作用,检查点抑制剂有可能加速现有的 T 细胞淋巴瘤或重新激活 T 细胞克隆。帕博利珠单抗和纳武利尤单抗被 NCCN 列为 R/R 结外 NK/T 细胞淋巴瘤的首选治疗。PD-1 免疫疗法联合表观遗传修饰剂正在研究中,因为表观遗传学治疗可能通过逆转髓源性抑制细胞的免疫抑制作用使肿瘤细胞对检查点抑制剂敏感。一项 II 期研究评估了romidepsin与帕博利珠单抗联合治疗既往多线治疗R/R PTCL,ORR 为50%,但仍观察到过度进展。一项小型 I 期研究评价了帕博利珠单抗与地西他滨和普拉曲沙治疗 R/R PTCL,三联治疗下2/3应答。
5.5.Mogamulizumab
CCR4 主要在 ATL 中表达,也在其他 PTCL 中表达,包括ALK- ALCL(65%)、PTCL- NOS(40%)、
和 AITL(40%)。Mogamulizumab是一种人源化、IgG1单克隆抗 CCR4 抗体,通过 ADCC 对 CCR-4 阳性淋巴瘤细胞具有直接细胞毒作用,诱导细胞介导的裂解。虽然基于报告 ORR 为65%和中位 PFS 为7.4个月的 II 期结果,mogamulizumab在日本获批用于治疗复发性ATL,但一项比较 mogamulizuab 与美国研究者选择的化疗的研究显示,两组的 ORR 相似,均为11%。该差异可能是因为日本与美国(加勒比海)ATL变体中的临床和遗传变异性,但最近的基因组研究确定了影响 mogamulizumab 临床结局的生物标志物,可能会改善获益患者亚组的选择。mogamulizumab已在美国获批用于CTCL,但未获批用于淋巴结 PTCL 或ATL。
5.6.JAK抑制剂
Janus 蛋白表现出使细胞因子受体磷酸化的酪氨酸激酶活性 (JAK1,JAK2,JAK3,TYK2),导致与增殖、分化和存活相关的 STAT 蛋白转录激活。PTCL中 JAK/STAT 通路的改变很常见,包括PTCL-NOS(27%)、ALK- ALCL(57%)、AITL(29%)、T细胞大颗粒淋巴细胞白血病 [T-LGL](40%) 和γδT细胞淋巴瘤 (33%)。芦可替尼在45例 R/R PTCL 患者中进行的II 期研究报告了临床获益率的差异(完全或部分缓解,或持续6个月的疾病稳定 [SD]),取决于 JAK/STAT 改变的生物标志物。最高临床获益见于 JAK 和/或 STAT 激活突变患者 (53%),其次为IHC 显示 pSTAT3 表达≥40%的患者(45%),而无生物标志物表达的患者仅显示13%的临床获益率。按亚型区分,TFH淋巴瘤、AITL和 T-LGL 的缓解率最高。最常见的≥3级副作用为细胞减少症。Golidoctinib是一种口服 JAK1 特异性抑制剂,正在51例 R/R PTCL 患者中进行评价, ORR 为43%,具有良好的安全性特征(29%≥3级中性粒细胞减少和10%≥3级血小板减少)。
5.7.抗CD25抗体
T 细胞活化 (CD25) 是异源三聚体 IL-2 受体的α亚基,见于40%-50%的所有PTCL,针对CD25 的抗体药物结合物显示可喜的结果。Camidanlumab tesitine是一种与细胞毒性吡咯苯二氮卓类二聚体偶联的 CD25 抗体,在 PTCL 患者中显示出良好的缓解 (ORR 48%)。E7777是一种由白喉毒素和人 IL-2 组成的重组融合蛋白,已在一项 II 期研究中CD25+ (≥20%) PTCL中进行了研究,ORR为41%,副作用可管理(给予类固醇预治疗,以降低毛细血管渗漏综合征的发生率)。虽然缓解与CD25 表达相关,但一项伴随研究中CD25+ 细胞<20%的患者仍可达到31%的ORR,意味着CD25表达并不妨碍E7777作为这些患者的治疗选择。
5.8.抗CD47抗体
CD47 表达增加通过与信号受体蛋白α (SIRPα) 的相互作用,导致巨噬细胞和树突状细胞介导的吞噬细胞增多抑制信号,抗 CD47化合物抑制 CD47 信号可促进巨噬细胞吞噬肿瘤细胞。Magrolimab是一种抗 CD47 单克隆抗体 (HU5F9-G4),已在体外和小鼠的人源性异种移植 (PDX)模型中进行研究,但发现 PTCL-NOS 细胞系具有耐药性。TTI-621(SIRPα-IgG1 Fc) 是一种“诱骗受体”,可与 CD47 结合,I期研究发现有单药疗效,32例 T 细胞淋巴瘤患者中ORR 为25%。
5.9.抗KIR3DL2抗体
KIR3DL2 是杀伤免疫球蛋白样受体 (KIR) 家族的抑制性受体,在急性型ATL(90%)、PTCL-NOS(32%) 和 ALK- ALCL(24%) 中表达,可以使用单克隆抗体 (lacutamab) 进行靶向治疗。一项 Ib 期试验目前正在评价 lacutamab 在表达KIR3DL2(≥1%) PTCL的患者中的疗效 (NCT05321147);但在发生非预期致死性不良事件嗜血细胞性淋巴组织细胞增生症后,该试验目前被暂停。
5.10.细胞疗法
靶向 T 细胞淋巴瘤的CAR-T 细胞设计已经落后于 B 细胞恶性肿瘤,原因在于担心自相残杀(fratricide)、免疫抑制对 T 细胞再生障碍的潜在挑战以及生产自体 CAR-T 细胞时恶性 T 细胞的产品污染。正在开发使用基于基因组的基因编辑技术来选择合适的靶抗原和/或敲除泛 T 细胞标志物 (CD3/CD7) 的策略来减轻自相残杀。早期研究中有多种 CAR-T 结构,CD5 CAR-T 细胞在9例 R/R PTCL 患者中的4例产生应答,允许桥接至异基因移植;CD30 CAR-T 细胞也显示出良好的细胞扩增和对 PTCL 异种移植瘤的细胞毒活性;CD37是部分PTCL 上表达的潜在靶点,CD37 CAR-T 细胞在体外对 PTCL 细胞具有抗肿瘤活性;针对 CD70 的异基因CAR-T 细胞在18例 R/R PTCL 患者中有令人鼓舞的疗效和可耐受的安全性特征,≥3(≥3X108个细胞)剂量水平下 ORR 为70%,CR率为30%;无剂量限制性毒性、≥3级细胞因子释放综合征或≥3级免疫效应细胞相关神经毒性综合征。最后,靶向 T 细胞抗原的双特异性抗体正在开发中,AFM13(一种肿瘤细胞上CD30结合NK细胞上 CD16A 的 CD30/CD16A 双特异性抗体)的 II 期研究显示初步疗效 (ORR 32.4%,CR 10.2%)。
5.11.抗凋亡治疗
BCL2、MCL1和 BCL-XL是抗凋亡蛋白,可阻止 BAX 和BAK(通透线粒体外膜的凋亡效应器)的活化,细胞应激以特异性或包容性方式上调与抗凋亡蛋白 (BCL2、MCL1) 结合的 BH3 蛋白。PTCL中 MCL-1高表达。Koch等使用 BH3 分析评估了细胞对不同 BH3 肽进行线粒体外膜通透性化的能力,发现大多数 TCL 来源的细胞系对 MCL1 表现出选择性依赖性,然后用 MCL1 抑制剂AZD599±CHOP处理异种移植这些 PDX 的小鼠,肿瘤缩小良好。基于该数据,正在 R/R PTCL 患者中研究 MCL1 抑制剂(PRT1419-NCT04543305)。在 BCL2 阳性 R/R PTCL 患者的前瞻性 II 期试验中,发现 BLC2 抑制剂维奈克拉仅对少数患者具有活性,17例入组患者中1例 CR 和2例SD。
5.12.法尼基转移酶(Farnesyltransferase)抑制剂
CXCL12 是一种趋化因子,负责 T 细胞归巢和维持免疫细胞祖细胞,在高达50%的 AITL 中表达。Tipifarnib是法尼基转移酶的口服抑制剂,可下调 CXCL12 的分泌。一项 II 期研究评价了既往多线治疗的 AITL 或 PTCL-NOS 患者使用 tipifanib 的作用。AITL 队列有11例可评价患者的 ORR 为45%;在3例可评价的CXCL12+ PTCL患者中,1例患者治疗后PR,2例患者治疗后SD。CXCL12 表达与治疗的有利结局相关。
6.结论性意见
作者提供了侵袭性 T 细胞淋巴瘤治疗全景的广泛概述。由于采用当前治疗方法时 PTCL 患者的结局仍然较差,因此在未来几年中,基于突变特征来评价生物标志物引导的治疗策略对于改进治疗范例至关重要。许多以靶向通路或发病机制相关改变为基础的药物已显示出前景,尤其是在复发性或难治性疾病中,其对促进桥接异基因移植很有价值。细胞疗法在 T 细胞淋巴瘤中仍处于起步阶段,但异基因 CD70 CAR-T 细胞疗法的第一份大型报告暗示了其前景。基于组织学、突变和其他生物学替代品的治疗范例的进一步完善,可以预期的是,未来几年治疗会持续进展,治疗范例也会进一步改善。
参考文献
Ong SY, Zain JM. Aggressive T-cell lymphomas: 2024: Updates on diagnosis, risk stratification, and management. Am J Hematol. 2024;1‐18. doi:10.1002/ajh.27165
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#风险分层# #侵袭性T细胞淋巴瘤#
33