武爱文教授:2022年度结直肠癌治疗进展
2022-12-17 肿瘤界 肿瘤界 发表于上海
翟建宁1,王晰程2,武爱文1(1.北京大学肿瘤医院暨北京市肿瘤防治研究所 北京大学肿瘤医院 胃肠肿瘤中心三病区 恶性肿瘤发病机制及转化研究教育部重点实验室
翟建宁1,王晰程2,武爱文1(1.北京大学肿瘤医院暨北京市肿瘤防治研究所 北京大学肿瘤医院 胃肠肿瘤中心三病区 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;2.北京大学肿瘤医院暨北京市肿瘤防治研究所 北京大学肿瘤医院 消化肿瘤内科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
基金项目:国家自然科学基金(82173156);北京市医管中心临床医学发展专项“扬帆”计划重点培育项目(ZYLX202116)
通信作者:武爱文
E-mail:wuaw@sina.com
【摘要】 在全球范围内结直肠癌已经是最常见的癌症之一。近些年来,结直肠癌持续上升的发病率给社会经济带来了巨大压力。尽管治疗手段在不断地进步,但是结直肠癌的死亡率仍居高不下,这需要持续不断提高和探索治疗的新模式。可将结直肠癌的治疗分为围手术期治疗和转移性结直肠癌治疗。在围手术期治疗中,从传统开腹手术发展到腹腔镜辅助或机器人辅助手术,这种技术的进步改善了结直肠癌患者术后康复和生存预后。为进一步提高患者的整体生存预后,全程新辅助治疗的推广及免疫检查点抑制剂在微卫星不稳定型结直肠癌中的应用极大地提高了患者的长期生存率和器官保留率,是围手术期治疗的重要组成部分。在转移性结直肠癌治疗中,虽然化疗和靶向药物的进步对生存率有所提高,但是其整体的疗效尚未达到预期效果,特别是相关基因突变导致的难治性转移性结直肠癌的治疗。因此无论是对于局部进展期结直肠癌还是转移性结直肠癌,需要更多的研究去探索和验证结直肠癌的新治疗模式,才能不断地提高结直肠癌的治疗效果。本文将回顾并介绍2022年度结直肠癌治疗的新进展。
【关键词】 结直肠癌;围手术期治疗;全程新辅助治疗;免疫检查点抑制剂;转移性结直肠癌
据GLOBOCAN 2020数据估算,2020年中国估计有555 477例新诊断的结直肠癌(CRC) 和28 ,162例CRC相关死亡[1],在新发癌症病种中排在第二位[2]。结直肠癌对我国人民的健康及社会经济的压力在逐年上升。可喜的是,随着诊断治疗技术的进步,结直肠癌的治疗效果随着诊断治疗技术的进步也在逐步改善。2022年结直肠癌治疗领域研究结果丰硕,呈现出治疗精细化、个体化的态势。笔者汇总2022年内的相关重要文献、学术会议报告,并征询部分专家的意见,围绕手术治疗、围手术期治疗策略、患者管理及康复、转移性结直肠癌的治疗等话题进行简要回顾和点评,以飨读者。
01、手术治疗
1.1 手术方式及入路 手术治疗仍是目前结直肠癌治疗最有效的手段,近年微创外科得到了广泛的发展,腹腔镜结直肠手术比重越来越高,机器人手术方兴未艾。新技术的评价涉及患者安全和肿瘤学结局,也涉及人群选择和卫生经济学评价。
腹腔镜结肠癌手术已经作为标准手术方式被推荐,而对直肠癌而言,开腹手术是标准,腹腔镜手术的应用尚存在不同意见,尤其对于低位直肠癌。池畔教授牵头的一项随机临床试验LASRE研究比较了低位直肠癌腹腔镜手术与传统开腹手术的短期疗效,结果显示腹腔镜组与开腹组病理结果无差异,腹腔镜组较开腹组的括约肌保留率更高(71.7%:65%),且住院天数更短(8 d:9 d)[3]。提示直肠癌腹腔镜手术有助于患者术后康复,提高括约肌保留率。值得关注的是,一方面需要等待肿瘤学的远期结局如局部复发和远期生存数据,还需要注意该研究参与者为严格质控筛选过的结直肠癌外科医生,提示研究结果的推广需建立在良好的手术质控的基础上。无独有偶,经腹入路与经腹经肛入路腹腔镜手术(杂交TaTME)的比较亦然。康亮教授牵头的研究显示,对腹膜返折以下的Ⅰ~Ⅲ期直肠癌,taTME组和laTME组在术后并发症及病理结果上没有明显差异,表明了taTME术式的安全性[4]。
微创手术后的辅助切口免除近年受到国内外同行的关注。经自然腔道取标本的结直肠癌根治术(Natural Orifice Specimen Extraction Surgery,NOSES)是融合免除辅助切口、全腔镜下吻合等综合技术,是经自然腔道手术(NOTES)的基础和铺垫。王锡山教授牵头的登记研究汇总全国39个中心、5055例Ⅰ~Ⅲ期接受NOSES手术的结直肠肿瘤患者数据,对比历史文献数据,认为NOSES手术具有术后恢复更快、术后疼痛更轻、美容效果更好等优势,且术后并发症风险并未升高[5]。蔡建春教授牵头的一项随机对照研究结果显示,NOSES组与传统腹腔镜手术组在3年无病生存期(96.7%和83.3%)和总生存期(100%和90.0%)的差异无统计学意义。但术后疼痛程度减轻、首次排气时间缩短[6]。
机器人手术是腹腔镜手术的手术器械的革新和进步,其是否能够给结直肠癌患者带来了获益值得期待。许剑民教授牵头的一项多中心随机对照研究揭示了机器人和传统腹腔镜手术在中低位直肠癌患者中的短期效果,显示机器人组环周切缘阳性率较低(4.0%:7.2%,P=0.023)、并发症较少(16.2%∶23.1,P=0.003)、住院天数更短[7]。
从上述结果可以看出,微创外科平台设备的进步有效地帮助外科医生实现手术实时可视化,减少了显露盲区和死角及术中手术意外事件的发生,尤其对于传统开放和腹腔镜手术下较为困难的病例如低位直肠癌、“困难骨盆”、肥胖患者等,可提高手术质量、减少手术相关预后不良因素如环周切缘、远切缘阳性等,因而有望改善部分患者的肿瘤学结局。微创手术带来患者的损伤减轻,包括瘢痕小、疼痛轻、恢复快等将改善患者生活质量,增加回归社会及工作的可能。值得注意的是,开放手术仍是目前结直肠外科的基础,微创手术的相关研究需要包括有关患者治疗决策倾向、医学教育以及卫生经济学方面的综合评价。
1.2 手术技术与技巧 伴随着结直肠癌手术方式的不断探索,手术技术与技巧的完善和改进也为减少患者的术后并发症,降低患者复发和转移做出了努力。其中,既包括对现有技术的改进与优化,也有对传统理念的挑战。
肿瘤外科手术的原则之一是无瘤原则,其中“非接触技术”被奉为经典,并推荐先行供血及引流血管结扎后行肿瘤切除。今年《外科学年鉴》发表了一项日本团队的多中心随机临床试验结果[8]。该研究以结直肠癌开放手术为基础,分别以传统开放手术和无接触手术方式进行比较。结果显示两组在3年DFS和术后并发症未见明显差异。不得不讲,该研究结果一定程度上动摇了对传统外科观念的笃信。笔者相信,在腹腔镜结直肠癌手术,如得出同样结论并不令人意外。
腹腔镜手术需要建立气腹,气腹会带来静脉回流、心输出量以及肝肾灌注减少等改变,进而对呼吸功能和肝肾功能产生影响[9-10]。PAROS研究比较了低气腹压(7 mmHg)和标准气腹压(12 mmHg)的术后恢复情况[11]。结果显示在术后并发症无明显差异,但低气腹压组可较为明显地缩短住院时间、减速术后疼痛和镇痛药用量。提示腹腔镜手术中在不影响手术视野的情况下,尽可能的应用低气腹压以减少患者术后并发症的影响。亦有不少学者探讨免气腹的腹腔镜手术。显然,无论是低气腹压还是免气腹,能安全顺利地完成手术应该是前提。
除针对标准结直肠癌根治手术的相关研究之外,发表在《英国外科杂志》的一项临床试验比较了在左半结肠癌伴肠梗阻的患者中应用腔内支架或急诊手术的疗效和安全性[12]。支架置入组中82.4%的患者梗阻得到了缓解,造口率较急诊手术组明显降低(47.5% vs 67.9%,P=0.003)。除此之外,还有诸多手术技术相关的临床研究,如比较机器人右半结肠切除术后体内及体外吻合的研究[13],比较Hughes缝合和传统缝合方式对切口疝的影响的研究[14],均提示在结局相似的前提下外科技术的提高和优化。虽然这些手术技术和技巧的改良和创新对患者的生存预后的改善有限,但不断的积累将显著影响患者的康复和生活质量。
精准手术在肿瘤外科中顾名思义是指针对可切除病灶进行精准地切除,减少不必要的切除或切除范围数量过小。完成精准手术的必要条件是需要精确定位,传统手段包括术前增强CT、MRI和纳米碳示踪等技术。应用吲哚菁绿显影技术指导结直肠癌肝转移的病灶切除,可明显增加发现的肝转移灶数目,降低1年肝内复发率,且不增加术后并发症。该结果发表在Journal of American College of Surgeons上[15]。其结果引起了不小的反响,显示以吲哚菁绿为代表的显影技术,在病灶检出及指导手术切除范围方面可以发挥更加重要的作用。
02、围手术期治疗
围手术期治疗是以术前新辅助治疗和术后辅助治疗分类,包括抗肿瘤治疗及康复治疗。
2.1 术后辅助治疗 结直肠癌术后辅助化疗可以有效地减少复发转移,提高患者远期生存,但如何避免过度治疗是多年来研究的重点。包括日本队列[16]在内的IDEA研究基于不同病期及风险度,提出了辅助化疗的推荐方案。2022年发表在新英格兰医学杂志的研究发现ctDNA可指导辅助化疗的实施,以手术后第4或第7 周的 ctDNA的结果为准,ctDNA阳性结果进行基于奥沙利铂或氟尿嘧啶的辅助化疗,而ctDNA 阴性的患者不接受辅助化疗[17]。该研究有助于化疗人群的筛选,但对持续阳性患者的方案选择尚无结论。笔者牵头的一项以ctDNA检测结合临床分期的多中心随机对照临床试验也在进行中,有助于此问题的回答。
围手术期并发症预防及术后康复训练等方面对患者的术后恢复也是极其重要的。结直肠癌术后血栓相关并发症的预防是关系患者安全的重要因素。今年的英国医学杂志发表的一项关于预防重症患者静脉血栓栓塞的meta分析,通过系统回顾44项随机对照试验、90095名患者资料,显示中等剂量的低分子肝素似乎是预防静脉血栓栓塞一个良好的选择[18]。直肠癌术后前切除综合征是影响患者生活质量的主要原因之一。盆底康复训练 (Pelvic Floor Rehabilitation, PFR) 和患者自我管理均可有助于患者前切除综合征的改善[19]。CALGB/SWOG 80702研究发现对Ⅲ期结肠癌患者而言,参与较大量的体育活动、较长时间的轻度至中等强度有氧体育活动或高强度有氧体育活动可显著提高患者的DFS[20]。国内一项研究评估了自我管理计划对保括约肌手术 (SPS) 后中低位直肠癌患者肠道症状的影响[22]。自我管理计划通过问卷收集了患者肠道症状、生活质量和肠道症状自我管理行为的数据进行实施,可有效地改善患者术后肠道症状及生活质量。因此对结直肠患者而言,影响患者结局的并非仅仅是抗肿瘤治疗,康复治疗应该得到足够重视。
2.2 术前新辅助治疗 近二十年来,术前新辅助治疗在结直肠癌尤其直肠癌领域均为热点。因结肠癌新辅助治疗的大型随机对照研究较少(FOXTROT研究[22]和OPTICAL研究[23]),且多未显示较传统治疗的优势,故本文重点仍集中在直肠癌。直肠癌的新辅助治疗由于免疫治疗的加入,基于错配修复蛋白及微卫星检测结果分为两类成为共识。
dMMR/MSI-H结直肠癌占所有结直肠癌10%~15%,对常规化疗的反应较差[24-25],但对免疫检查点抑制剂有明显应答[26]。2022年最受关注的研究恐怕是来自美国纪念斯隆凯瑟琳癌症中心发表在新英格兰医学杂志的研究。12名dMMR/MSI-H局部进展期直肠癌患者接受6个月的多斯塔利单抗治疗后,12名患者均达到了临床完全缓解(cCR),且没有接受手术,部分患者已经随访2年仍无复发转移,一度成为非手术治愈癌症的典范。这一结论也在国内学者的研究中得以重现,且有更长的随访或病理证实[27]。因此,对非转移性dMMR/MSI-H直肠癌,抗PD-1单药治疗可考虑成为治疗选择。
pMMR/MSS结直肠癌比重高,仍需仰仗放化疗为主的术前治疗模式。2022年,有更多有关直肠癌免除放疗、直肠癌全程新辅助治疗(total neoadjuvant therapy,TNT)模式、器官保留和联合免疫治疗的研究结果报告。
丁克峰教授领衔的PSSR研究纳入通过CRM阴性且肿瘤距肛门6-12cm的局部晚期直肠癌,比较干预组(直接手术,其中CRM阳性加放化疗,阴性CRM根据手术病理分期接受辅助化疗)和对照组(新辅助放化疗后接受手术和辅助化疗)间的3年无病生存率[28]。因中期分析显示两组之间的3年DFS率差异超过5% 而中止试验,最终分析纳入275人。中位随访34.6个月,3年DFS 差异在ITT和PP人群中分别为3.55%和5.44%。研究认为对于MRI环切缘阴性的局部晚期直肠中段癌,初始手术不如常规术前放化疗。恰好2021年ESMO会议上丁培荣教授牵头的CONVERT研究纳入了近乎同样的直肠癌人群,研究发现术前4个周期CapeOx方案化疗较术前常规长程放化疗联合卡培他滨术后pCR和降期率相近,而围手术期远处转移和预防性结肠造口术更少[35]。虽无远期随访结果,似乎可作为一种替代选择。
金晶教授牵头的STELLAR研究是一项前瞻性多中心随机对照研究,对比术前短程放疗后化疗(5Gy×5+4个周期CAPOX,TNT组)与标准长程放化疗方案(2Gy×25 +卡培他滨,CRT组)。主要终点是3年DFS。结果显示两组3年DFS 无显著差别(64.5%和62.3%),TNT组3年总生存期优于CRT组(86.5%和75.1%, P=0.033)[30]。该研究结果也呼应了全程新辅助治疗的优势,包括联合FOLFOXIRI的PRODIGE 23研究[31]和联合伊立替康的CinCLARE研究[32]。
在2022年的ASCO会议中,一项随机对照非劣效性试验(TAUTEM)揭示了局部早期的直肠癌经过术前放化疗+经肛门内窥镜显微手术(CRT-TEM)的治疗后,患者并发症(50.6%和20.7%,P<0.001)和住院率显著减低,明显改善了患者的术后生活质量[33]。该研究提示我们在TNT治疗模式中是否可以放弃TME手术治疗,选择TEM或者非手术等待观察?这一问题也在OPREA研究中得到回答。该研究纳入了324名Ⅱ期或Ⅲ期直肠腺癌患者,分别接受诱导化疗后同步放化疗 (INCT-CRT) 或同步放化疗后巩固化疗 (CRT-CNCT) ,随后根据肿瘤退缩反应分别选择TME或非手术观察等待。该研究以无病生存期 (DFS) 作为两组的主要终点。中位随访时间为3年。两组的3年DFS均为76%, 3年非手术治疗率分别为41%和53%。说明接受TNT治疗的直肠癌患者中约有一半患者进行了保留器官,并且生存没有明显影响,CRT-CNCT的3年非手术治疗率较高。在笔者开展的一项前瞻性Ⅱ期临床试验(PKUCH-R01试验)中,该结论也得到证实,病期较早(T2,T3ab)的患者的3年器官保留率可高达67.2%[34]。这些研究不仅为术前新辅助治疗后进行保留器官治疗或策略提供指导依据,同时也揭示了MRI可以作为进行保留器官治疗或策略的指导手段。
pMMR/MSS结肠癌患者能否在免疫治疗中获益是近两年的热点。NICHE研究在2022年ASCO年会中展示的最终临床分析,显示约有30%的pMMR/MSS结肠癌对新辅助纳武单抗和伊匹单抗有良好的反应[35]。笔者牵头的前瞻性、单中心、Ⅱ期研究(PKUCH 04)展示了pMMR/MSS型高危局部进展期直肠癌在新辅助放化疗联合免疫治疗中的疗效,21例入组患者中各有7名患者(33.3%)达到了pCR、主要病理缓解和部分病理缓解[36]。笔者回顾性分析国内四家中心接受新辅助免疫治疗的94例患者数据,结果显示联合新辅助免疫治疗的 68 例 pMMR 和 MSS 患者 pCR 率为35.3%(24/68),MPR率为58.8%(40/68)[37]。现有诸多联合放疗的前瞻性研究正在进行,如表1所示,或有助于pMMR/MSS直肠癌患者疗效的提高。
表1 正在进行的局部进展期结直肠癌新辅助免疫治疗的相关临床试验

来自2019—2022年中国药物临床试验登记与信息公示平台和美国临床试验注册库的登记
注(表格中缩写):AEs:不良事件;CR:完全缓解;cCR:临床完全缓解;CRT:放化疗;DFS:无病生存期;MPR:主要病理缓解;NAR:新辅助直肠评分;nCRT:新辅助放化疗;ORR:客观缓解率;OS:总生存期;pCR:病理完全缓解;PFS:无进展生存期;TCR:T细胞受体;TRG:肿瘤消退分级。
03、转移性结直肠癌(mCRC)的治疗
转移是结直肠癌相关死亡的主要原因[38],大约22%的结直肠癌患者在初诊时是伴随转移的,最终约70%的结直肠癌患者会发生转移性复发[39]。不可切除的mCRC的主要治疗手段是全身治疗为主,以双药(FOLFOX/FOLFIRI)或三药(FOLFOXIRI)联合VEGF单抗(贝伐珠单抗)或西妥昔单抗作为mCRC患者一线治疗标准。而三药治疗较双药治疗可明显提高mCRC患者的OS、PFS及客观缓解率(ORR),但相关化疗引起的不良事件也较多[40-41],因此这需要在临床中根据病人个体情况来选择治疗策略。
对于非特殊类型的mCRC的治疗中,原发灶为左半结肠且RAS和BRAF野生型mCRC推荐应用化疗联合EGFR单抗[40]。2022年ASCO会议上的PARADIGM床研究(表2)比较了EGFR单抗(帕尼单抗)联合mFOLFOX6与贝伐珠单抗联合mFOLFOX6在RAS 野生型mCRC的疗效[42]。结果显示在整体队列中,联合帕尼单抗组整体优于联合贝伐珠单抗组,OS分别为36.2个月和31.3个月,RR分别为74.9%和67.3%,R0切除率分别16.5%和10.9%。而在原发灶为右半结肠的患者队列中未见明显差异。与此同时DEEPER[43]和IMPROVE[44]两项ASCO会议中的研究(表2)也阐述了说明化疗联合EGFR单抗在原发灶为左半结肠的RAS野生型mCRC治疗中的优势。另外还有一些ASCO报道的临床研究针对RAS野生型或RAS/BRAF双野生型的mCRC比较EGFR单抗和VEGF单抗的优劣(表2)。
表2 2022年转移性结直肠癌相关临床研究
(源于PubMed数据库、ASCO及ESMO会议论文)
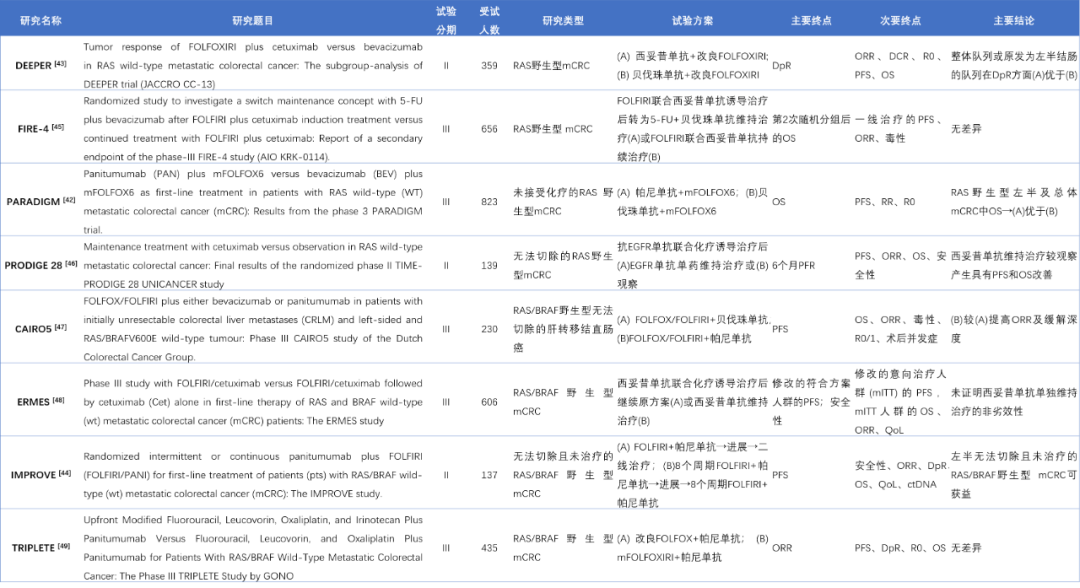
注(表格中缩写):ctDNA:循环肿瘤DNA;DCR:疾病控制率;DFS:无病生存期;DpR:缓解深度;mPFS:中位无进展生存期;QoL:生活质量指数;ORR:客观缓解率;OS:总生存期;PFS:无进展生存期。
值得关注的是,有不少研究关注联合免疫检查点抑制剂以观察整体mCRC中的疗效。如2022年ASCO会议报告的一项临床研究CheckMate 9X8[50],评估纳武单抗联合mFOLFOX6/贝伐珠单抗与mFOLFOX6/贝伐珠单抗两组在mCRC的疗效。主要研究终点是无进展生存期(PFS)。PFS未达到主要研究终点。但是从前期结果看,联合纳武单抗组15个月和18个月的PFS分别为45%和28%,似乎优于未联合纳武单抗组(21.5%和9%),ORR更高(60%和46%)反应持续时间(DOR)也较长(12.9个月和9.3个月)。该研究表明应用免疫检查点抑制剂联合mFOLFOX6/贝伐珠单抗在mCRC的治疗可能在部分MSS型患者有获益可能。
近年来,根据分子和病理特征不同可将mCRC分为不同亚型,其中尤其值得关注的是dMMR/MSI-H结直肠癌和相关基因改变导致的特殊分子类型的转移性结直肠癌,如BRAFV600E突变、KRAS突变、Her2扩增等。
3.1 dMMR/MSI-H转移性结直肠癌 对dMMR/MSI-H结直肠癌而言,多项研究结果提示单纯免疫治疗可获得较好的疾病控制及远期结局[51]。KEYNOTE-177[52]研究了单药帕博利珠单抗在疾病缓解情况和无进展生存期(PFS)要明显优于传统化疗,支持帕博利珠单抗可作为转移性dMMR/MSI-H结直肠癌的一线治疗。其无进展生存期达到16.5个月,明显优于化疗组的8.2个月(P<0 .0002)。今年发表在临床肿瘤学杂志的CHECKMATE 142研究[53] ,患者接受静脉注射纳武单抗 3mg/kg(每3周一次)和低剂量伊匹单抗1mg/kg(每6周一次),ORR达到69%,2年PFS 74%。提示纳武单抗可作为转移性dMMR/MSI-H结直肠癌的一线治疗,联合低剂量伊匹单抗具有良好治疗效果和耐受性。鉴于,目前dMMR/MSI-H结直肠癌免疫检查点抑制剂作为一线治疗,仍有部分患者出现治疗后进展,后续研究终点将探讨免疫治疗后耐药的处理策略及内在机制。
3.2 转移性BRAFV600E突变结直肠癌 BRAF突变型结直肠癌是一种比较特殊的类型,其中以BRAFV600E最常见。基于BEACON临床研究[54]和国内外指南推荐,该类型mCRC的二线或三线治疗推荐BRAF抑制剂+西妥昔单抗±MEK抑制剂,但一线治疗(FOLFOXIRI+贝伐珠单抗或FOLFOX/FOLFIRI+贝伐珠单抗)如何选择仍存在争议。2022年ASCO会议上的一项多机构真实世界数据分析的研究(WJOG13219G)分析比较了治疗BRAFV600E突变的mCRC三联模式(FOLFOXIRI+贝伐珠单抗)和二联模式(FOLFOX/FOLFIRI+贝伐珠单抗)的疗效[55]。三联组较二联组在无进展生存期(9.7个月与7.8个月)和总生存期(中位数为18.7与18.3个月)未显示出较好的生存获益。为探索BRAFV600E型mCRC的有效治疗策略,ANCHOR研究探索了BRAF抑制剂+西妥昔单抗+MEK抑制剂用于BRAFV600E型mCRC的一线治疗,结果显示其主要终点临床客观缓解率(cORR)为48%,中位PFS为4.86个月,中位OS为14.4个月[56]。另一项BREAKWATER研究比较了康奈非尼(BRAF抑制剂)联合西妥昔单抗±mFOLFOX6与 mFOLFOX6/FOLFOXIRI/CAPOX±贝伐珠单抗一线治疗BRAFV600E突变mCRC的疗效与安全性,其安全期导入阶段数据显示康奈非尼联合西妥昔单抗和化疗具有良好的安全性和抗肿瘤疗效[57]。从上述两项研究可以看出,无论是三靶向药物还是双靶向药物联合化疗对BRAFV600E突变mCRC的治疗效果尚没有达到预期效果,仍有待于进一步研究。
ASCO会议上另外一项研究(NIVACOR)观察了RAS/BRAF突变转移性结直肠癌标准治疗联合免疫治疗的疗效。研究应用纳武单抗联合FOLFOXIRI/贝伐珠单抗对转移性RAS/BRAF突变结直肠癌患者的疗效。研究以ORR为主要研究终点,发现纳武单抗联合FOLFOXIRI/贝伐珠单抗的ORR为76.7%,值得注意的是其中MSS亚组ORR达到78.9%[58]。这些结果证实了免疫检查点抑制剂纳武单抗联合FOLFOXIRI/贝伐珠单抗作为转移性RAS/BRAF突变结直肠癌患者一线治疗的初步疗效和安全性。与此同时应用双靶向药物(康奈非尼+西妥昔单抗)联合免疫治疗的研究(SEAMARK[59])正在进行,其结果值得期待。
3.3 KRASG12C突变转移性结直肠癌 在转移性结直肠癌中,KRAS突变是RAS突变类型mCRC最常见的。在KRAS突变位点中G12C在其突变类型中相对较低(约3%),一直以来尚无有效治疗策略和药物[60-61]。2022年两项临床(KRYSTAL-1和CodeBreaK100)研究揭示了两种KRASG12C抑制剂Adagrasib和Sotorasib的疗效。在KRYSTAL-1的I/Ib期临床研究中,25名KRASG12C突变晚期实体瘤的患者单独接受Adagrasib治疗。除了KRASG12C突变非小细胞肺癌患者表现出部分反应外,另外2名KRASG12C突变的晚期结直肠癌患者的1名患者也表现出良好抗肿瘤反应,其反应持续时间达4.2个月[62]。该研究受试者人数较少,尚无法得到有效数据。而另一项研究(CodeBreaK100)揭示采用另一种KRASG12C抑制剂Sotorasib治疗伴有KRASG12C突变的实体瘤。结肠癌亚组中,患者除接受Sotorasib治疗外,还同时接受伊立替康、奥沙利铂和氟尿嘧啶化疗。62名KRASG12C突变结直肠癌患者中,6名患者存在客观缓解,ORR达到9.7%。另外2名患者出现腹泻,1名患者出现4级不良事件[63]。
基于上述研究,显示KRASG12C抑制剂在KRASG12C突变结直肠癌具有一定疗效,但是比较有限,其主要考虑是由于EGFR的激活引起MAPK信号传导增加导致的。因此KRYSTAL-1和CodeBreaK100这两项后续的研究观察了联合EGFR抑制剂的疗效。2022年ESMO报道了这两项研究后续扩展试验的初步结果。在KRYSTAL-1的后续I/II期临床研究中,Adagrasib+西妥昔单抗ORR为46%,疾病控制率(DCR)达100%,中位PFS和OS分别为6.9个月和13.4个月[64]。而CodeBreaK101研究中,Sotorasib+帕尼单抗的ORR达30%,DCR达90%,中位PFS为5.7个月。这两项研究表明了KRASG12C抑制剂联合EGFR抑制剂较单KRASG12C抑制剂的治疗更有前景的疗效和良好的安全性[65]。因此靶向KRASG12C药物的研发和联合其他靶向药物的治疗模式将会是该类型的mCRC研究的一个备受关注的领域。
3.4 HER2扩增型转移性结直肠癌 诸多研究也证实抗HER2治疗在HER2扩增mCRC中也具有一定效果[66-67]。DESTINY CRC01研究发现[68],DS8201使45.3%的HER2过表达转移性结直肠癌达到客观缓解。一项纳入8项单臂临床试验共计258名患者的荟萃分析显示,使用HER2 靶向抑制剂治疗后ORR和DCR可达29%和71%,中位无进展生存期 (mPFS) 和中位总生存期 (mOS) 分别为4.9个月和13.0个月[69]。联合帕妥珠单抗和曲妥珠单抗对HER2扩增型结直肠癌有效,但对HER2/3突变型结直肠癌未显示抗肿瘤效果[70]。
04、展望
2022年我们看到了在手术方式和手术技术技巧不断完善和改进,其总体趋向于在不影响患者预后的情况下,缩小手术范围并减少手术带来的副损伤。直肠癌新辅助治疗模式的改良和完善能够改善患者的预后,为患者提供了保留器官治疗和非手术等待观察等的可能。dMMR/MSI-H局部进展期结直肠癌中免疫治疗可能会作为一种标准模式。基于诸多研究的结果,相信在不久的未来局部进展期直肠癌的围手术期治疗将迎来一个里程碑的变革。转移性结直肠癌的治疗中,以分子靶向治疗研究及药物的研发逐步深入,期待将来更多令人瞩目的研究结果。即将过去的2022年可谓硕果累累,期待即将来临的2023年结直肠癌领域取得更大突破。
参考文献
[1]Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F: Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021, 71:209-249.
[2]Xia C, Dong X, Li H, Cao M, Sun D, He S, Yang F, Yan X, Zhang S, Li N, Chen W: Cancer statistics in China and United States, 2022: profiles, trends, and determinants. Chin Med J (Engl) 2022, 135:584-590.
[3]Jiang WZ, Xu JM, Xing JD, Qiu HZ, Wang ZQ, Kang L, Deng HJ, Chen WP, Zhang QT, Du XH, et al: Short-term Outcomes of Laparoscopy-Assisted vs Open Surgery for Patients With Low Rectal Cancer: The LASRE Randomized Clinical Trial. JAMA Oncol 2022, 8:1607-1615.
[4]Liu H, Zeng Z, Zhang H, Wu M, Ma D, Wang Q, Xie M, Xu Q, Ouyang J, Xiao Y, et al: Morbidity, Mortality, and Pathologic Outcomes of Transanal Versus Laparoscopic Total Mesorectal Excision for Rectal Cancer Short-term Outcomes From a Multicenter Randomized Controlled Trial. Ann Surg 2022.
[5]Guan X, Hu X, Jiang Z, Wei Y, Sun D, Wu M, Zhou H, Yao H, Song J, Wang G, et al: Short-term and oncological outcomes of natural orifice specimen extraction surgery (NOSES) for colorectal cancer in China: a national database study of 5055 patients. Science Bulletin 2022, 67:1331-1334.
[6]Chen ZZ, Xu SZ, Ding ZJ, Zhang SF, Yuan SS, Yan F, Wang ZF, Liu GY, Qiu XF, Cai JC: [Comparison between laparoscopic-assisted natural orifice specimen extraction surgery and conventional laparoscopic surgery for left colorectal cancer: a randomized controlled study with 3-year follow-up results]. Zhonghua Wei Chang Wai Ke Za Zhi 2022, 25:604-611.
[7]Feng Q, Yuan W, Li T, Tang B, Jia B, Zhou Y, Zhang W, Zhao R, Zhang C, Cheng L, et al: Robotic versus laparoscopic surgery for middle and low rectal cancer (REAL): short-term outcomes of a multicentre randomised controlled trial. Lancet Gastroenterol Hepatol 2022, 7:991-1004.
[8]Takii Y, Mizusawa J, Kanemitsu Y, Komori K, Shiozawa M, Ohue M, Ikeda S, Takiguchi N, Kobatake T, Ike H, et al: The Conventional Technique Versus the No-touch Isolation Technique for Primary Tumor Rep in Patients With Colon Cancer (JCOG1006): A Multicenter, Open-label, Randomized, Phase III Trial. Ann Surg 2022, 275:849-855.
[9]Karagulle E, Turk E, Dogan R, Ekici Z, Dogan R, Moray G: The effects of different abdominal pressures on pulmonary function test results in laparoscopic cholecystectomy. Surg Laparosc Endosc Percutan Tech 2008, 18:329-333.
[10]Akkurt G, Birben B, Akcay FK, Altay CM, Baskan S, Yildiz BD: Effects of different intraabdominal pressures on internal jugular vein, liver and kidney functions in obese patients undergoing laparoscopic sleeve gastrectomy. Acta Chir Belg 2021:1-7.
[11]Celarier S, Monziols S, Celerier B, Assenat V, Carles P, Napolitano G, Laclau-Lacrouts M, Rullier E, Ouattara A, Denost Q: Low-pressure versus standard pressure laparoscopic colorectal surgery (PAROS trial): a phase III randomized controlled trial. Br J Surg 2021, 108:998-1005.
[12]Group CRC: Colorectal Endoscopic Stenting Trial (CReST) for obstructing left-sided colorectal cancer: randomized clinical trial. Br J Surg 2022, 109:1073-1080.
[13]Dohrn N, Yikilmaz H, Laursen M, Khesrawi F, Clausen FB, Sorensen F, Jakobsen HL, Brisling S, Lykke J, Eriksen JR, et al: Intracorporeal Versus Extracorporeal Anastomosis in Robotic Right Colectomy: A Multicenter, Triple-blind, Randomized Clinical Trial. Ann Surg 2022, 276:e294-e301.
[14]Collaborative H: Incisional hernia following colorectal cancer surgery according to suture technique: Hughes Abdominal Repair Randomized Trial (HART). Br J Surg 2022, 109:943-950.
[15]He K, Hong X, Chi C, Cai C, An Y, Li P, Liu X, Shan H, Tian J, Li J: Efficacy of Near-Infrared Fluorescence-Guided Hepatectomy for the Detection of Colorectal Liver Metastases: A Randomized Controlled Trial. J Am Coll Surg 2022, 234:130-137.
[16]Yamazaki K, Yamanaka T, Shiozawa M, Manaka D, Kotaka M, Gamoh M, Shiomi A, Makiyama A, Munemoto Y, Rikiyama T, et al: Oxaliplatin-based adjuvant chemotherapy duration (3 versus 6 months) for high-risk stage II colon cancer: the randomized phase III ACHIEVE-2 trial. Ann Oncol 2021, 32:77-84.
[17]Tie J, Cohen JD, Lahouel K, Lo SN, Wang Y, Kosmider S, Wong R, Shapiro J, Lee M, Harris S, et al: Circulating Tumor DNA Analysis Guiding Adjuvant Therapy in Stage II Colon Cancer. N Engl J Med 2022, 386:2261-2272.
[18]Eck RJ, Elling T, Sutton AJ, Wetterslev J, Gluud C, van der Horst ICC, Gans ROB, Meijer K, Keus F: Anticoagulants for thrombosis prophylaxis in acutely ill patients admitted to hospital: systematic review and network meta-analysis. BMJ 2022, 378:e070022.
[19]van der Heijden JAG, Kalkdijk-Dijkstra AJ, Pierie J, van Westreenen HL, Broens PMA, Klarenbeek BR, group Ft: Pelvic Floor Rehabilitation After Rectal Cancer Surgery: A Multicenter Randomized Clinical Trial (FORCE Trial). Ann Surg 2022, 276:38-45.
[20]Brown JC, Ma C, Shi Q, Fuchs CS, Meyer J, Niedzwiecki D, Zemla T, Couture F, Kuebler P, Kumar P, et al: Physical Activity in Stage III Colon Cancer: CALGB/SWOG 80702 (Alliance). J Clin Oncol 2022:JCO2200171.
[21]Li C, Li ZY, Lu Q, Zhou YJ, Qin XY, Wu AW, Pang D: The Effectiveness of a Self-management Program of Bowel Dysfunction in Patients With Mid and Low Rectal Cancer After Sphincter-Preserving Surgery: A Pilot Randomized Controlled Trial. Cancer Nurs 2023, 46:67-76.
[22]Morton D: FOxTROT: An international randomised controlled trial in 1053 patients evaluating neoadjuvant chemotherapy (NAC) for colon cancer. On behalf of the FOxTROT Collaborative Group. Annals of Oncology 2019, 30:v198.
[23]Hu H, Huang M, Li Y, Wang Z, Wang X, Liu P, Zhang R, Zhang H, Huang Z, Pei H, et al: Perioperative chemotherapy with mFOLFOX6 or CAPOX for patients with locally advanced colon cancer (OPTICAL): A multicenter, randomized, phase 3 trial. Journal of Clinical Oncology 2022, 40:3500-3500.
[24]Innocenti F, Ou FS, Qu X, Zemla TJ, Niedzwiecki D, Tam R, Mahajan S, Goldberg RM, Bertagnolli MM, Blanke CD, et al: Mutational Analysis of Patients With Colorectal Cancer in CALGB/SWOG 80405 Identifies New Roles of Microsatellite Instability and Tumor Mutational Burden for Patient Outcome. J Clin Oncol 2019, 37:1217-1227.
[25]Tougeron D, Sueur B, Zaanan A, de la Fouchardiere C, Sefrioui D, Lecomte T, Aparicio T, Des Guetz G, Artru P, Hautefeuille V, et al: Prognosis and chemosensitivity of deficient MMR phenotype in patients with metastatic colorectal cancer: An AGEO retrospective multicenter study. Int J Cancer 2020, 147:285-296.
[26]Chalabi M, Fanchi LF, Dijkstra KK, Van den Berg JG, Aalbers AG, Sikorska K, Lopez-Yurda M, Grootscholten C, Beets GL, Snaebjornsson P, et al: Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med 2020, 26:566-576.
[27]Wang QX, Xiao BY, Cheng Y, Wu AW, Zhang T, Wang H, Zhang X, Huang WX, Tang JH, Jiang W, et al: Anti-PD-1-based immunotherapy as curative-intent treatment in dMMR/MSI-H rectal cancer: A multicentre cohort study. Eur J Cancer 2022, 174:176-184.
[28]Ding K-F, Li J, Hu Y, Liu C, Wang Z, Wang L-H, Ju H, Huang X, Chi P, Du J, et al: Primary surgery followed by selective radiochemotherapy versus conventional preoperative radiochemotherapy for patients with locally advanced rectal cancer with MRI-negative circumferential margin (PSSR): A multicenter, randomized, open-label, noninferiority, phase 3 trial. Journal of Clinical Oncology 2022, 40:3515-3515.
[29]Ding PR, Wang XZ, Li YF, Sun YM, Yang CK, Wu ZG, Zhang R, Wang W, Li Y, Zhuang YZ, et al: LBA22 Neoadjuvant chemotherapy with oxaliplatin and capecitabine versus chemoradiation with capecitabine for locally advanced rectal cancer with uninvolved mesorectal fascia (CONVERT): Initial results of a multicenter randomised, open-label, phase III trial. Annals of Oncology 2021, 32:S1296.
[30]Jin J, Tang Y, Hu C, Jiang LM, Jiang J, Li N, Liu WY, Chen SL, Li S, Lu NN, et al: Multicenter, Randomized, Phase III Trial of Short-Term Radiotherapy Plus Chemotherapy Versus Long-Term Chemoradiotherapy in Locally Advanced Rectal Cancer (STELLAR). J Clin Oncol 2022, 40:1681-1692.
[31]Conroy T, Bosset JF, Etienne PL, Rio E, Francois E, Mesgouez-Nebout N, Vendrely V, Artignan X, Bouche O, Gargot D, et al: Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021, 22:702-715.
[32]Zhu J, Sun X, Liu A, Zhu Y, Zhang T, Liu L, Jia J, Tan S, Wu J, Wang X, et al: Long-term outcome of a phase III trial on neoadjuvant chemoradiation with capecitabine and irinotecan in patients with locally advanced rectal cancer: Updated results of the CinClare trial. Journal of Clinical Oncology 2021, 39:3603-3603.
[33]Serra-Aracil X, Pericay C, Badia-Closa J, Golda T, Biondo S, Hernández P, Tarragona E, Borda-Arrizabalaga N, Reina Á, Delgado S, et al: Noninferiority multicenter prospective randomized controlled study of rectal cancer T2–T3s (superficial) N0, M0 (T2T3sN0M0) undergoing neoadjuvant treatment and local excision (TEM) versus total mesorectal excision (TME): Preoperative, surgical, and pathological outcomes—The TAUTEM-study. Journal of Clinical Oncology 2022, 40:3501-3501.
[34]Wang L, Zhang XY, Zhao YM, Li SJ, Li ZW, Sun YS, Wang WH, Wu AW, Rectal Cancer Cooperative Group of Peking University Cancer H: Intentional Watch & Wait or Organ Preservation Surgery Following Neoadjuvant Chemoradiotherapy Plus Consolidation CAPEOX for MRI-defined Low-risk Rectal Cancer: Findings from a Prospective Phase 2 Trial (PKUCH-R01 Trial, NCT02860234). Ann Surg 2022.
[35]Verschoor YL, van den Berg J, Beets G, Sikorska K, Aalbers A, van Lent A, Grootscholten C, Huibregtse I, Marsman H, Oosterling S, et al: Neoadjuvant nivolumab, ipilimumab, and celecoxib in MMR-proficient and MMR-deficient colon cancers: Final clinical analysis of the NICHE study. Journal of Clinical Oncology 2022, 40:3511-3511.
[36]Wu A, Li Y, Ji D, Zhang L, Zhang X, Cai Y, Zhang Y, Yao Y, Wang L, Leng J, et al: PKUCH 04 trial: Total neoadjuvant chemoradiation combined with neoadjuvant PD-1 blockade for pMMR/MSS locally advanced middle to low rectal cancer. Journal of Clinical Oncology 2022, 40:3609-3609.
[37]Wu AW, Li YJ: [Current status, controversy and challenge in the neoadjuvant immunotherapy of colorectal cancer]. Zhonghua Wei Chang Wai Ke Za Zhi 2022, 25:185-192.
[38]Siegel RL, Miller KD, Jemal A: Cancer statistics, 2019. CA Cancer J Clin 2019, 69:7-34.
[39]Wang J, Li S, Liu Y, Zhang C, Li H, Lai B: Metastatic patterns and survival outcomes in patients with stage IV colon cancer: A population-based analysis. Cancer Med 2020, 9:361-373.
[40]Morris VK, Kennedy EB, Baxter NN, Benson AB, 3rd, Cercek A, Cho M, Ciombor KK, Cremolini C, Davis A, Deming DA, et al: Treatment of Metastatic Colorectal Cancer: ASCO Guideline. J Clin Oncol 2022:JCO2201690.
[41]Biller LH, Schrag D: Diagnosis and Treatment of Metastatic Colorectal Cancer: A Review. JAMA 2021, 325:669-685.
[42]Yoshino T, Watanabe J, Shitara K, Yasui H, Ohori H, Shiozawa M, Yamazaki K, Oki E, Sato T, Naitoh T, et al: Panitumumab (PAN) plus mFOLFOX6 versus bevacizumab (BEV) plus mFOLFOX6 as first-line treatment in patients with RAS wild-type (WT) metastatic colorectal cancer (mCRC): Results from the phase 3 PARADIGM trial. Journal of Clinical Oncology 2022, 40:LBA1-LBA1.
[43]Satake H, Tsuji A, Tanaka C, Takahashi T, Wakamura K, Yoshida T, Murata K, Shindo Y, Ishikawa Y, Konishi K, et al: Tumor response of FOLFOXIRI plus cetuximab versus bevacizumab in RAS wild-type metastatic colorectal cancer: The subgroup-analysis of DEEPER trial (JACCRO CC-13). Journal of Clinical Oncology 2022, 40:109-109.
[44]Avallone A, Giuliani F, Nasti G, Montesarchio V, Santabarbara G, Leo S, De Stefano A, Rosati G, Lolli I, Tamburini E, et al: Randomized intermittent or continuous panitumumab plus FOLFIRI (FOLFIRI/PANI) for first-line treatment of patients (pts) with RAS/BRAF wild-type (wt) metastatic colorectal cancer (mCRC): The IMPROVE study. Journal of Clinical Oncology 2022, 40:3503-3503.
[45]Stintzing S, von Weikersthal L, Fuchs M, Kaiser F, Heinrich K, Modest DP, Hofheinz R, Decker T, Gerger A, Angermeier S, et al: Randomized study to investigate a switch maintenance concept with 5-FU plus bevacizumab after FOLFIRI plus cetuximab induction treatment versus continued treatment with FOLFIRI plus cetuximab: Report of a secondary endpoint of the phase-III FIRE-4 study (AIO KRK-0114). Journal of Clinical Oncology 2022, 40:3519-3519.
[46]Boige V, Francois E, Ben Abdelghani M, Phelip JM, Le Brun-Ly V, Mineur L, Galais MP, Villing A-L, Hautefeuille V, Miglianico L, et al: Maintenance treatment with cetuximab versus observation in RAS wild-type metastatic colorectal cancer: Results of the randomized phase II PRODIGE 28-time UNICANCER study. Journal of Clinical Oncology 2021, 39:15-15.
[47]Bond MJG, Bolhuis K, Loosveld OJL, Droogendijk HJ, de Groot JWB, Hendriks MP, De Valk B, Liem MSL, Rijken AM, Verhoef K, et al: LBA21 FOLFOX/FOLFIRI plus either bevacizumab or panitumumab in patients with initially unresectable colorectal liver metastases (CRLM) and left-sided and RAS/BRAFV600E wild-type tumour: Phase III CAIRO5 study of the Dutch Colorectal Cancer Group. Annals of Oncology 2022, 33:S1389.
[48]Pinto C, Orlandi A, Normanno N, Maiello E, Calegari MA, Antonuzzo L, Bordonaro R, Zampino MG, Pini S, Bergamo F, et al: LBA22 Phase III study with FOLFIRI/cetuximab versus FOLFIRI/cetuximab followed by cetuximab (Cet) alone in first-line therapy of RAS and BRAF wild-type (wt) metastatic colorectal cancer (mCRC) patients: The ERMES study. Annals of Oncology 2022, 33:S1390.
[49]Rossini D, Antoniotti C, Lonardi S, Pietrantonio F, Moretto R, Antonuzzo L, Boccaccino A, Morano F, Brugia M, Pozzo C, et al: Upfront Modified Fluorouracil, Leucovorin, Oxaliplatin, and Irinotecan Plus Panitumumab Versus Fluorouracil, Leucovorin, and Oxaliplatin Plus Panitumumab for Patients With RAS/BRAF Wild-Type Metastatic Colorectal Cancer: The Phase III TRIPLETE Study by GONO. Journal of Clinical Oncology 2022, 40:2878-2888.
[50]Lenz H-J, Parikh AR, Spigel DR, Cohn AL, Yoshino T, Kochenderfer MD, Elez E, Shao SH, Deming DA, Holdridge RC, et al: Nivolumab (NIVO) + 5-fluorouracil/leucovorin/oxaliplatin (mFOLFOX6)/bevacizumab (BEV) versus mFOLFOX6/BEV for first-line (1L) treatment of metastatic colorectal cancer (mCRC): Phase 2 results from CheckMate 9X8. Journal of Clinical Oncology 2022, 40:8-8.
[51]Oliveira AF, Bretes L, Furtado I: Review of PD-1/PD-L1 Inhibitors in Metastatic dMMR/MSI-H Colorectal Cancer. Front Oncol 2019, 9:396.
[52]Andre T, Amonkar M, Norquist JM, Shiu KK, Kim TW, Jensen BV, Jensen LH, Punt CJA, Smith D, Garcia-Carbonero R, et al: Health-related quality of life in patients with microsatellite instability-high or mismatch repair deficient metastatic colorectal cancer treated with first-line pembrolizumab versus chemotherapy (KEYNOTE-177): an open-label, randomised, phase 3 trial. Lancet Oncol 2021, 22:665-677.
[53]Lenz HJ, Van Cutsem E, Luisa Limon M, Wong KYM, Hendlisz A, Aglietta M, Garcia-Alfonso P, Neyns B, Luppi G, Cardin DB, et al: First-Line Nivolumab Plus Low-Dose Ipilimumab for Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: The Phase II CheckMate 142 Study. J Clin Oncol 2022, 40:161-170.
[54]Tabernero J, Grothey A, Van Cutsem E, Yaeger R, Wasan H, Yoshino T, Desai J, Ciardiello F, Loupakis F, Hong YS, et al: Encorafenib Plus Cetuximab as a New Standard of Care for Previously Treated BRAF V600E-Mutant Metastatic Colorectal Cancer: Updated Survival Results and Subgroup Analyses from the BEACON Study. J Clin Oncol 2021, 39:273-284.
[55]Shimozaki K, Hirata K, Sato T, Nakamura M, Kato K, Hirano H, Kumekawa Y, Hino K, Kawakami K, Kito Y, et al: WJOG13219G: Triplet versus doublet in patients with previously untreated BRAFV600E-mutant metastatic colorectal cancer: A multi-institutional real-world data analysis (BRACELET study). Journal of Clinical Oncology 2022, 40:37-37.
[56]Van Cutsem E, Taieb J, Yaeger R, Yoshino T, Maiello E, Elez E, Dekervel J, Ross P, Ruiz Casado A, Graham J, et al: O-10 ANCHOR CRC: Results from a single-arm, phase 2 study of encorafenib, binimetinib plus cetuximab in previously untreated BRAF V600E–mutant metastatic colorectal cancer. Annals of Oncology 2021, 32:S222.
[57]Kopetz S, Grothey A, Yaeger R, Ciardiello F, Desai J, Kim TW, Maughan T, Van Cutsem E, Wasan HS, Yoshino T, et al: BREAKWATER: Randomized phase 3 study of encorafenib (enco) + cetuximab (cetux) ± chemotherapy for first-line (1L) treatment (tx) of BRAF V600E-mutant (BRAFV600E) metastatic colorectal cancer (mCRC). Journal of Clinical Oncology 2021, 39:TPS3619-TPS3619.
[58]Damato A, Bergamo F, Antonuzzo L, Nasti G, Pietrantonio F, Tonini G, Maiello E, Bordonaro R, Rosati G, Romagnani A, et al: Phase II study of nivolumab in combination with FOLFOXIRI/bevacizumab as first-line treatment in patients with advanced colorectal cancer RAS/BRAF mutated (mut): NIVACOR trial (GOIRC-03-2018). Journal of Clinical Oncology 2022, 40:3509-3509.
[59]Kopetz S, Bekaii-Saab TS, Yoshino T, Chung C-H, Zhang X, Tabernero J: SEAMARK: Randomized phase 2 study of pembrolizumab + encorafenib + cetuximab versus pembrolizumab alone for first-line treatment of BRAF V600E-mutant and microsatellite instability-high (MSI-H)/mismatch repair deficient (dMMR) metastatic colorectal cancer (CRC). Journal of Clinical Oncology 2022, 40:TPS3634-TPS3634.
[60]Parsons BL, Myers MB: Personalized cancer treatment and the myth of KRAS wild-type colon tumors. Discov Med 2013, 15:259-267.
[61]Liu J, Kang R, Tang D: The KRAS-G12C inhibitor: activity and resistance. Cancer Gene Ther 2022, 29:875-878.
[62]Ou SI, Janne PA, Leal TA, Rybkin, II, Sabari JK, Barve MA, Bazhenova L, Johnson ML, Velastegui KL, Cilliers C, et al: First-in-Human Phase I/IB Dose-Finding Study of Adagrasib (MRTX849) in Patients With Advanced KRAS(G12C) Solid Tumors (KRYSTAL-1). J Clin Oncol 2022, 40:2530-2538.
[63]Fakih MG, Kopetz S, Kuboki Y, Kim TW, Munster PN, Krauss JC, Falchook GS, Han SW, Heinemann V, Muro K, et al: Sotorasib for previously treated colorectal cancers with KRAS(G12C) mutation (CodeBreaK100): a prespecified analysis of a single-arm, phase 2 trial. Lancet Oncol 2022, 23:115-124.
[64]Klempner SJ, Weiss J, Pelster M, Spira A, Barve M, Ou SHI, Leal TA, Bekaii-Saab T, Christensen JG, Kheoh T, et al: LBA24 KRYSTAL-1: Updated efficacy and safety of adagrasib (MRTX849) with or without cetuximab in patients with advanced colorectal cancer (CRC) harboring a KRASG12C mutation. Annals of Oncology 2022, 33:S1391.
[65]Kuboki Y, Yaeger R, Fakih M, Strickler JH, Masuishi T, Kim EJH, Bestvina CM, Langer CJ, Krauss JC, Puri S, et al: 45MO Sotorasib in combination with panitumumab in refractory KRAS G12C-mutated colorectal cancer: Safety and efficacy for phase Ib full expansion cohort. Annals of Oncology 2022, 33:S1445-S1446.
[66]Tosi F, Sartore-Bianchi A, Lonardi S, Amatu A, Leone F, Ghezzi S, Martino C, Bencardino K, Bonazzina E, Bergamo F, et al: Long-term Clinical Outcome of Trastuzumab and Lapatinib for HER2-positive Metastatic Colorectal Cancer. Clin Colorectal Cancer 2020, 19:256-262 e252.
[67]Sartore-Bianchi A, Trusolino L, Martino C, Bencardino K, Lonardi S, Bergamo F, Zagonel V, Leone F, Depetris I, Martinelli E, et al: Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016, 17:738-746.
[68]Siena S, Di Bartolomeo M, Raghav K, Masuishi T, Loupakis F, Kawakami H, Yamaguchi K, Nishina T, Fakih M, Elez E, et al: Trastuzumab deruxtecan (DS-8201) in patients with HER2-expressing metastatic colorectal cancer (DESTINY-CRC01): a multicentre, open-label, phase 2 trial. Lancet Oncol 2021, 22:779-789.
[69]Gao M, Jiang T, Li P, Zhang J, Xu K, Ren T: Efficacy and safety of HER2-targeted inhibitors for metastatic colorectal cancer with HER2-amplified: A meta-analysis. Pharmacol Res 2022, 182:106330.
[70]Gupta R, Meric-Bernstam F, Rothe M, Garrett-Mayer E, Mangat PK, D'Andre S, Ahn ER, O'Lone R, Halabi S, Grantham GN, Schilsky RL: Pertuzumab Plus Trastuzumab in Patients With Colorectal Cancer With <i>ERBB2</i> Amplification or <i>ERBB2/3</i> Mutations: Results From the TAPUR Study. JCO Precis Oncol 2022, 6:e2200306.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言