【协和医学杂志】白细胞介素-6靶向治疗前时代的中国Castleman病诊疗现状
2023-10-20 协和医学杂志 协和医学杂志 发表于上海
对罕见病患者群体的关注程度,与社会的文明进步程度密切相关。
1 Castleman病介绍
Castleman病(CD)是一种具有特征性病理改变和高度临床异质性的血液系统罕见疾病,该病于1956年由美国病理学家Castleman首次报道并因此得名[1]。2018年5月,CD被纳入我国《第一批罕见病目录》。
淋巴结病理诊断是CD诊断的“金标准”。根据组织病理学特征,其可分为透明血管型CD (HV-CD)、浆细胞型CD (PC-CD)及混合型CD[2-5]。此病具有显著的临床异质性,即使同种病理分型的患者,临床表现也存在显著差异。因此,目前国内外指南、共识更加强调CD的临床分型[3-5]。
根据临床表现,此病可分为单中心型CD(UCD)和多中心型CD(MCD)。前者仅累及单个淋巴结区域,大多可通过手术治愈,预后较好;后者累及多个淋巴结区域,往往伴有全身炎症症状,病情相对较重。而在MCD中,对于存在人类疱疹病毒(HHV) -8感染的病例,根据国际Castleman病协作网(CDCN)2017年发布的诊断标准[4]以及中国Castleman病协作组(CCDN)2021年发布的专家共识[5],被归为“HHV-8阳性MCD”,此类患者常合并人类免疫缺陷病毒感染,治疗方案可考虑基于利妥昔单抗的治疗。
对于HHV-8阴性MCD患者,如存在临床症状、高炎症状态和/或脏器损伤,且符合CCDN诊断标准,则被归为特发性多中心型CD(iMCD)。该亚型病情重,预后差,患者5年生存率仅为51%~77%[5],且是中国MCD中最常见的类型[2],应引起国内临床医师关注。
值得注意的是,虽然临床分型与病理分型存在一定的相关性,如UCD的病理类型以HV-CD多见,MCD的病理类型以PC-CD及混合型CD多见。但亦存在相当比例的UCD患者(10%~30%)病理类型为PC-CD或混合型CD。同样,也有不少MCD患者(约20%)的病理类型为HV-CD。
因此,不能简单地通过患者的病理分型推测其临床分型。由于其他疾病(如病毒感染、结缔组织病、淋巴瘤、POEMS综合征等)可伴发淋巴结“Castleman样”改变[4-5],因此诊断CD时,需首先除外此类潜在相关疾病。
2018年,CCDN提出了国际上首个基于循证医学证据的iMCD诊治指南,建议白细胞介素(IL)-6靶向治疗(如司妥昔单抗)作为iMCD的一线治疗选择[3]。2022年,司妥昔单抗在中国上市,标志着国内IL-6靶向治疗时代的开启。值此特殊时间节点,CCDN开展了基于国内40家医疗中心的大型回顾性研究,以描述CD的临床特征、治疗模式和预后特点[2]。
2 IL-6靶向治疗前时代的中国CD研究现状
作为罕见病,关于CD的大规模回顾性研究匮乏。此外,2017年iMCD的诊断标准(CDCN诊断标准)才在国际上获得共识[4],既往CD研究入组的患者诊断标准也不尽相同。如多项大规模回顾性研究均将淋巴结具有“Castleman样”改变的POEMS综合征患者纳入,而此类患者在疾病本质上与iMCD患者存在较大差异,纳入后在一定程度上将影响研究结论。
CCDN研究人员意识到上述问题,在开展研究的过程中,参考《中国Castleman病诊断与治疗专家共识(2021年版)》[5]进行患者筛选和分类,该共识中iMCD的诊断标准与CDCN发表于2017年的标准保持一致[4]。
CCDN成立于2021年1月,隶属于中国抗癌协会血液肿瘤专业委员会,由来自国内40余家医疗机构、在CD领域具有较丰富诊疗经验的医师组成,旨在提升CD的诊治和研究水平,改善国内CD患者的生存状况,推动CD领域快速进展。
2021年7月,CCDN在《中华血液学杂志》发表了《中国Castleman病诊断与治疗专家共识(2021年版)》[5]。2023年3月,CCDN在Lancet Reg Health West Pac发表了过去21年中国CD的回顾性研究[2]。
该研究数据来源于CCDN登记网络,共纳入了中国40家医疗中心过去21年(2000—2021年)诊断的1634例CD患者,初步描述了我国CD在IL-6靶向治疗前时代的疾病分布特点、治疗选择情况和患者预后特点。
根据《中国Castleman病诊断与治疗专家共识(2021年版)》分类标准,在1634例患者中,903例为UCD患者,731例为MCD患者(图1)。
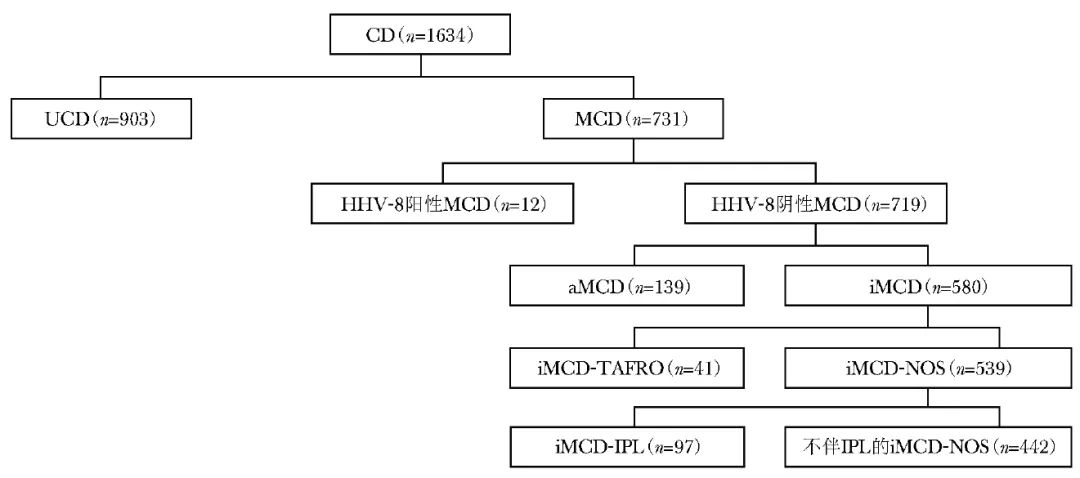
图1 依托中国Castleman病协作组的国内多中心回顾性研究纳入的CD患者临床分型
CD:Castleman病;UCD:单中心型Castleman病;MCD:多中心型Castleman病;HHV-8:人类疱疹病毒-8;aMCD:无症状性MCD;iMCD:特发性多中心型Castleman病;iMCD-TAFRD:iMCD-TAFRD综合征;iMCD-NOS:iMCD-非特指型;IPL:特发性浆细胞性淋巴结病
而在903例UCD患者中,最常见的受累淋巴结区域为腹腔内/腹膜后(35.7%),其次为颈部(25.7%)、纵隔/肺门(23.1%)。在UCD患者中,5.9%合并副肿瘤天疱疮,3.9%合并闭塞性细支气管炎,而后者是影响UCD患者预后的重要因素。
此外,根据国内研究者2021年提出的“伴类似于iMCD样高炎症状态的UCD(UCD-MIS)”概念[6],该研究发现17.9%的患者符合UCD-MIS标准。在731例MCD患者中,12例患者被归类为HHV-8阳性MCD,719例被归类为HHV-8阴性MCD。
在此719例患者中,580例符合CDCN和CCDN的iMCD诊断标准[4-5];其余139例无全身症状,亦无高炎症表现和脏器损伤,根据CCDN的诊断标准,被归为“无症状性MCD(aMCD)”[5]。
在580例iMCD患者中,7.1%的患者符合iMCD-TAFRO诊断标准,在不符合iMCD-TAFRO诊断标准的539例患者中,97例存在血小板增多、IgG水平升高、病理为浆细胞型或混合型特点,被定义为iMCD-特发性浆细胞性淋巴结病(iMCD-IPL)亚型。
而在具有一线治疗选择信息的iMCD患者中,该研究发现此病的治疗模式近年来存在较大改变:2010年之前,脉冲式强化疗(如CHOP或CHOP样方案)是我国iMCD患者的主流治疗方案;2020年之后,相对缓和的持续治疗策略(如以沙利度胺为基础的方案)已成为我国iMCD患者治疗最常用的方案。
这种治疗策略的演变,符合即将到来的IL-6靶向治疗时代的治疗理念:以司妥昔单抗治疗iMCD为例,即是采用缓和且持续的治疗策略。通过生存分析发现,CDCN定义的“重型”iMCD确实是重要的不良预后因素(HR=3.747,95% CI:2.112~6.649,P<0.001)。
该研究是目前世界范围内最大规模、采用最新CDCN标准定义iMCD的多中心、回顾性研究,也是IL-6靶向治疗时代来临前,国内最大规模的CD现状研究。该研究不仅充分展现了这一罕见病的流行病学特征、疾病分布情况(根据CCDN标准)、治疗选择和预后特点,且首次对一些特殊且暂未被CDCN分类标准[4]纳入的CD亚型(如UCD-MIS、iMCD-IPL、aMCD)进行了初步描述,为后续针对此类特殊亚型开展更细致的临床研究提供了方向,也为CD诊断和分类共识的更新提供了重要参考。
3 中国学者在CD领域的研究成果
近年来,中国学者在CD领域紧跟国际前沿,取得了多项引人瞩目的成果。2018年,北京大学第一医院董玉君教授团队在Ann Hematol 发表了利妥昔单抗治疗iMCD的回顾性研究成果[7]。
2019年,北京协和医院李剑教授团队在Blood 发表了全口服TCP方案(沙利度胺-环磷酰胺-泼尼松)治疗iMCD的前瞻性研究成果[8]。
2019年,郑州大学第一附属医院张明智教授团队在Leukemia 报道了部分UCD患者存在PDGFRB基因突变[9]。
2020年,南昌大学第二附属医院余莉教授团队在Oncologist 发表了适合iMCD危险分层的“国际预后指数”模型(iMCD-IPI)[10]。
2023年,北京协和医院李剑教授和张伟宏教授团队在CHEST 发表了描绘iMCD-非特指型(iMCD- NOS患者肺部受累表现和演变规律[11]。
2023年,北京协和医院李剑教授团队在Blood 发表了BCD方案(硼替佐米-环磷酰胺-地塞米松)治疗iMCD的前瞻性研究成果[12]。
上述研究成果体现了中国学者在CD领域的关注和持续努力,在这一罕见病研究领域作出了重大贡献。此外,随着CCDN的建立及依托于CCDN的研究工作陆续开展,相信中国学者将在已经到来的IL-6靶向治疗时代,继续在CD领域开展更多有价值的临床科研工作。
4 小结与展望
对罕见病患者群体的关注程度,与社会的文明进步程度密切相关。国家“十四五”规划中明确指出,要把保障人民健康放在优先发展的战略位置,为人民提供全方位全生命期的健康服务。作为中国的医务工作者,应努力为包括罕见病群体在内的广大患者服务,积极开展临床科研工作,提升罕见病的诊疗水平。正如Lancet Reg Health West Pac 杂志为我国CD多中心研究刊发的专题述评中写到:“所有针对罕见病的研究和倡议都值得被鼓励”[13]。
参考文献
[1]Castleman B,Iverson L,Menendez VP. Localized mediastinal lymphnode hyperplasia resembling thymoma[J].Cancer, 1956,9:822-830.
[2]Zhang L, Dong YJ, Peng HL, et al. A national, multicenter, retrospective study of Castleman disease in China implementing CDCN criteria[J]. Lancet Reg Health West Pac, 2023, 34:100720.
[3]van Rhee F,Voorhees P,Dispenzieri A,et al.International,evidence-based consensus treatment guidelines for idiopathic multicentric Castleman disease[J].Blood,2018,132:2115-2124.
[4]Fajgenbaum DC,Uldrick TS,Bagg A,et al. International,evidence-based consensus diagnostic criteria for HHV-8-negative/idiopathic multicentric Castleman disease[J].Blood,2017,129:1646-1657.
[5]中华医学会血液学分会淋巴细胞疾病学组,中国抗癌协会血液肿瘤专业委员会,中国Castleman病协作组.中国Castleman病诊断与治疗专家共识(2021年版)[J].中华血液学杂志,2021,42:529-534.
[6]Zhang MY,Jia MN,Chen J,et al.UCD with MCD-like inflammatory state:surgical excision is highly effective[J].Blood Adv, 2021,5:122-128.
[7]Dong Y,Zhang L,Nong L,et al. Effectiveness of rituximab-containing treatment regimens in idiopathic multicentric Castleman disease[J]. Ann Hematol,2018,97:1641-1647.
[8]Zhang L,Zhao AL,Duan MH,et al.Phase 2 study using oral thalidomide-cyclophosphamide-prednisone for idiopathic multicentric Castleman disease[J]. Blood,2019,133:1720-1728.
[9]Li Z,Lan X,Li C,et al. Recurrent PDGFRB mutations in unicentric Castleman disease[J]. Leukemia, 2019, 33:1035-1038.
[10]Yu L,Shi M,Cai Q,et al. A Novel Predictive Model for Idiopathic Multicentric Castleman Disease:The International Castleman Disease Consortium Study[J].Oncologist, 2020,25:963-973.
[11]Zhou J,Zhang L,Liu X,et al. Evolution of Pulmonary Involvement in Idiopathic Multicentric Castleman Disease-Not Otherwise Specified:From Nodules to Cysts or Consolidation[J].Chest,2023.doi: 10.1016/j.chest.2023.03.022.
[12]Zhao H,Zhang M,Shen K,et al. A phase 2 prospective study of bortezomib,cyclophosphamide,and dexamethasone in newly-diagnosed iMCD patients[J]. Blood, 2023, 141: 2654-2657.
[13]Zhong NN, Liu B, Bu LL. Exploring Castleman disease in China: pre-IL-6 treatment era and advancements in knowledge[J]. Lancet Reg Health West Pac, 2023, 34:100747.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言