Respir Res:抑制内皮细胞中 Hsp110-STAT3 相互作用可减轻缺氧肺动脉高血压模型中的血管重塑
2023-11-29 刘少飞 MedSci原创 发表于上海
化合物6有望成为开发针对PAH的首创药物的有前途的先导化合物。这一发现为未来PAH治疗的研究和药物开发提供了新的方向。
研究背景:
肺动脉高压(PAH)是一种进行性而具毁灭性的疾病,其特征是与肺血管细胞的恶性表型相关的肺血管重塑。近期的研究报道了热休克蛋白110(Hsp110)在人体动脉平滑肌细胞中的作用。然而,在PAH早期阶段,特别是在最初发生紊乱的阶段,Hsp110在人体肺动脉内皮细胞(HPAECs)中的潜在作用和机制仍然未知。

研究方法:
在这项研究中,我们调查了Hsp110在PAH患者和大鼠模型中的表达,并在体内和体外确定了Hsp110的定位。我们评估了在低氧条件下,HPAECs中升高的Hsp110对细胞过度增殖和迁移的影响,并通过荧光偏振、抗聚集和蛋白印迹等方法筛选了靶向Hsp110-STAT3相互作用的小分子抑制剂。此外,通过干扰Hsp110-STAT3相互作用,我们评估了化合物6对体外HPAECs异常表型以及体内低氧诱导的PAH大鼠肺血管重塑的影响。
研究结果:
我们的研究显示,与相应的健康受试者相比,PAH患者血清中的Hsp110表达增加,PAH大鼠的肺部和肺动脉中也有增加。在低氧条件下,HPAECs中的Hsp110水平显著升高,并导致其异常表型。此外,通过增加p-STAT3和c-Myc,Hsp110-STAT3相互作用的增强导致了HPAECs的异常增殖和迁移。值得注意的是,我们成功地确定了化合物6作为强效的Hsp110-STAT3相互作用抑制剂,该化合物有效抑制了HPAECs的增殖和迁移,并在PAH大鼠中显著改善了右心肥厚和血管重塑。
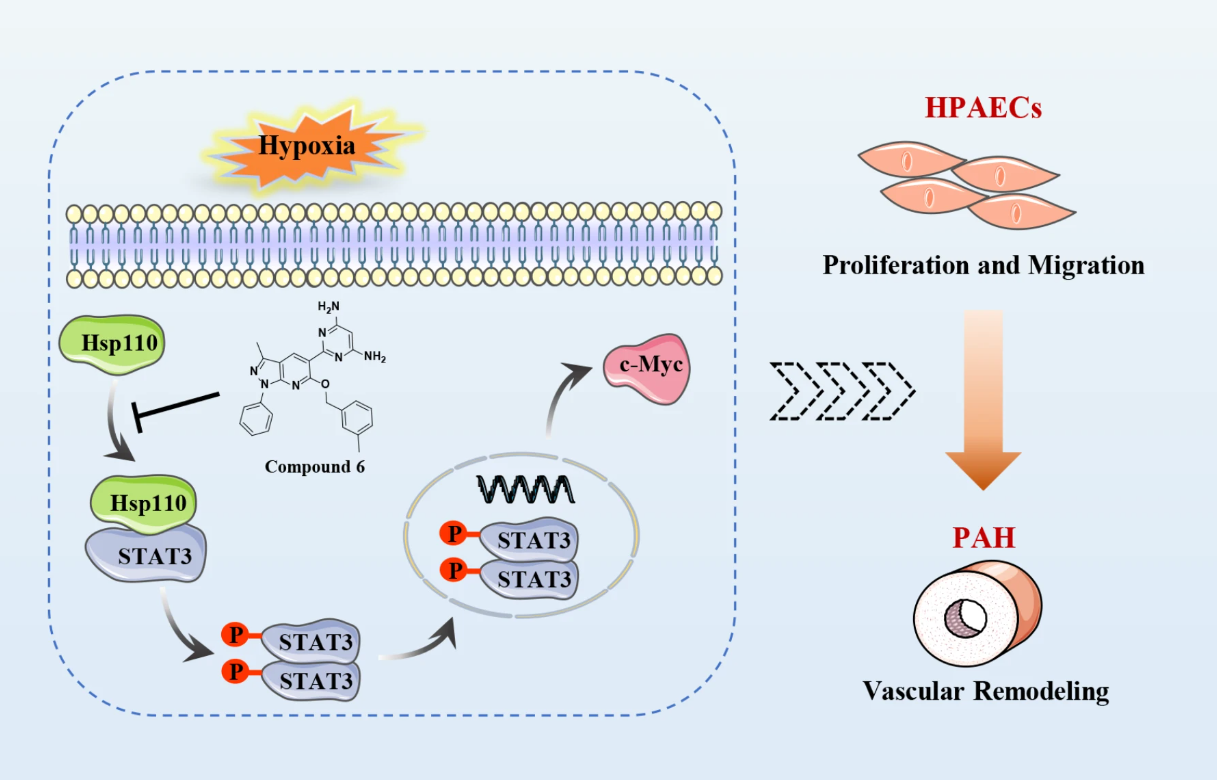
研究结论:
我们的研究表明,升高的Hsp110在HPAECs中发挥着重要作用,而抑制Hsp110-STAT3相互作用是改善血管重塑的新策略。此外,化合物6有望成为开发针对PAH的首创药物的有前途的先导化合物。这一发现为未来PAH治疗的研究和药物开发提供了新的方向。
原始出处:
Zhao C, Le X, Li M, Hu Y, Li X, Chen Z, Hu G, Hu L, Li Q. Inhibition of Hsp110-STAT3 interaction in endothelial cells alleviates vascular remodeling in hypoxic pulmonary arterial Hypertension model. Respir Res. 2023 Nov 17;24(1):289. doi: 10.1186/s12931-023-02600-5. PMID: 37978368; PMCID: PMC10655391.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#缺氧# #HSP110# #肺动脉高血压#
39