Sci Adv:熊海清/何爱彬团队开发超高通量单细胞表观遗传联合分析方法,同时检测5种组蛋白修饰
2024-02-04 测序中国 测序中国 发表于陕西省
研究团队开发了名为uCoTarget的技术,利用split & pool条形码策略实现了多个表观修饰蛋白的超高通量单细胞联合分析。
组蛋白修饰和转录因子通过塑造表观基因组决定基因转录和细胞命运的特异性。了解这些分子模式之间的共存和调控相互作用对于预测发育和疾病期间未来的基因表达和细胞命运至关重要。迄今为止,在同一单细胞中直接检测转录因子(TF)结合和组蛋白修饰还无法实现。目前,已被开发并广泛采用的单细胞表观修饰技术大多是基于pA/G-Tn5转座酶检测组蛋白修饰和TF结合位点。基于这一策略,北京大学-清华大学生命科学联合中心的何爱彬团队及其他团队报道了一种双组学方法,可同时检测单细胞中的单一表观基因组模式和转录组。但单细胞中高通量检测多种表观遗传蛋白的实验研究相对较少。
近期开发的scMulti-CUT&Tag、MulTI-Tag、nano-CUT&Tag(nano-CT)和纳米抗体-转座测序(NTT-seq)等技术已经实现了单细胞多模态染色质分析,这些方法能够同时分析单个细胞内的多种组蛋白修饰,但仍然存在一些限制。此外,这些技术并不适用于分析具有组蛋白修饰的TF结合,也不能用于分析它们在单个细胞中控制的表观遗传蛋白和转录组。
近日,北京大学-清华大学生命科学联合中心的何爱彬团队联合中国医学科学院北京协和医学院血液病研究所熊海清团队在Science Advances上发表了题为“Single-cell joint profiling of multiple epigenetic proteins and gene transcription”的文章。研究团队开发了名为uCoTarget的技术,利用split & pool条形码策略实现了多个表观修饰蛋白的超高通量单细胞联合分析。通过对灵敏度和多模态分辨率的不断优化,uCoTarget能够在单细胞中同时检测5种组蛋白修饰(H3K27ac、H3K4me3、H3K4me1、H3K36me3和H3K27me3)。在此基础上进一步优化革新,研究人员开发了uCoTargetX技术,率先实现了单细胞多种组蛋白修饰和转录组的并行检测。

文章表发于Science Advances
用于多个表观遗传蛋白平行分析的CoTarget设计
首先,研究人员开发了CoTarget,以同时检测多种组蛋白修饰。将针对不同组蛋白修饰或TF的特异性抗体与带有T7条形码接头(PAT-T7)的预组装pA–Tn5一起孵育后,将抗体-PAT-T7复合物引导至轻度固定的染色质位点进行标记,并使用相应的T7条形码识别抗体/靶蛋白组合,并在数据处理中进行解析。然后引入带有二次抗体的PAT-T5复合物,在表观遗传蛋白位点上进一步标记(图1A)。
研究团队验证了CoTarget的性能。在1000个细胞原位和ENCODE染色质免疫沉淀测序(ChIP-seq)的K562细胞中,不同组CoTarget的代表性活性基因周围存在强烈的H3K27ac信号,而H3K27me3和H3K27ac信号是相互排斥的(图1B)。进一步全面评估CoTarget的数据质量发现,所有三个数据集在相同的组蛋白标记中高度相关,并且相关性热图显示,无论组蛋白修饰的检测顺序如何,H3K27ac和H3K27me3数据集之间都有明显的分离(图1C)。这些结果表明,CoTarget允许以高信噪比有效地检测多个组蛋白标记。
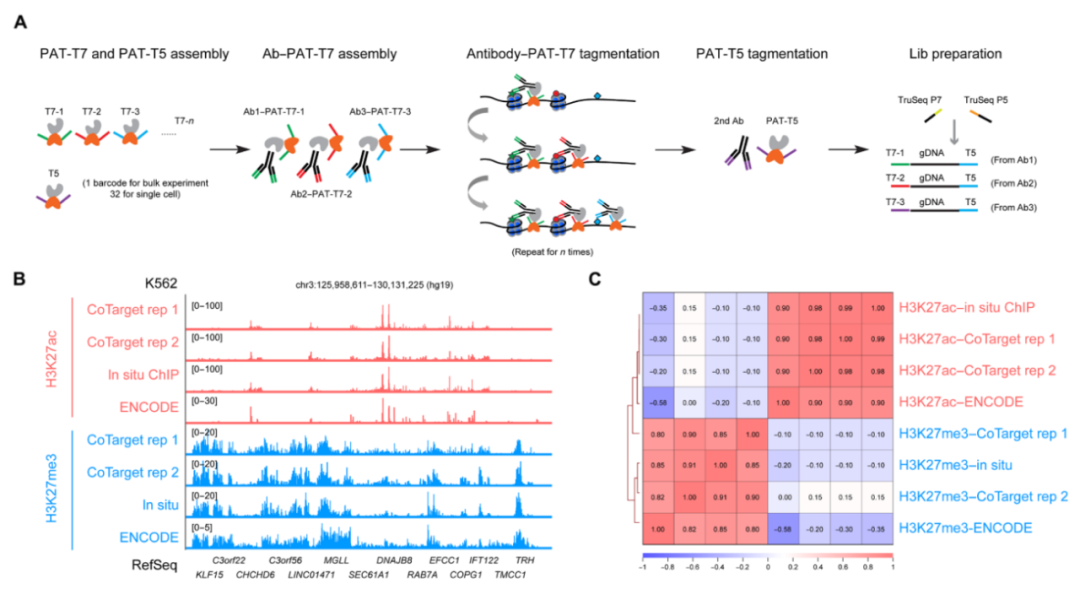
图1.CoTarget用于同时分析多种组蛋白修饰,来源:Science Advances
超高通量单细胞CoTarget同时检测五种组蛋白修饰
为了提高CoTarget的灵敏度和多模式分辨率,研究人员对许多关键步骤进行了优化,采取逐步添加带有特定标签的抗体-PAT-T7复合物的方案,规避了其他技术中共价交联和纯化的繁琐步骤,并且不依赖物种特异的一抗和特殊的微流控设备,开发了uCoTarget(图2A)。研究人员在K562和Kasumi-1细胞系中同时对多达5种激活或抑制性组蛋白修饰(H3K27ac、H3K4me3、H3K4me1、H3K36me3和H3K27me3)进行检测,证明了uCoTarget实验的真实性、可靠性和稳定性(图2E)。

图2.超高通量单细胞CoTarget能够准确分析五种组蛋白修饰,来源:Science Advances
uCoTarget分析HSPC生成过程中的三个标记
接下来,研究人员使用uCoTarget分析了不同的表观基因组模式如何使用造血干细胞/祖细胞(HSPCs)分化模型来协调细胞谱系的特异性。研究人员在人胚胎干细胞(hESC)中收集分化第8天的细胞,并进行了uCoTarget分析,以同时检测同一细胞中的H3K27me3、H3K27ac和H3K4me3(图3A)。基于H3K27ac谱的单个细胞聚类识别了三个主要群体,分别注释为中胚层、造血细胞和心肌细胞(图3B)。不出所料,研究人员在SMAD3位点的中胚层细胞和TAL1位点的HSPCs中观察到强烈的H3K4me3和H3K27ac信号。中胚层和心肌细胞中TAL1周围的H3K27me3信号可能根据较低的H3K27ac和H3K4me3抑制其表达(图3E和F)。
SMAD3增强子在中胚层细胞中具有很强的共结合信号,在HSPC中则显著降低。H3K4me3也表现出细胞类型特异性共结合事件,但H3K4me3的共结合系数低于H3K27ac,表明细胞类型特异性增强子的共结合更有可能驱动基因表达特异性(图3G)。值得注意的是,uCoTarget使研究人员能够联合分析多因素定义的顺式调控元件。以上结果支持了细胞类型特异性阐明HSPC分化的多模态表观遗传调控的重要性。
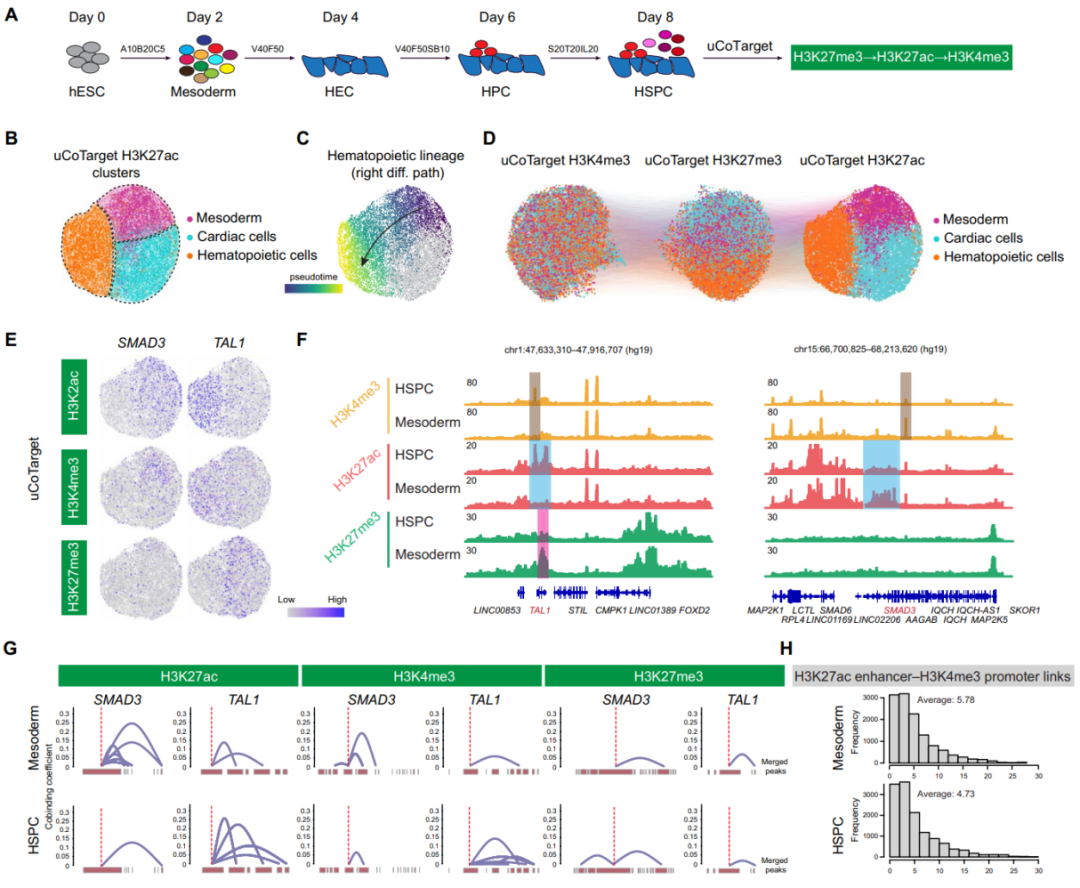
图3.uCoTarget分析造血干祖细胞生成过程中的组蛋白修饰,来源:Science Advances
uCoTarget探索HSPC分化过程中表观基因组的不同模式
为了揭示转录因子和组蛋白修饰在造血干细胞/祖细胞(HSPC)分化过程中细胞命运决定的协同或异步作用,研究人员结合体外分化模型,利用uCoTarget同时捕获RUNX1、标记活性增强子的组蛋白修饰H3K27ac以及抑制性组蛋白修饰H3K27me3。通过RUNX1-H3K27ac染色质速率(chromatin velocity)和轨迹分析,能在一定程度上预测心脏和造血谱系的分化路径(图4D)。
为了分析中胚层细胞向HSPC的转变过程中RUNX1和组蛋白修饰的动态变化,研究人员对uCoTarget-H3K27ac数据进行了差异分析,共鉴定出429个差异增强子区域,包括SMAD3、TEAD2(中胚层特异性)、ETS相关基因(ERG)和TAL1(HSPC特异性)(图4E). 结果发现,在HSPC生成过程中,RUNX1结合先于H3K27ac在HSPC特异性增强子区域的激活(图4F)。此外,染色质速度在很大程度上反映了HSPC分化的动态(图4G)。这些结果表明RUNX1启动H3K27ac调控了HSPC生成期间出现的表观基因组。
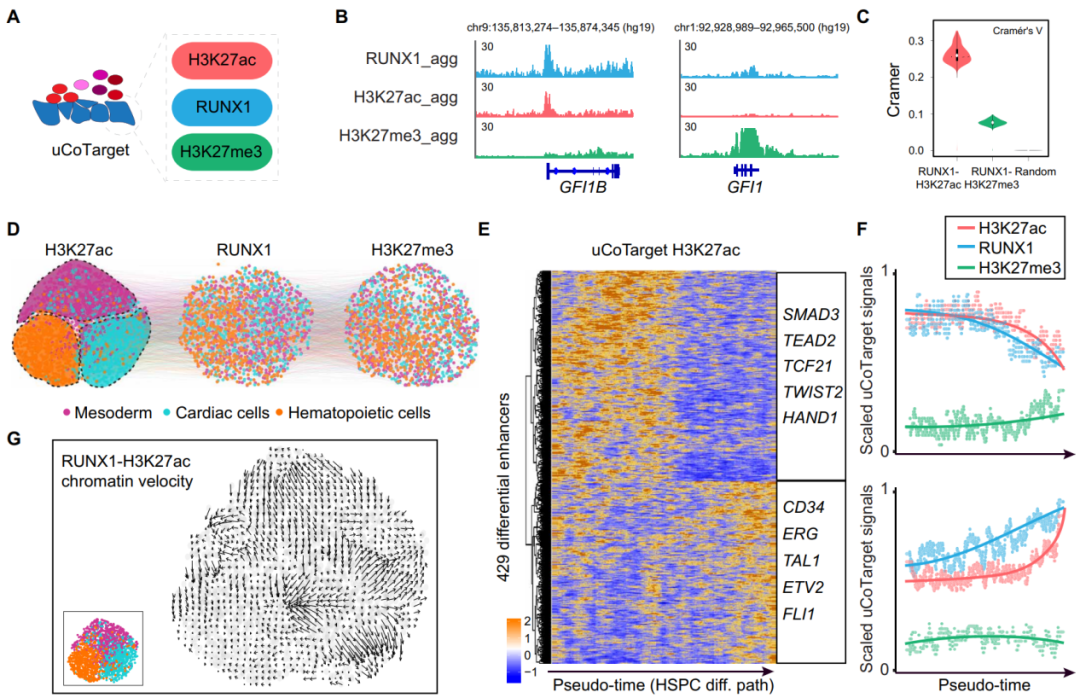
图4.uCoTarget揭示了RUNX1对H3K27ac的启动调控了造血干祖细胞的出现,来源:Science Advances
uCoTargetX用于单细胞转录组和多模态表观基因组的共测定
接下来,研究人员将uCoTarget与改进的Smart-seq2相结合,成功开发了uCoTargetX,实现了单细胞全基因组范围内多种蛋白-染色质的相互作用和mRNA同时捕获(图5A)。通过评估人胚胎肾293细胞中DNA或RNA模态条形码顺序的潜在影响,发现在条形码RNA条件下,每个细胞的特异性reads和基因数略高。此外,RNA模式通过分析单一模式或不同模式组合属于同一细胞类型的比例,提高了细胞类型识别的准确性(图5G)。为了在更动态的生物背景下对uCoTargetX进行基准检测,研究人员在HSPC分化过程中,在CD34+和CD34-细胞中进行了RNA-RUNX1-H3K27ac uCoTargetX分析(图5I),在KAT6B基因位点周围发现H3K27ac和RUNX1结合的差异富集,在RNA水平上没有,这表明表观基因组和转录组之间存在异步变化(图5J)。集成UMAP显示了从CD34-到CD34+细胞的分化轨迹,也验证了多模式分析的数据质量(图5K)。在CD34+和CD34−细胞中,RNA模式比RUNX1模式与H3K27ac的相关性更强(图5L)。
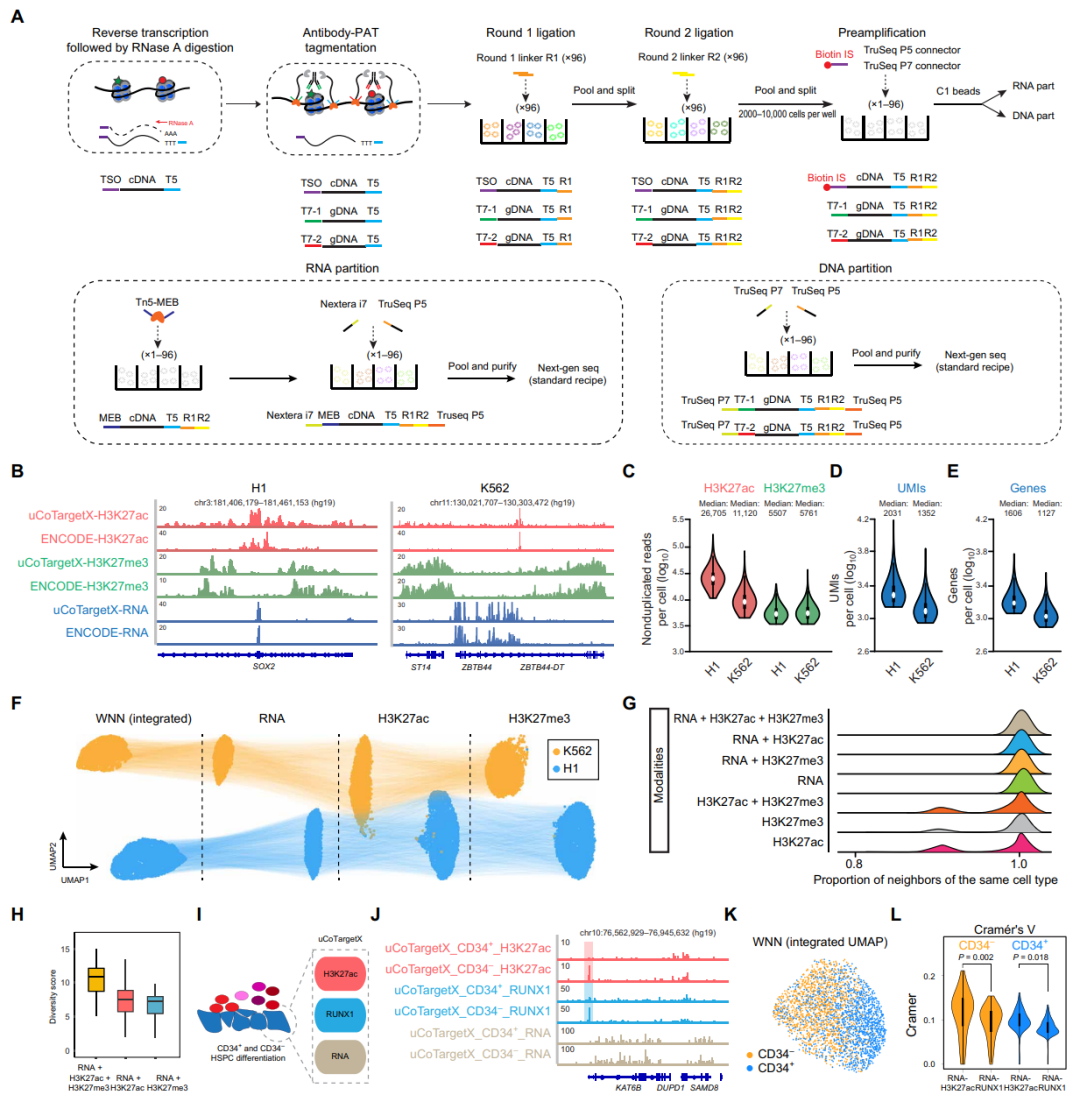
图5.uCoTargetX能够联合检测单细胞中的转录组和多种组蛋白修饰,来源:Science Advances
综上所述,研究团队提出了一种通用方法uCoTarget,可同时检测多种表观遗传模式,且具有超高通量,为多模式分析提供了更高的便利性和效率。此外,uCoTarget很容易实现,每个细胞的成本极低,仅需0.01美元。值得注意的是,uCoTarget的通量可以很容易地扩大到100万个单细胞,只需在一个96孔PCR板上对sublibraries进行测序。
uCoTarget能够同时检测5种组蛋白修饰,研究团队相信很容易将检测扩展到更多的表观基因组模式。当该方法也存在局限性:由于数据稀疏,当前的单细胞表观基因组和多模式方法还远未成熟。分子生物学优化有望进一步提高uCoTarget和uCoTargetX的灵敏度。展望未来,uCoTargetX具有构建人类细胞图谱的潜力,并揭示人类疾病中失调细胞谱系的表观遗传原理。
论文原文:
Xiong H, Wang Q, Li CC, He A. Single-cell joint profiling of multiple epigenetic proteins and gene transcription. Sci Adv. 2024;10(1):eadi3664. doi:10.1126/sciadv.adi3664
https://www.science.org/doi/10.1126/sciadv.adi3664
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#单细胞# #组蛋白修饰#
22