TGF-β或BMPR2信号通路失衡在肺动脉高压和系统性硬化症中的作用
2021-11-26 刘少飞 MedSci原创
肺动脉高压(PAH)是结缔组织病(CTD)的严重并发症,可导致系统性硬化症(SSc)死亡。在过去的十年中,人们对PAH和SSc中的microRNA(miRNA)产生了许多科学见解。
系统性硬化症 (SSc) 是一种复杂的多系统疾病,其特征在于皮肤和内脏器官内的纤维化和过度胶原沉积、慢性炎症、自身免疫失调和微血管内皮功能障碍。 随着血管紧张素转换酶抑制剂治疗SSc肾危象的出现,SSc 相关的肺动脉高压 (SSc-PAH) 已成为导致过早死亡的发病率和死亡率的主要原因。 因此,SSc-PAH 的预后较差。 PAH是 SSc的主要死因,影响了所有SSc患者的12%,PAH诊断后3年内死亡率为50%。 在特发性PAH中,PAH的年死亡率仍然高达10%。 PAH的定义是平均肺动脉压 (mPAP)升高>25 mmHg,肺毛细血管楔压<15 mmHg。 SSc-PAH在 SSc患者中的患病率各不相同,但在10%到12%之间。
SSc-PAH 是中小型肺血管系统进行性重塑的结果。疾病进展的确切机制尚不清楚,但研究发现炎症和内皮损伤是常见的前兆。此外,肺动脉血管收缩和细胞增殖在 PAH 进展过程中发生。肺血管系统中进一步的缺血-再灌注损伤会促进额外的细胞因子释放,从而促进血管重塑、纤维化和腔内微血栓形成。最终结果是肺血管阻力、肺动脉压和右心室 (RV) 压力超负荷的逐渐增加。SSc-PAH 的死亡率和治疗反应比特发性肺动脉高压 (IPAH) 差,部分原因可能是其多方面的潜在机制和多系统性质。因此,一种多学科方法,包括使用生物标志物进行早期诊断或治疗以及更好地表征 SSc-PAH 的临床表型,可能有助于 SSc-PAH 的管理。
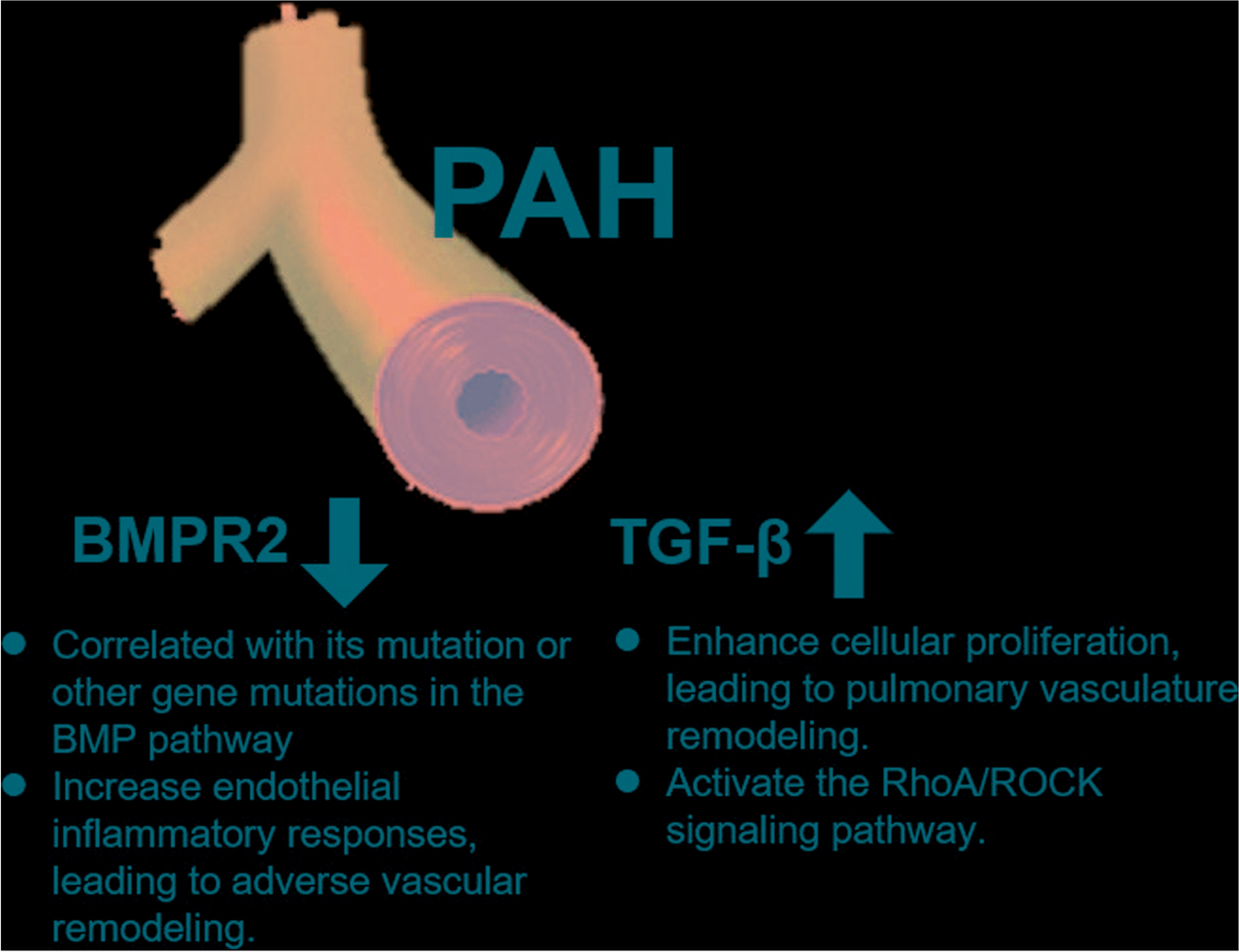
通常,人们认为PAH分子水平的特征是转化生长因子-β (TGF-β) 和骨形态发生蛋白 (BMP) 信号传导失衡。已知骨形态发生蛋白受体 II 型 (BMPR2) 参与成骨和细胞分化。BMPR2通路抑制肺循环内的 SMC 细胞增殖,主要是在肺小动脉内。当发生突变时,BMPR2与发生 PAH 的易感性增加有关。TGF-β 信号通路对组织具有复杂且相反的作用。
TGF-β 信号在PAH中的作用
TGF-ß 信号与 PAH 的发病机制密切相关。TGF-β 信号的激活对于 PAH 的形成至关重要。TGF-ß 信号调节多个过程,包括细胞增殖和血管生成。根据临床和实验数据,TGF-β 在 PAH 中升高,并与它的发病机制有关。IPAH 患者的 TGF-ß 血清浓度升高。PAH 肺中的抗增殖 BMP 信号减弱,而循环 TGF-β 水平升高会增强血管细胞的增殖,导致肺血管系统发生闭塞性重塑。对野百合碱 (MCT) 处理的大鼠模型的研究表明,用口服活性小分子转化生长因子-β 受体 1 型 (TGF-βR1) 抑制剂抑制 TGF-β 通路可以降低 MCT 诱导的肺动脉高压 (MCT-PH) )。这些发现证实内皮细胞凋亡通过 TGF-β 诱导肺动脉平滑肌细胞 (PASMC) 生长。腺病毒介导的 TGF-βR1 过表达导致肺纤维化和 PH,与重塑肺血管周围肺组织中 TGF-β 信号传导增加相关。TGF-β 与其受体结合激活下游信号级联,例如 SMAD 蛋白。PAH 中的血管重塑是平滑肌细胞肥大和血管细胞增殖的结果。已提议通过 TGF-β 及其下游介质 SMAD2/3 增加信号传导以驱动肺血管重塑。前期研究表明,PAH大鼠注射TGF-β1重组蛋白可激活RhoA和ROCK的mRNA和蛋白表达,揭示TGF-β1的过表达可能激活RhoA/ROCK信号通路,促进PAH的发生发展。
BMPR2 在 PAH 中的作用
BMPR2 是 BMP 途径的跨膜丝氨酸/苏氨酸激酶受体,对胚胎发生、发育和成体组织稳态至关重要。BMP 诱导的 BMPR2 与 BMP I 型受体 (BMPR1) 的异聚复合物形成。BMPR2 随后通过磷酸化激活 BMPR1。之后,激活的 BMPR1 通过 SMAD1/5/8 转录因子的磷酸化将信号传播到细胞中。
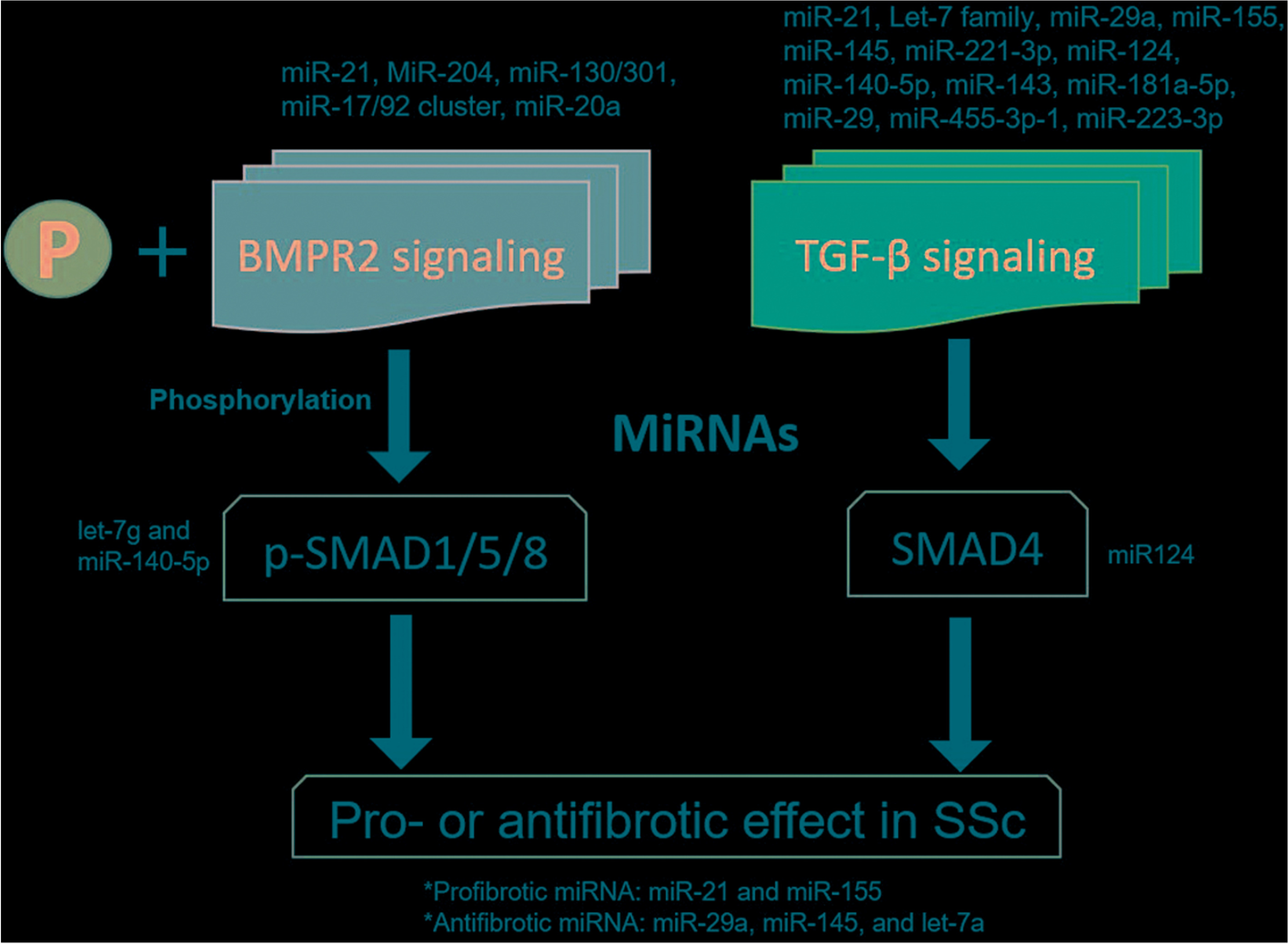
之前的一项研究表明,SSc-PAH 患者的 BMPR2 蛋白减少,并且在相关小鼠模型中发现 BMPR2 的蛋白酶体降解增加。总的来说,这些结果表明 TGF-β 可能通过其受体的降解来削弱 BMP 信号传导并促进 SSc 中的PAH敏感性,这可能为不同形式的多环芳烃提供统一的机制。尽管 BMPR2 通路对于血管稳态至关重要,并且 BMPR2 突变与 PAH 之间存在很强的相关性,但 BMPR2 突变的不完全外显率(20-30%)表明其他遗传和环境因素可能导致这种疾病。一种 BMPR2 剪接变体缺少外显子 12,它是该基因的最大外显子并编码细胞质尾部。已经表明,这种变异的携带者更容易患上 PAH。此外,BMP 通路中其他基因的突变进一步加强了该通路在 PAH 中的因果作用的概念。此外,已经描述了修饰基因、感染、毒性暴露、炎症或雌激素代谢改变的共存,其中一些被发现下调 BMPR2 表达。例如,促炎细胞因子如肿瘤坏死因子 α (TNF-α) 和白细胞介素 6 (IL-6) 会诱导抑制 BMPR2 表达的 miRNA 表达。此外,BMPR2是用于维持肺动脉内皮细胞衬里屏障功能必不可少的,BMPR2缺乏增加血管内皮细胞的炎性反应,从而促进不良血管重塑。最近的研究表明 BMPR2 表达和下游信号在特发性和遗传性 PAH 患者的肺血管系统中降低。尽管肺血管系统中 BMPR2 表达增加,但 MCT 和 SuHx 大鼠模型确实出现了 PAH 并损害了下游 BMPR2-Smad 信号传导。
参考文献:
Xu B, Xu G, Yu Y, Lin J. The role of TGF-β or BMPR2 signaling pathway-related miRNA in pulmonary arterial hypertension and systemic sclerosis. Arthritis Res Ther. 2021 Nov 25;23(1):288. doi: 10.1186/s13075-021-02678-6. PMID: 34819148.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#硬化症#
43
#动脉高压#
41
#BMP#
51
#系统性#
33
#TGF#
39
#TGF-β#
34
#信号通路#
44
#系统性硬化#
26
学习了
61