JCI:肺间充质中过度活跃的 mTORC1 诱导内皮细胞功能障碍和肺血管重塑
2023-12-26 刘少飞 MedSci原创 发表于上海
本研究旨在深入了解这种疾病的分子机制,特别是LAM细胞如何影响ECs,从而导致肺血管的异常改变。
研究背景
淋巴管平滑肌瘤病(LAM)是一种进展性的囊性肺疾病,由于肺部间质细胞中的结节性硬化复合体1/2(TSC1/2)基因突变引起,导致机械靶向雷帕霉素复合体1(mTORC1)的激活。除了呼吸系统的损害外,LAM还表现出一些患者伴随肺血管重塑和肺动脉高压。然而,在LAM细胞与内皮细胞(ECs)之间如何进行通信以引发血管重塑的过程中,仍知之甚少。本研究旨在深入了解这种疾病的分子机制,特别是LAM细胞如何影响ECs,从而导致肺血管的异常改变。

研究方法:
我们采用了一系列方法来研究LAM病理生理学,包括对末期LAM肺组织的分析以及利用小鼠模型进行体内研究。首先,在末期LAM肺组织中,我们识别了内皮细胞功能的异常表现,包括增加的增殖、迁移、缺陷的血管生成以及异常形成的内皮管网络。接着,我们使用了一种mTORC1增活的小鼠模型(Tbx4LME-CreTsc2fl/fl),该模型通过肺间质中Tsc2基因的敲除模拟了LAM疾病。我们在小鼠的8周和1年龄两个时间点进行了ECs的分子学分析,并通过单细胞RNA测序来识别LAM细胞与ECs之间的分子交流。
研究结果:
在研究的初期,我们发现了Tbx4LME-CreTsc2fl/fl小鼠的ECs在8周龄时出现了显著的转录组变化,尽管此时肺远端微血管的形态学尚未发生变化。然而,到了1年龄,这些小鼠自发性地发展出了肺血管重塑,伴随着中膜厚度的增加。通过对1年龄小鼠肺的单细胞RNA测序,我们确定了源自Tsc2KO间质的旁分泌配体,这些配体可以通过动脉EC中的受体进行信号传递。这些ECs具有转录上改变的基因,包括与血管重塑相关的通路中的基因。
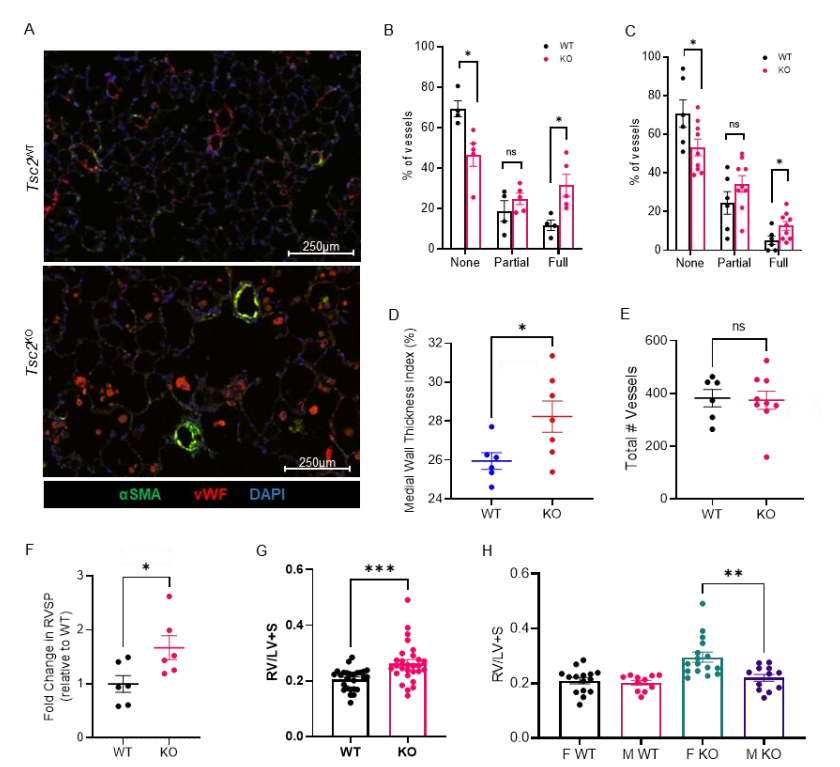
研究结论:
本研究强调了在LAM中间质与ECs之间的病理生理学上的交流。尽管LAM患者和Tbx4LME-CreTsc2fl/fl小鼠的ECs并不携带TSC2突变,但我们的研究证明了在LAM中,持续活跃的mTORC1肺间质细胞编排了EC反应的异常,这为肺血管的重塑做出了贡献。这一发现对于理解LAM的病理生理机制,以及未来可能的治疗方法提供了新的视角。该研究结果突显了LAM疾病中间质-EC轴改变的重要性,并为进一步研究和临床干预提供了基础。
原始出处:
Lin SM, Rue R, Mukhitov AR, Goel A, Basil MC, Obraztsova K, Babu A, Crnkovic S, Ledwell O, Ferguson LT, Planer JD, Nottingham AN, Vanka KS, Smith CJ, Cantu Iii E, Kwapiszewska G, Morrisey EE, Evans JF, Krymskaya VP. Hyperactive mTORC1 in lung mesenchyme induces endothelial cell dysfunction and pulmonary vascular remodeling. J Clin Invest. 2023 Dec 21:e172116. doi: 10.1172/JCI172116. Epub ahead of print. PMID: 38127441.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#内皮细胞# #肺间充质祖细胞#
21