血液中枢神经系统屏障(BCNSB)的破坏是许多神经炎症性疾病的标志,例如多发性硬化症(MS)。美国犹他大学的研究团队使用MS小鼠模型和自身免疫性脑脊髓炎(EAE)小鼠模型,发现内皮到间充质的转变(EndoMT)发生在临床症状发作前的中枢神经系统中,并且在BCNSB损伤中起主要作用。
EndoMT可由IL-1b刺激的信号通路诱导,其中ARF6的激活导致与ALK-SMAD1/5通路的串扰。抑制ARF6的活化既可以预防和逆转EndoMT,稳定BCNSB功能,减少脱髓鞘。即使在在严重的EAE后也能减轻症状,而不会对自身进行免疫损害。ALKs的抑制也降低了EAE模型中的疾病严重程度。因此,IL-1b-ARF6-ALK-SMAD1/5通路的多种成分可以靶向治疗神经炎症性疾病的。
内皮特异性Arf6敲除
可阻断MS进展并减少血管渗漏
为了检查ARF6是否参与EAE的建立和进展,研究团队构建了全身敲除小鼠(Arf6f/-;Rosa26-CreERT),内皮特异性Arf6敲除小鼠(Arf6f/f;Cdh5-CreERT2),T细胞特异性Arf6敲除小鼠(Arf6f/-;Lck-Cre)和造血细胞特异性Arf6敲除小鼠(Arf6f/-;Vav1-iCre)。
作者用髓鞘少突胶质细胞糖蛋白(MOG35-55)处理小鼠以诱导EAE,并在28天内评估临床评分和体重。产后第1天全身或内皮特异性敲除Arf6可显着降低临床评分的严重程度并限制体重减轻。HE染色以及LFB染色分别显示内皮特异性Arf6敲除小鼠的T细胞浸润减少和脱髓鞘减少。
总体而言,ARF6的内皮特异性抑制稳定了BCNSB并显着抑制了EAE的进展,而不影响T细胞的全身水平。
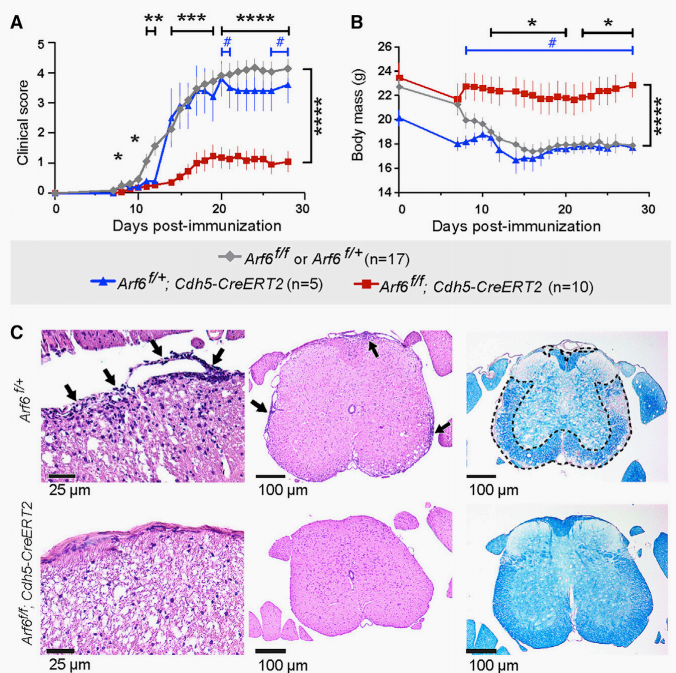
图1.小鼠内皮特异性Arf6 敲除阻断疾病进展
抑制ARF6的药物是
治疗MS的潜在治疗策略
用NAV-2729(每日腹膜内注射30mg/kg),小分子ARF6抑制剂预防治疗野生型C57BL/6J小鼠,降低临床评分,体重减轻和血管渗漏。为了确定抑制ARF6是否可能为治疗MS提供潜在的治疗策略,研究团队在EAE诱导后13天开始每天用NAV-2729治疗EAE小鼠。
结果发现NAV-2729治疗后降低了临床评分,防止体重减轻,并减少T细胞浸润和脱髓鞘。
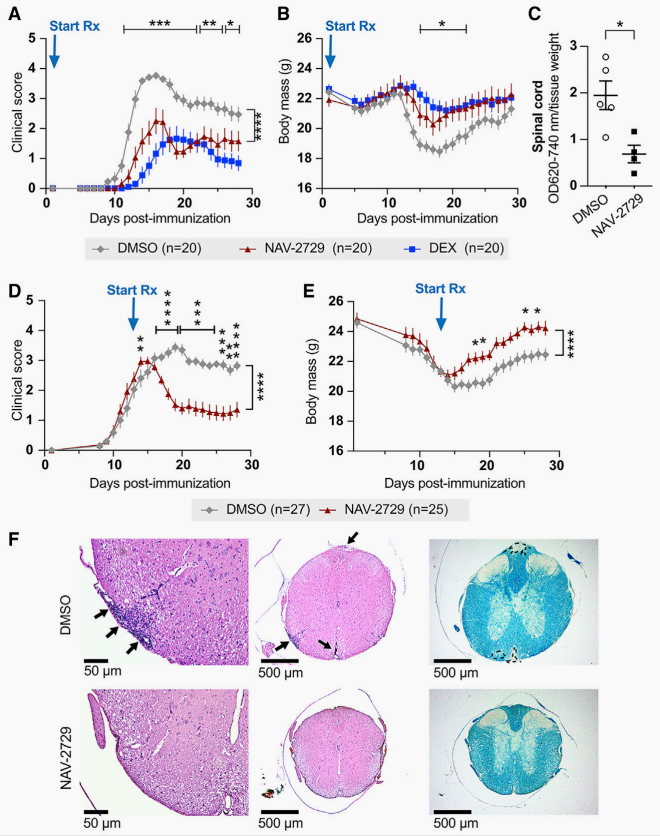
图2.ARF6的药理学抑制逆转MOG诱导的EAE小鼠的症状和病理学
Arf6的内皮特异性丢失
或ARF6的全身抑制可降低
中枢神经系统血管中的EndoMT
为了确定血管渗漏是否可能在导致临床症状的EAE的早期进展中发挥作用,研究人员在EAE诱导后使用EvansBlue染色评估了C57BL/6J EAE小鼠大脑和脊髓中的血管通透性,发现在这个症状前时间点确实血管通透性增加,其中大部分发生在大脑和尾脊髓。在免疫后第14天和第21天,渗透性增加并扩散到整个脊髓。因此,研究人员假设EndoMT可能是EAE模型中BCNSB中断的驱动因素。
为了验证这一假设,研究团队在EAE诱导后分离脊髓微血管并通过免疫荧光检查pSMAD1/5、N-钙粘蛋白和SNAI2表达水平,发现EndoMT标记物信号增加。总之,这些结果表明EndoMT是BCNSB功能障碍的催化剂,并且EAE病理生理学可以通过ARF6抑制来逆转。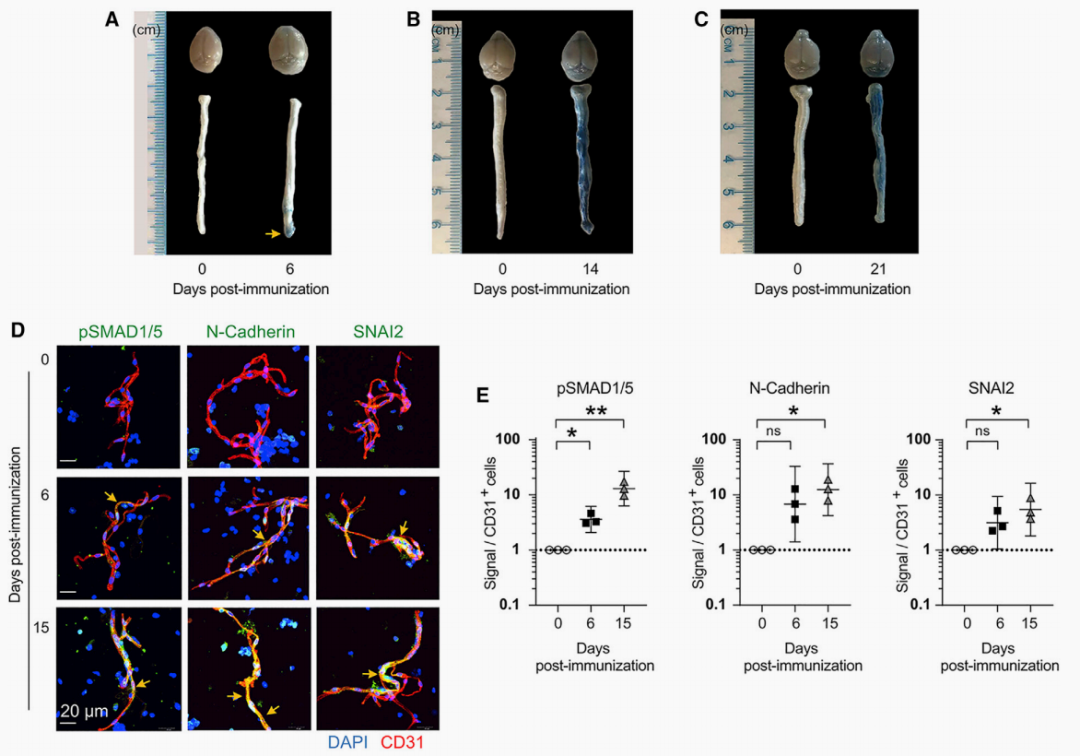
图3.抑制Arf6 可降低了从EAE小鼠脊髓分离的微血管中的EndoMT
IL-1b和ALK信号之间的串扰
诱导人脑微血管内皮细胞中的EndoMT
IL-1b可诱导内膜MT,导致内皮屏障功能丧失;此外,ARF6可被IL-1b激活以增加内皮通透性。为了确定IL-1b是否可能驱动EndoMT和血管渗漏,研究人员用IL-1b处理了人脑微血管内皮细胞(HBMECs)。IL-1b在12小时和20小时诱导内皮细胞和EndoMT标志物的形态学变化,其中CD31被下调,而Snail和N-钙粘蛋白被上调。
这些结果表明IL-1b可以以ALK依赖的方式激活SMAD1/5,这表明IL-1b和ALK信号之间的串扰会导致EndoMT。
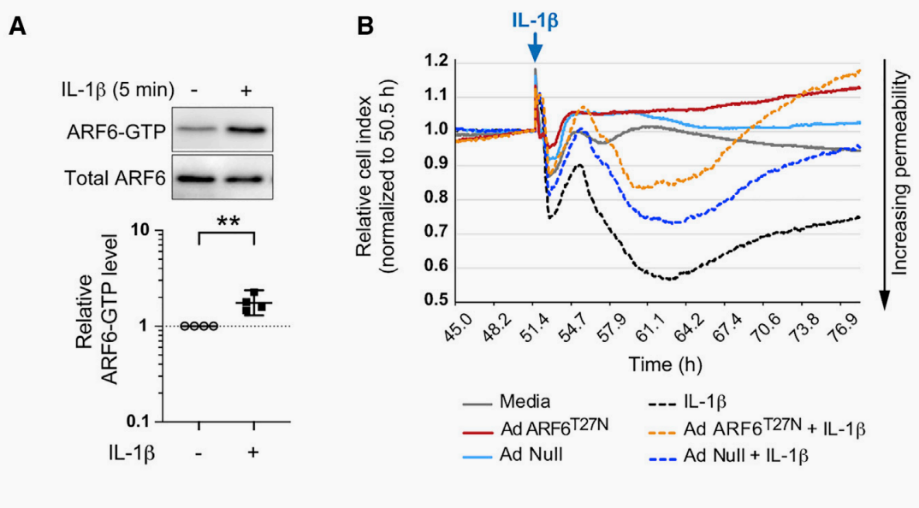
图4.ARF6是IL-1b诱导的EndoMT所必需的
抑制ALK受体可减少
血管渗漏并阻止EAE的进展
该研究的体内和体外数据表明,ARF6通过其ALK的激活在调节EAE的病理生理学方面起着至关重要的作用,从而导致EndoMT和BCNSB的分解和血管渗漏。这提示阻断ALK应减少MSEAE模型中的临床症状,脱髓鞘,EndoMT和血管泄漏。
因此,在EAE诱导后的第1天至第28天每天用ALK抑制剂LDN193189和SB431542治疗EAE小鼠,发现抑制ALK可降低临床评分,稳定体重,并减少T细胞浸润和脱髓鞘,降低了EndoMT和脊髓和大脑中的血管通透性。
结 论
综上所述,研究人员发现在慢性炎症条件下,IL-1b诱导ARF6激活,通过尚未确定的机制促进与ALK-SMAD1/5通路的串扰。SMAD1/5的激活会刺激转录调节因子的表达,从而导致内皮细胞标志物的丢失和间充质细胞标志物的获得,并导致血液中可溶性部分的血管渗漏。白细胞被募集到中枢神经系统实质中的脱髓鞘和炎症部位。这一过程会加速CNS炎症并抑制髓鞘再生,并导致神经退行性变。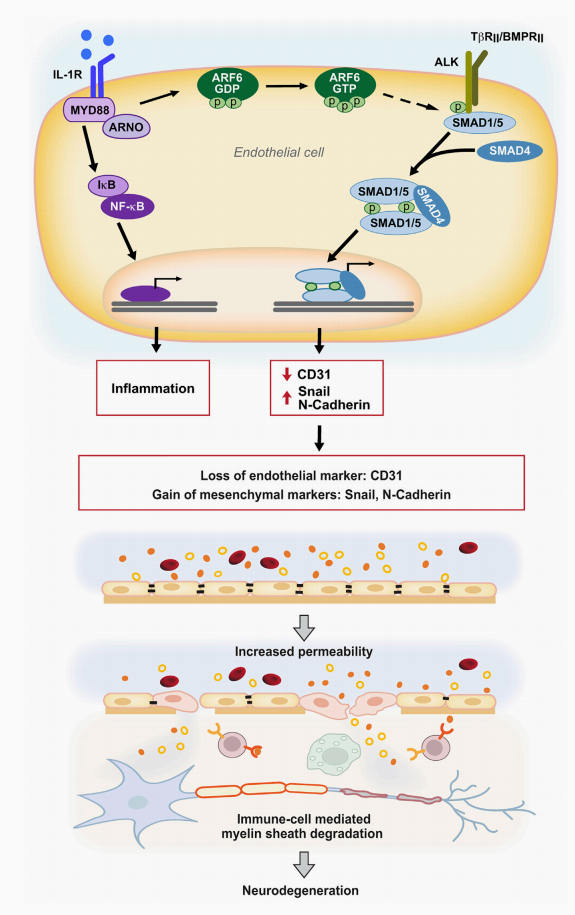
图5.BCNSB中EndoMT响应MS炎性刺激示意图
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言