NEJM Evid:avapritinib治疗惰性系统性肥大细胞增多症安全有效
2023-06-24 MedSci原创 MedSci原创 发表于上海
2021年6月16日,美国FDA批准avapritinib(阿伐替尼片)用于治疗晚期系统性肥大细胞增多症(AdvSM)的成年患者,包括侵袭性系统性肥大细胞增多症(ASM)、伴有相关血液肿瘤的系统性肥大
2021年6月16日,美国FDA批准avapritinib(阿伐替尼片)用于治疗晚期系统性肥大细胞增多症(AdvSM)的成年患者,包括侵袭性系统性肥大细胞增多症(ASM)、伴有相关血液肿瘤的系统性肥大细胞增多症(SM-AHN) 和肥大细胞白血病 (MCL)患者。该申请获得了优先审评、突破性认定和孤儿药认定。
2023年6月5日,KIT/PDGFRA抑制剂泰吉华(阿伐替尼片)已被美国食品药品监督管理局(FDA)批准用于治疗惰性系统性肥大细胞增多症(ISM)成人患者,这是全球首个且目前唯一获批用于治疗该疾病的药物。FDA批准基于PIONEER研究的结果。

在PIONEER研究的随机、双盲、安慰剂对照部分中,共有141名患者在13个国家的49个研究中心接受泰吉华每日25毫克加最佳支持治疗,71名患者接受安慰剂加最佳支持治疗(安慰剂组)。该研究包括经中心病理学审核确诊为ISM的成人患者,同时患者需满足接受优化的最佳支持治疗的情况下,仍然有中度至重度疾病负担。所有患者在试验期间能够继续进行针对症状的对症治疗,并在24周的治疗期结束后有选择地参加泰吉华®的开放标签扩展研究。治疗组和对照组的患者基线人口统计学特征平衡,并反映了显著的疾病负担。使用ISM症状评估表(ISM-SAF)评估疾病症状。
2020 年 9 月至 2022 年 1 月期间,第 2 部分中 13 个国家 42 个地点的 212 名患者被随机分配接受每日一次口服 avapritinib 25mg (n=141) 或安慰剂 (n=71) 治疗; 数据截止日期为 2022 年 6 月 23 日。
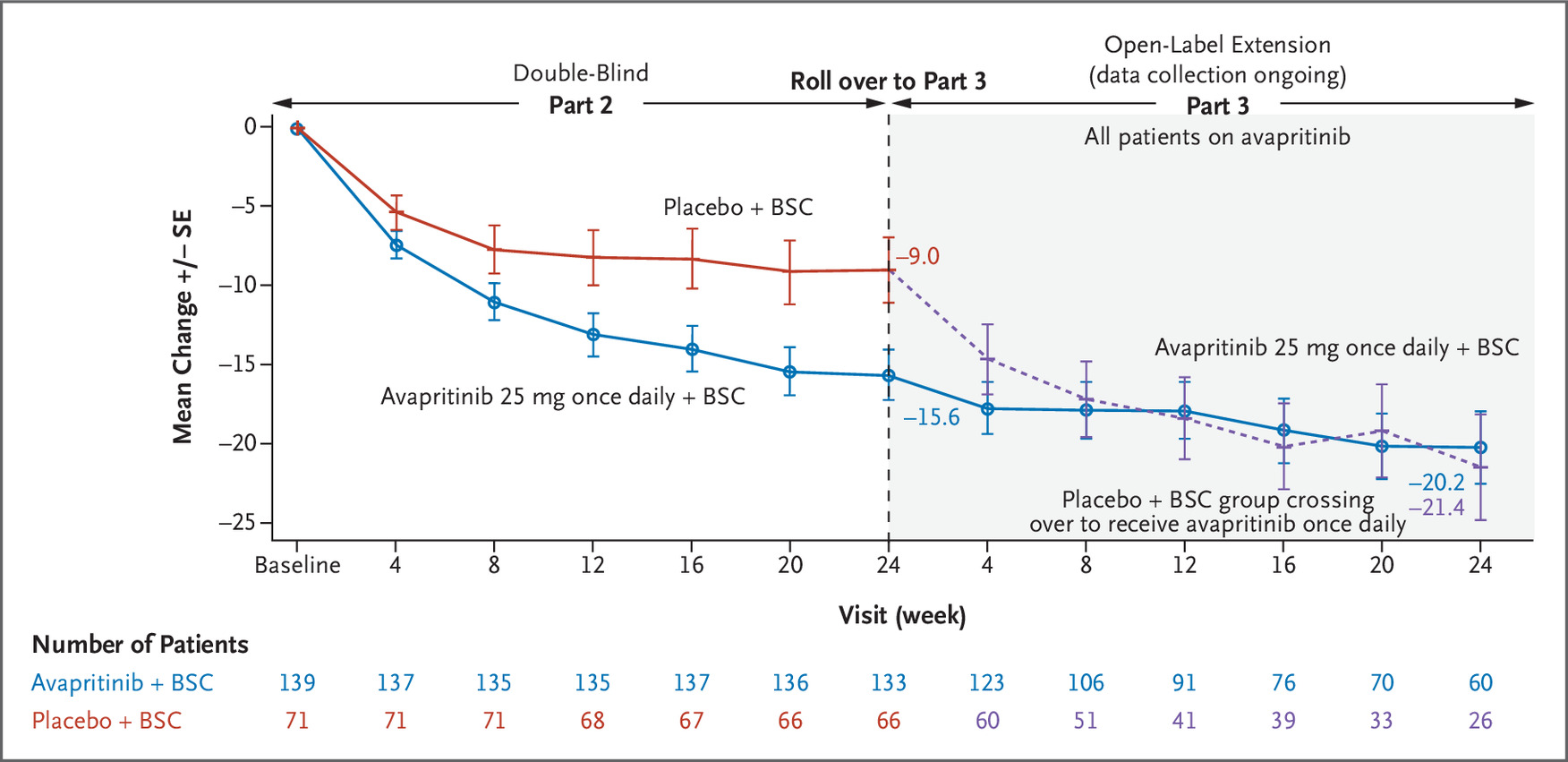
在第 2 部分中,主要终点显示,从基线到第 24 周,avapritinib 治疗的患者平均 TSS 降低了 15.6 点(95% CI,–18.6 至 –12.6),而降低了 9.2 点(95% CI,–13.1 至 –5.2)。 )在安慰剂组中(P=0.003)(图2)。
从基线到第 24 周,avapritinib 组 141 名患者中的 76 名(54%;45% 至 62%)与安慰剂组 71 名患者中的 0 名相比,血清类胰蛋白酶水平降低了≥50%(P<0.001)(图 .3A)。 从基线到第 24 周,avapritinib 组 118 名患者中有 80 名(68%;59% 至 76%)外周血中 KIT D816V VAF 降低 ≥50%,而安慰剂组 63 名患者中有 4 名(6%;59%;59%)外周血 KIT D816V VAF 降低 ≥50%。 2%至16%;P<0.001)(图3B)。 从基线到第 24 周,141 名 avapritinib 治疗患者中的 35 名(25%;18% 至 33%)的 TSS 降低了≥50%,而 71 名安慰剂治疗患者中有 7 名(10%;4% 至 19%;P= 0.005)(图3C)。 从基线到第 24 周,141 名 avapritinib 治疗患者中有 64 名(45%;37% 至 54%)的 TSS 降低了 30% 以上,而 71 名安慰剂治疗患者中有 21 名(30%;19% 至 42%;P= 0.009)(图3D)。 从基线到第 24 周,106 名 avapritinib 治疗患者中的 56 名(53%;43% 至 63%)骨髓肥大细胞负荷减少 ≥50%,而 57 名安慰剂治疗患者中有 13 名(23%;13% 至 63%)骨髓肥大细胞负荷减少 ≥50%。 36%;P<0.001)。

骨髓肥大细胞负担的变化
从基线到第 24 周,阿伐普替尼组骨髓肥大细胞负荷的平均百分比变化(SD;95% CI)为 –11.3%(84.1%;95% CI,–26.4 至 3.8%),而阿普替尼组为 0.4%(69.1%;95 安慰剂组的 % CI,–17.3 至 18.1%(图 S3)。
最严重的症状
第 24 周时,avapritinib 治疗组最严重个体症状的平均 (SD) 变化为 –2.2 (2.3),而安慰剂组为 –1.4 (1.9)。 图 4 显示了显示单个患者预先指定的皮肤斑点分析的图像(与第 24 周相比的基线)。 使用 Avapritinib,单个患者的皮肤斑点从基线到第 24 周得到改善。
到第 24 周时,阿伐普替尼治疗组中有 24% 的患者减少/停止了 BSC 的使用,而安慰剂治疗组中这一比例为 13%(差异:11 个百分点;1 至 22 个百分点)。 总体而言,服用安慰剂的患者中有 11% 增加了 BSC 的使用,而服用 avapritinib 的患者只有 8% 增加了 BSC 使用率(差异:3 个百分点;–12 至 5 个百分点)。
患者生活质量
与安慰剂相比,接受 avapritinib 治疗的患者的 SF-12 身体评分分别增加了 20%(14% 至 26%)和 12%(5% 至 19%); SF-12 心理健康部分得分分别增加了 12%(8% 至 17%)和 6%(–1% 至 13%)。 EQ-VAS 评分分别增加 19%(10% 至 27%)与 5%(–4% 至 13%),MC-QoL 评分分别下降 34%(–40% 至 –29%)与 18%(–25%) 分别为 –11%)。 第 24 周及一段时间内的 MC-QoL 域如图 S4 所示。
开放标签扩展
在第 3 部分中,在第 3 部分中完成额外 24 周治疗的交叉患者 (n=26) 中,48 周时 TSS 的平均变化为 –21.4(95% CI,–28.0 至 –14.9)(图 1)。 2); 在这些患者中,37%(41 名中的 15 名)和 59%(41 名中的 24 名)在大约 4 个月内 TSS 分别降低了 ≥50% 和 ≥30%(图 3C 和 3D)。 在接受 avapritinib 治疗的患者中,TSS 随时间持续变化,如图 2、3C 和 3D 所示。
最常见的治疗相关不良事件(≥5%)是头痛(泰吉华7.8% vs. 安慰剂 9.9%)、恶心(泰吉华 6.4% vs. 安慰剂 8.5%)、外周水肿(泰吉华6.4% vs. 安慰剂 1.4%)、眶周水肿(泰吉华 6.4% vs. 安慰剂 2.8%)和头晕(泰吉华 2.8% vs. 安慰剂 7.0%)。大多数水肿AEs为1级,没有导致治疗中止的情况。
总之,在 PIONEER 试验的这项为期 24 周的盲法阶段中,avapritinib 在改善 BSC 上有中度至重度 ISM 症状的患者症状方面表现出优于安慰剂的效果。 各组之间 AE 的总体发生率相似,停药率较低。 正在进行的 5 年开放标签扩展旨在评估 avapritinib 的长期疗效和安全性。
原始出处:
Avapritinib versus Placebo in Indolent Systemic Mastocytosis, NEJM Evid 2023;2(6) DOI: 10.1056/EVIDoa2200339
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言