摘要 负压性肺水肿(NPPE)是由急性或慢性上气道梗阻引起的并发症,临床医生识别和诊断常具有挑战性。如果不及时治疗,NPPE会导致低氧血症、心力衰竭甚至休克。此外,NPPE的药物治疗仍然是一个有争议的话题。NPPE始发病理生理机制包括需要高吸气压力来抵消上气道梗阻,随后导致胸腔内负压逐渐增大,肺微血管压力增加,肺毛细血管液渗入肺泡。NPPE有许多危险因素和原因,麻醉和拔管后喉痉挛最为常见。由于NPPE与胃食管反流或心源性肺水肿等疾病相混淆,NPPE的诊断常存在挑战,因为这些疾病的诱因相似。保持上气道通畅、正压无创通气、给氧和再插管机械通气是治疗NPPE的基础。本文就NPPE的病因、临床表现、病理生理及治疗进行综述。
-
前言
负压性肺水肿(Negative pressure pulmonary edema,NPPE)是由胸腔内负压迅速升高引起的非心源性肺水肿,可因急性或慢性上气道梗阻而发生,可导致危及生命的低氧血症;上气道梗阻可由多种潜在因素引起,包括喉痉挛、异物及气管插管等,导致呼吸困难。当病人呼吸时,毛细血管产生负压,肺毛细血管液体渗入肺泡和间质,导致肺泡和间质水肿。上气道梗阻与肺水肿的关系最早由Moore和Binger在1927年提出,但直到1973年才报道第一例临床病例。此后NPPE被多次报道,其发生率各不相同。在一项对176名重度上气道梗阻儿童的研究中,NPPE发病率为9.6%,另一项研究报道急性上气道梗阻患者NPPE发病率高达12%。据澳大利亚事件监测研究(AIMS)统计,喉痉挛患者NPPE发病率为3%,也有报道低至0.1%。因此,NPPE的估计发病率在0.1 - 12%之间。但是考虑到上气道梗阻在围麻醉期间频繁发生,推测实际发生率可能比目前报道的要高得多,因为个别病例被误诊或忽略了。关于死亡率的报道也各不相同,以前描述为11 - 40%,最近文献综述显示,死亡率仅为2%。最近一项对成人耳鼻喉(ENT)手术中NPPE的系统回顾报告,死亡率为5%,并确定年龄和住ICU是死亡率增加的主要风险。由于NPPE的高发病率和误诊率,临床实践中有望进一步提高NPPE的诊断、治疗和管理水平。本文就NPPE流行病学、病理生理学、临床表现及治疗等方面的最新研究进展作一综述。
-
病因学
几种急慢性疾病可引起上气道梗阻,每种疾病均可导致NPPE。上气道创伤,更常见的是喉痉挛,占梗阻后NPPE的50%左右。此外,上气道感染和声带功能障碍也是NPPE的潜在原因。
急性气道梗阻:在成人患者中,导致NPPE的气道梗阻最常发生于拔管后喉痉挛。大多数儿童病例是由声门、急性传染性喉头炎或会厌炎引起的声门下梗阻。在这些儿科病例中,由于声门或声门上梗阻,伴长喘鸣和肺水肿而出现呼吸衰竭,通常在机械通气后才确诊。
慢性气道梗阻:慢性上气道梗阻,在具有多种潜在因素的患者中很常见,包括肥胖、梗阻性睡眠呼吸暂停、扁桃体或腺体肥大、上气道肿瘤、纵隔肿瘤、鼻咽肿块、甲状腺肿和肢端肥大症。特别是肥胖和梗阻性睡眠呼吸暂停的成年患者,其特征是间歇性呼吸浅慢和低氧血症,表现出反复出现的上气道梗阻,引起间歇性肺水肿倾向。
其他风险因素:一些研究回顾了包括围麻醉期诱发NPPE危险因素的病例,如肥胖伴梗阻性睡眠呼吸暂停和解剖气管插管困难,以及鼻、咽和喉部手术或疾病。有上述危险因素的患者宜采用清醒插管,因为全麻拔管后气道并发症的风险可能增加。因此,在这些患者中确保了最佳的上气道肌张力,术后应在麻醉后监护病房密切观察,观察持续时间取决于具体的个体。
-
发病机制及病理生理特征
NPPE的出现是多种因素综合作用的结果。发病机制主要有两种,静水压型肺水肿和通透性增加型肺水肿。静水压型肺水肿的机制表明,NPPE是由胸腔内压力变化引发的液体明显转移引起的(图1)。通透性增加型肺水肿背后的机制表明,严重机械应力引起肺泡上皮和肺泡微血管膜破坏,导致肺毛细血管通透性增加和富含蛋白的肺水肿。由于急性肺损伤患者的肺泡上皮屏障,过滤肺泡水肿液体的能力通常会受损,而静水压性肺水肿则不会,因此测定肺水肿液体/血浆蛋白比值,常用于区分这两种肺水肿。例如Fremont等人在10名NPPE患者插管后初始8小时收集了水肿液和血浆样本。肺水肿液/血浆蛋白比值平均为0.54±0.15,8 h内肺泡液清除率为14.0±17.4%/h。肺水肿液/血浆蛋白比值和肺泡液清除率,支持了静水压性肺水肿的发生机制。
Starling 理论: Starling理论是描述液体通过肺毛细血管内皮-肺泡壁屏障这一过程的重要理论。Starling方程包括决定NPPE形成的因素:Qf=[Kx(Pmv-Pi )]–[ σx(πmv-πi)],其中Qf 为毛细血管膜间的流体净通量,K为毛细管渗透系数,Pmv 为毛细管膜的静水压,Pi 是肺泡间质静水压,σ是反射系数(即膜阻挡蛋白质通过的能力),πmv 是微血管蛋白质渗透压,πi 是间质蛋白渗透压。生理条件下,当流体静水压处于平衡状态时,从毛细血管流向肺间质的初级血浆液量很少,然后液体被淋巴管再吸收。然而当组织间液生成多于再吸收时,即形成水肿。
Müller试验:Müller试验是在声门关闭后尝试强迫吸气,这一行为可显著增加胸腔负压。肺血管周围和肺间质内压力也可通过周围结构压力传递而显著降低。在健康人群中,平静吸气末胸腔内压力范围在-8 ~ 4cmH2O之间,呼气末在-4 ~ 2cmH2O之间。然而当气道梗阻时,强烈吸气能产生低至-50 ~ -100cmH2O的胸内压。强烈吸气努力可能产生更大的负压(-140cmH2O)。虽然胸腔内负压诱发肺水肿的确切阈值尚不清楚,但可能存在个体差异,因为Starling方程中每个个体的参数不同。
心室前负荷和后负荷:胸腔内压力的降低传递到肺间质,最终导致回流到右心房的静脉血流量增加。右心负荷增加导致肺血容量、肺毛细血管静水压和毛细血管静水压力梯度的增加,促进了肺水肿形成。相比之下,胸腔内压力的降低会增加左心室(LV)后负荷,增加左心室舒张末期容积和压力。降低了左室射血量和射血分数,最终导致肺微血管压升高。
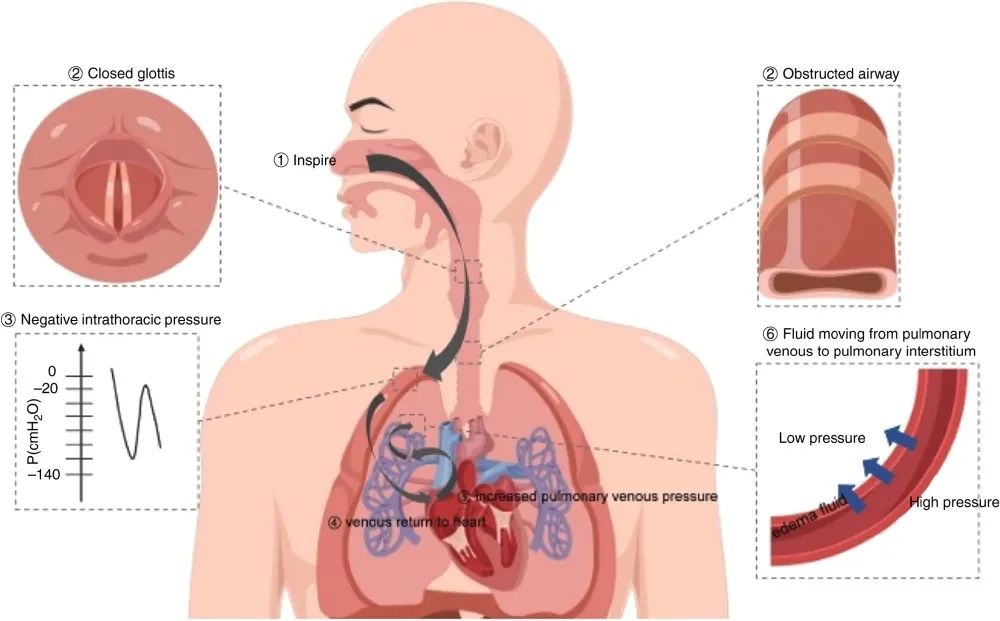
图1 NPPE发病机制 NPPE发生于上气道梗阻或部分梗阻时。用力吸气对抗梗阻,胸腔内产生负压,增加静脉回流和左心室前负荷。肺静脉内压力升高,导致液体从毛细血管渗漏到肺部,导致肺水肿。
心室间依赖:静脉回流增加导致右心室充盈增加,将室间隔挤向左心室,导致左室容量和顺应性下降(“心室间依赖性”),最终导致左室舒张末压升高。胸内负压增加了左心室和主动脉之间的压力梯度,从而增加了左室后负荷。
肺毛细血管通透性:通常认为,在胸腔负压情况下,肺毛细血管通透性增加。一般当肺血管顺应性较低时,肺血容量增加会改变膜的通透性,甚至破坏膜的完整性,最终导致体液和血细胞渗入肺泡。这种损伤效应已在实验和临床中得到证实。
低氧血症和高肾上腺素能状态:伴随上气道梗阻的低氧血症和高肾上腺素能状态也可导致肺水肿。高肾上腺素能状态单独由上气道梗阻引起,因低氧血症增强。缺氧和代谢性酸中毒(发生在缺氧时,由于无氧代谢、循环受损或氧利用受损)导致肺微循环血管收缩,增加肺循环阻力,从而改变肺毛细血管渗透能力,抑制心肌功能。交感神经系统兴奋性的增加导致循环集中和全身血液向肺循环运动,从而增加肺微血管压。
高肾上腺素能状态也能改变肺毛细血管壁的完整性。此外自主神经过度兴奋促进神经源性肺水肿的发展,这种情况的特征是由于中枢神经系统功能障碍或损伤导致肺部液体积聚,如创伤性脑损伤、颅内出血、癫痫、脑肿瘤或影响中枢神经系统的感染。肾上腺髓质儿茶酚胺的强烈释放,导致肺毛细血管膜通透性和肺微血管压力增加,目前认为是肺水肿的主要致病机制。
-
临床表现
症状:值得注意的是,患者可能存在上气道梗阻的易感因素。上气道梗阻症状包括喘鸣、呼吸窘迫、胸部反常运动和呼吸时辅助呼吸肌的参与。急性肺水肿的临床表现包括呼吸困难、呼吸急促、发绀、哮喘和产生大量粉红色泡沫状痰。因此急性肺水肿潜在的呼吸功能障碍和气体交换紊乱可能会导致并发症,包括低氧血症、高碳酸血症和代谢性酸中毒。
疾病进展:延迟起病的病例很少见,但有报道在上气道梗阻后1 ~ 6小时发生肺水肿。由于临床表现严重程度的多样性,一些轻微的病例可能未能识别。病情严重程度与梗阻持续时间和肺毛细血管损伤的程度有关。
有研究建议,对于已有或易感上气道梗阻的患者,即使未观察到肺水肿表现,拔管后的观察期也应延长。对于一些患者,手术室脉搏氧监测和麻醉后监护可以识别任何危险因素。NPPE症状和体征不典型,偶尔NPPE的临床表现可能仅引起脉搏氧饱和度轻微下降。当患者呼吸室内空气时,这一点可能更加明显。某些情况下只有胸部影像才能识别NPPE的风险。
症状消退:一旦气道得到保护,气道负压就可通过正压机械通气缓解。肺泡或间质水肿的影像学分析表明,NPPE通常在12 - 24小时内消退。有时NPPE消退需要更长时间,这与肺微血管损伤的程度有关。多数情况下NPPE会在12 - 24小时内缓解。
NPPE的后果:部分NPPE患者可能出现长期并发症,如心肌梗死、短暂性脑缺血发作、非ST段抬高型心肌梗死、低氧性脑损伤和肺出血。少数可能死于感染性休克和心脏骤停等。
-
鉴别诊断
临床上表现为轻度呼吸窘迫、轻度氧饱和度下降、轻度咳嗽或咳嗽伴泡沫痰、轻度胸部不适等症状的患者很难诊断NPPE。通常当上气道梗阻解除,但症状尚未完全缓解时才可进行诊断。NPPE应区别于下面疾病,治疗方法与NPPE不同。
胃内容物误吸:如果排除NPPE,首先应考虑胃内容物误吸和继发肺炎。吸入性肺炎有时会自限,只需支持性护理,如氧气治疗、液体和营养支持、症状管理、呼吸支持以及监测和观察,取决于吸入物的数量和质量,如pH值和吸入颗粒物的类型。直接喉镜检查或纤维支气管镜检查,可以帮助微粒吸入的诊断。胸部X射线无助于区分肺水肿和吸入性肺炎。
急性呼吸窘迫综合征(ARDS):根据患者危险因素,必须排除ARDS。ARDS是一种严重的肺部疾病,其特征是肺部突发和广泛炎症,导致氧合受损和呼吸困难。虽然ARDS和NPPE都涉及氧合受损和呼吸窘迫,但潜在机制不同。ARDS主要由肺泡和肺组织的炎症和损伤引起,导致肺血管通透性增加,液体渗漏到肺泡中。相反,NPPE是由于上气道梗阻导致肺部负压,导致液体积聚和肺水肿。快速的临床改善也有助于确认梗阻后NPPE的诊断。
高血容量:可以测量中心静脉压和肺毛细血管楔压,来解释循环高容量的可能性。治疗方法包括限制液体量(确保减少液体摄入,或与液体出量平衡)、扩张血管和使用利尿剂。
心脏功能异常:必须排除心脏功能不全的诊断,特别是对于既往有心脏病史或有显著心脏危险因素(如高血压、糖尿病、肥胖和年龄)的患者。这些心脏功能不全包括由瓣膜病引起的心肌缺血、心律失常和心脏失代偿。可以使用影像学辅助,NPPE常显示明显的双侧肺门周围肺泡浸润。心源性肺水肿浸润更倾向于间质性,典型表现为明显的肺血流分流。
新型冠状病毒肺炎(COVID-19):突发性呼吸衰竭和双肺斑片状浸润是NPPE最常见的表现。NPPE的临床诊断可能与COVID-19的临床诊断相混淆,NPPE和COVID-19都能在胸部CT上呈现磨玻璃样阴影。NPPE的特征性改变主要表现在中央区域,而COVID-19主要表现在肺外周区域。此外,NPPE导致血管清晰度下降,而COVID-19导致病变区域的血管扩张。这些差异和病人的病史对于区分这两种相似的影像学至关重要。临床医生必须了解COVID-19和NPPE之间的区别,以确保正确的诊断和治疗。
-
治疗方法
NPPE的治疗取决于其严重程度和病因,在轻病例中,单纯氧疗可能就足够了。通过正确的的诊断和治疗,NPPE可在24小时内康复。
通气支持:治疗NPPE的主要方法是保持气道通畅和氧气支持。诊断NPPE时一般不需要进行侵入性检查,但需要在重症监护病房密切观察,直至病情稳定。通常需要气管插管开放气道和机械通气支持。在Lang等人报道的病例中,85%的成年患者和儿童需要插管,50%需要机械通气,50%需要持续呼气末正压通气。最初的尝试是在没有插管的情况下维持气道通畅和吸氧。一些患者只需要氧气支持、只需要戴面罩持续PEEP或两者都需要。严重肺水肿通常需要在手术室或麻醉后监护室再插管。多数机械通气患者在24h内肺水肿得以缓解并拔管。机械通气PEEP可改善氧合,降低所需氧浓度。
如果上气道梗阻使气管插管困难,PEEP可能具有挑战性。急性会厌炎也会出现气管插管困难。这些情况下,临床医生需要做好准备,通过环甲状膜切开术或气管切开术快速获得气道通路。
液体管理:在心源性肺水肿的治疗中,利尿剂和类固醇常作为辅助药物,以促进液体清除。然而,一些利尿剂如速尿,是有争议的。一些研究表明,利尿剂仅对ARDS有效,对其他患者的作用有限。在过去,对于NPPE患者不建议限制液体摄入和使用利尿剂,因为大量液体转移到肺部而缺乏有效循环血容量,可能会加重他们目前的状态。
其他治疗措施:通常不需要有创的血流动力学监测,但对鉴别诊断有帮助。过去曾使用肾上腺皮质激素治疗,但目前不支持或推荐这种方法,因为没有直接解决NPPE的潜在机制。对支气管扩张剂的使用也进行了研究,尽管梗阻可能不是由支气管痉挛引起的,但这些研究表明,支气管扩张剂(如β受体激动剂)可以增加肺泡液体的清除,以减少肺水肿症状。如前所述,出现上气道梗阻或有诱发因素但尚未出现肺水肿的患者需要在麻醉后监护病房进行密切观察,但观察时间仍有争议。此前,Grant等人报导了一例26岁的喉乳头瘤病女性患者,在直接喉镜检查后出现喉痉挛,患者出现严重NPPE,机械通气支持无效,经静脉-静脉体外膜氧合治疗成功。
预防:为了减少或消除NPPE,研究了几种预防策略。拔管前应彻底抽吸患者口咽分泌物,因为带血的分泌物可引起喉痉挛;喉镜检查次数增加与喉痉挛发生率有关;拔管前可使用5mg地塞米松,以减少多次插管引起的喉部水肿。这种效果与通过增加麻醉深度,以及增强肌肉松弛程度,来降低喉痉挛频率。有报道称气管拔管前5分钟使用1~2mg/kg利多卡因可减少儿童喉痉挛,拔管前60秒给予0.5mg/kg剂量的异丙酚也能有效降低喉痉挛的发生率。此外,气囊漏气测试可以帮助预防拔管后水肿的风险。气囊漏气试验的原理是气囊放气处漏气量与喉部水肿引起的喉部梗阻程度成反比,如果患者在PEEP过程中咳嗽时能听到漏气,拔管可能成功。
7.结论
NPPE是上气道梗阻的一种罕见但可致命的并发症,症状不典型者常被误诊。在排除其他因素后,出现上气道梗阻后肺水肿症状应考虑NPPE。治疗包括密切监测、及时缓解气道梗阻、给予氧疗并在必要时辅助通气。由于个体间差异,NPPE的流行病学、病因学和病理生理过程一直是争议话题,一直存在挑战。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









认真学习了
37