急性髓系白血病(AML)的诊断、风险分层和治疗正在以前所未有的速度发展。随着过去十年对AML基础生物学的科学认识不断提高,特别是将MRD纳入纵向风险评估中,从而增强了预测工具和风险评估的精细化。WHO 和国际共识分类 (ICC) 最近更新了AML的分类,欧洲白血病网也更新了预后分层、缓解评估和 MRD 确定的建议。过去5年中新诊断AML患者的治疗选择发生了革命性变化,导致强化治疗患者和更适合非强化化疗患者的结局均显著改善;并且复发患者也可获得了更有效的靶向治疗选择,进一步推进治疗库并改善了患者结局。
近日《Lancet》发表一篇重磅综述“Acute myeloid leukaemia”,现整理翻译全文如下,如有谬误敬请各位老师批评指正,如需全文请联系赵龙飞,微信15203118065。

AML是一种恶性克隆性疾病,特征为骨髓原始细胞增殖伴扩增和分化阻滞,导致正常造血作用失效,并导致危及生命的血细胞减少和输血依赖。AML可累及所有年龄段的人群,但最常见于老年,诊断时的中位年龄为68岁,患者中有2/3超过55岁。AML多为散发,但公认长期环境或职业暴露于石油化工或苯是发生髓系恶性肿瘤(如AML或骨髓增生异常综合征)的风险因素,还包括既往暴露于细胞毒性药物或放疗的患者(即治疗相关AML)。此外,随着对遗传性血液恶性肿瘤认知的不断增加,发现约5-10%的AML与胚系易感(germline predisposition)相关。
全球每年有超过80000例AML患者死亡,预计在未来20年这一数字将增加一倍。美国AML的患者的5年相对生存率目前为30.5%,与2000年的仅18%相比有所改善。AML的改善与许多因素有关,包括最佳支持治疗(即抗真菌和抗菌预防和治疗)的进展、移植相关死亡率的降低(使更多患者尤其是老年患者能够从这种治愈手段中获益)以及有效和新型治疗方案的可及性提高。瑞典一项全国登记调查表明,随着时间的推移患者结局有所改善,且主要发生在五六十岁的中年男性中。此外生存预期仍有年龄依赖性,诊断时年龄<50岁的患者估计5年生存率为62%,50-64岁患者为37%,≥65岁患者仅有9.4%。
AML的及时诊断极为重要,常表现为内科急症。尽管其表现症状多为非特异性,但患者常表现出与免疫抑制、骨髓抑制(包括危及生命的贫血或血小板减少)和白细胞增多相关的一系列体征和症状(panel 1),因此应高度怀疑血液恶性肿瘤。医疗人员应意识到下面几种情况的重要性:在中性粒细胞减少性发热时开始广谱抗生素治疗、在白细胞增多时迅速开始细胞减灭治疗、治疗弥散性血管内凝血以及管理自发性或治疗诱发肿瘤溶解综合征。

如果怀疑急性早幼粒细胞白血病,应紧急开始全反式维甲酸治疗,因为至开始治疗时间是与生存期相关的重要预后因素。如果出现以下情景应高度怀疑急性早幼粒细胞白血病:形态学显示早幼粒细胞(尤其是伴多个Auer小体或双叶核),或伴颅内出血和自发性弥散性血管内凝血的临床表现,或流式细胞术标志物提示急性早幼粒细胞白血病(髓系区域 CD34 和 HLA-DR 阴性或 CD33 和髓过氧化物酶阳性),以及证实t(15;17) 染色体易位(通过细胞遗传学)或PML::RARA(通过FISH或RT-PCR)。急性早幼粒细胞白血病患者的早期识别和治疗启动至关重要,因为预期全反式维甲酸治疗和三氧化二砷治疗的治愈率可超过90%.
图1为建议的AML诊断评估项目及相关时间线。

即使处于诊断评估中,也仍需要进行仔细的持续监测,以确保充分管理急性髓性白血病的上述体征和症状;在这种情况下延迟治疗1-2周以获得完整的诊断结果,并在临床稳定的患者中开始最佳治疗是适当的。诊断应包括骨髓穿刺和粗针活检,除了原始细胞注释(blast annotation)以外还应关注整体骨髓细胞构成和形态,以及标准急性髓性白血病标志物(即CD34、髓过氧化物酶、CD33和CD117)的常规免疫组化。流式细胞术对于确定异常原始细胞群的骨髓性质越来越不可或缺,并且对于在诊断时识别异常白血病相关免疫表型至关重要,以实现跟踪白血病原始细胞随时间的变化从而确定可测量残留病 (MRD) 的存在和程度。常规细胞遗传学分析对于提供分期和分类信息至关重要,且可得到急性髓性白血病 FISH辅助,后者包括常见融合基因(即RUNX1::RUNX1T1,CBFB::MYH11,KMT2A重排等)和常见细胞遗传学异常(如–5/5q,–7/7q,+8,del(17p))的;AML的FISH 检测包括常见的AML相关细胞遗传学异常,在分裂相(metaphases)不足以进行常规细胞遗传学分析或隐匿性重排时特别有帮助。
还应通过分子生物学方法鉴定融合基因,以确定融合的确切断裂点,从而可以在诊断和随访时通过 RT-qPCR 或 ddPCR 进行定量。分子检测现在多通过二代测序开展,对于AML诊断越来越常规,可提供分类定义、预后突变及临床可操作突变(可用于优化治疗方案,包括IDH1、IDH2和FLT3)的信息。需要注意的是,常见的预后不良的FLT3–ITD突变在使用标准二代测序进行鉴定时可能极具挑战性,部分学术和研究实验室没有基于杂交捕获的化学和优化的二代测序生物信息学流水线,因此大多需要通过 PCR 片段分析进行独立的FLT3–ITD检测,然后进行毛细管凝胶电泳。PCR 检测的可及性通常比二代测序更早,这个问题很重要,因为FLT3–ITD突变可早期指导治疗。DNA 和 RNA 的基线储存也很重要,可与通过确定残留病的分子技术来定量初始治疗缓解。
最后,如果计划给予蒽环类药物为基础的治疗,临床评估还应包括心脏功能,例如使用经胸超声心动图或多门控采集扫描来确定充分的左心室收缩功能。对于诊断时存在髓外疾病、白细胞增多症(白细胞计数≥50 ×109),FLT3–ITD突变AML或伴单核细胞分化的AML(即FAB分类的 M4 或M5)的患者,应考虑进行腰椎穿刺以评估软脑膜病变。此外如果进行了腰椎穿刺,建议预防性给予鞘内阿糖胞苷或甲氨蝶呤。
对于AML的确诊,外周血或骨髓髓系原始细胞计数曾经的要求为≥30%,最近修改为≥20%,或存在定义AML的特异性基因组异常(无论原始细胞百分比如何)。如果疑似或确诊为急性髓性白血病,建议进行综合的诊断评估,包括形态学评估、免疫表型(流式细胞术),以及考虑全基因组注释的预后和治疗效果进行的基因组分析(包括常规核型和分子评估),以充分表征AML(图1)。
自1976年最初的FAB分类以来,急性髓性白血病的分类已经得到了数次迭代更新,该分类仅基于形态学,目前已无法充分代表疾病分类或风险。最近WHO和国际共识分类(ICC)分别更新了急性髓性白血病的分类,欧洲白血病网络建议采用 ICC 分类,两者均更佳依赖细胞遗传学和分子特征。但WHO 和 ICC分类之间也存在一些显著差异,例如ICC分类要求重现性(recurrent)遗传学异常AML的诊断需要原始细胞计数≥10%,而 WHO未明确定义遗传学异常的最低原始细胞阈值(伴BCR::ABL1或CEBPA 突变AML除外,其中AML的定义仍要求原始细胞≥20%)。
新版ICC 分类的重大修改在于用原始细胞阈值来定义骨髓增生异常综合征(MDS)和急性髓性白血病,并创建了一个新的患者类别,即原始细胞10-19%的患者(之前为MDS伴原始细胞增多2;MDS–EB2),现命名为“MDS/AML”,因为该术语可更好地反映患者遗传和临床连续性,并使患者有可能获益于MDS和AML治疗选择。
ICC 还认识到 TP53 突变是一种特定的髓系肿瘤,因为需要将这种特别高危的亚组作为独特的MDS/AML和AML亚类进行管理。与 WHO 相反,ICC也删除了继发性、治疗相关和胚系相关髓系肿瘤,而是优先考虑细胞基因组学特征并突出这些特征作为诊断限定词。
尽管两种不同的AML分类系统存在相关挑战,但它们之间的微小不一致有望整合到下一个更新版本中,总体而言,这些更新的指南均强调了细胞遗传学和分子特征在疾病分类、风险预测和治疗结局中的重要性。
AML源自获得致病性基因异常,包括造血干细胞和祖细胞发生的结构性细胞遗传学改变和重现性突变,结果导致克隆性增殖优势和自我恢复。AML基因组学定义了急性髓系白血病的分期、风险分层和常规治疗临床缓解的可能性。
急性髓系白血病分类分为3个预后组:预后良好、中等和不良(panel 2)。预后良好白血病包括与t(8;21) 和 inv(16) 或t(16;16) 相关的核心结合因子白血病和急性早幼粒细胞白血病 (t[15;17])。伴 NPM1 突变AML(不存在FLT3-ITD)或碱性亮氨酸拉链区框内 CEBPA 突变也对化疗更敏感,目前在更新的欧洲白血病网2022建议中归为预后良好。

在欧洲白血病网络2022建议中,预后不良组还包括另外两种:AML伴MDS相关基因突变(ASXL1、RUNX1、BCOR、EZH2、SF3B1、SRSF2、STAG2、U2AF1和ZRSR2)和细胞遗传学融合t(8;16)(KAT6A::CREBBP)。尽管伴MDS相关基因突变AML多发生于既往血液学疾病(如MDS)之后,但这些突变也可在新发AML中发生,且预后不良。
预后中等患者约占AML患者的40%,通常包括正常二倍体细胞遗传学患者。重要的是,更新的欧洲白血病网2022建议所有FLT3–ITD突变AML均应视为预后中等,而FLT3–ITD等位基因比率或是否存在NPM1 突变都不影响风险分层。这些更新是因为FLT3抑制剂治疗FLT3–ITD和 NPM1 野生型患者的结局改善,以及NPM1 MRD 越来越成为FLT3–ITD和 NPM1 共突变患者预后的主要决定因素。
克隆性造血
在没有血液系统恶性肿瘤的健康人中出现常见的MDS和AML相关突变,以扩增克隆(定义为变异等位基因分数VAF≥2%)的形式,称为克隆性造血,也称为不确定潜能的克隆性造血 (CHIP) 或年龄相关的克隆性造血 (ARCH)。这种所谓的癌前状态的发生率广泛存在,且在既往癌症患者中随年龄增长而增加。>65岁人中大约10%具有克隆性造血,最常见的克隆性造血相关突变发生于参与表观遗传调控 (DNMT3A、TET2、ASXL1)、剪接 (SF3B1、SRSF2)、DNA损伤修复 (TP53、PPM1D) 和 JAK2基因中。
克隆性造血在许多方面类似于意义不明的单克隆丙种球蛋白病(多发性骨髓瘤的前体),与血液肿瘤和全因死亡风险增加相关,后者主要与心血管疾病相关,估计冠心病风险增加2倍。白血病转化的发生率可能取决于特定的突变和克隆的大小,并进一步受到宿主因素的影响,如胚系风险等位基因和骨髓微环境,但这些因素目前还知之甚少。
目前还没有循证指南或共识标准,但克隆性造血功能的管理和随访通常包括基线骨髓检查以评估隐匿性血液恶性肿瘤,每3-6个月进行常规血液检查评估,以及在外周血细胞计数发生任何变化时重复骨髓评估。
遗传性白血病倾向
与实体瘤相关的遗传性肿瘤综合征早已得到认可,如与胚系 BRCA1 或 BRCA2 突变相关的乳腺癌和卵巢癌综合征、家族性结直肠癌综合征(如 Lynch 综合征或家族性腺瘤病性息肉病)和多发性内分泌肿瘤综合征等;最近发现遗传性血液学恶性肿瘤综合征的发生率相似,估计约为MDS和AML的5-10%。最常见的胚系易感综合征及其相关特征请参考本文附录,已知和新发疾病的综合列表详见更新的欧洲白血病网2022 指南。
对于很多患者,长期血细胞减少、频繁非典型感染或免疫缺陷、既往恶性肿瘤或各种先天性异常的个人史应怀疑遗传性肿瘤综合征,此外还应考虑血液恶性肿瘤的家族史。年龄较大不应排除基因检测,因为目前认为胚系 DDX41 突变是最常见的遗传性血液恶性肿瘤综合征,与老年时(中位年龄69岁)发生MDS和AML相关,这与一般人群中的风险有所重叠。
活动性血液恶性肿瘤患者应仔细进行胚系基因检测,因为在活动性恶性肿瘤期间外周血不能用于胚系检测(因为无法获知突变是胚系还是体细胞来源)。对于确定胚系异常的存在,从皮肤穿刺活检中生长的培养成纤维细胞是金标准。如果变异的VAF大于40%,或通过临床缓解未改善,则应将遗传性白血病易感相关的遗传变异视为胚系。因此对于可检测的特定患者,缓解期间重复检测可能有助于区分体细胞和胚系变异。此外,缓解期间的分子二代测序在评估无替代性分子标志物患者的 MRD 方面具有新的作用。
遗传性血液系统恶性肿瘤的识别可能影响患者管理,特别是如果患者是异基因干细胞移植候选者,预处理方案强度和最佳供者选择都可能受到遗传性血液系统恶性肿瘤的影响。如果已在患者中发现遗传性血液恶性肿瘤,应检测潜在的相关供者,并应优先考虑无遗传性血液恶性肿瘤的供者,原因在于移植物衰竭和供者来源的白血病与具有遗传性血液恶性肿瘤倾向的供者相关。

AML的目标是通过获得缓解来提高生存率,完全缓解定义为骨髓原始细胞低于5%,清除所有外周原始细胞或髓外疾病,以及骨髓充分重建(中性粒细胞绝对计数大于1000/μL,血小板计数大于100000/μL)和非输血依赖。应该注意的是,达到完全缓解现在可以考虑计数在下一个治疗周期前恢复。此外,欧洲白血病网2022建议正式认可完全缓解伴中性粒细胞≥500/μL且血小板≥50000/μL的部分血液学恢复 (CRh) 作为临床缓解指标,作为其他较低缓解标准的补充,如完全缓解伴中性粒细胞或血小板不完全恢复 (CRi)、部分缓解和形态学无白血病状态(Panel 3)。最近有一项评估低强度治疗的研究将 CRh 作为临床缓解的替代指标,以更好地反映中性粒细胞和血小板的充分恢复。术语 CRh 已纳入修订版欧洲白血病网2022建议中作为缓解终点,但还需要进一步研究来证实 CRh 是总生存期的替代指标。


尽管获得完全缓解、CRh或 CRi 与生存期改善相关,但如果缓解后治疗不充分,标准形态学评估未检测到的残留白血病细胞仍可能导致治疗失败;而MRD分析可检测低至1×10–4至1×10–6灵敏度的残留AML细胞,从而增加了任何特定时间点的缓解深度信息。
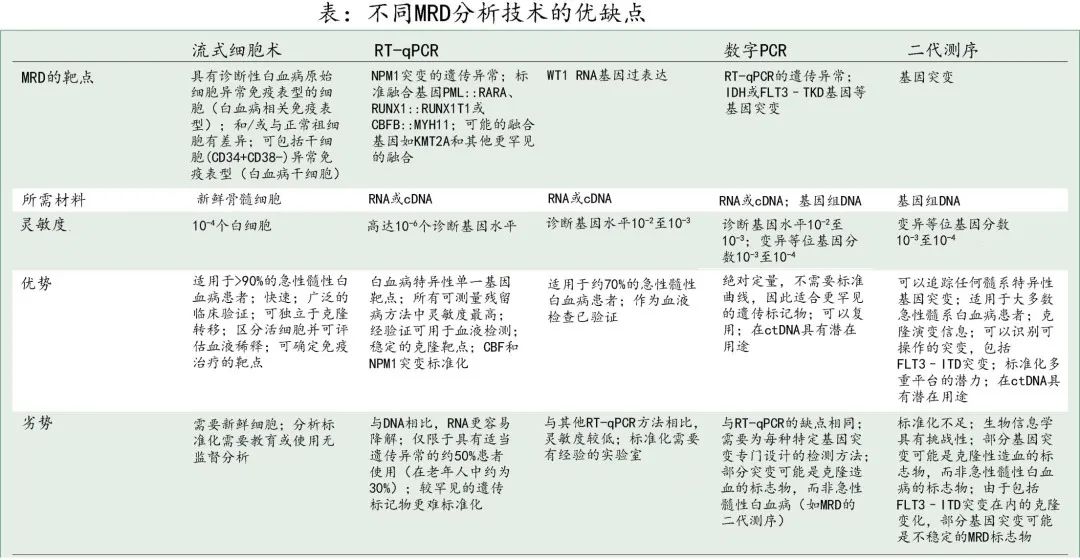
根据现行指南,MRD阴性的标准定义取决于MRD技术的类型和靶点(即细胞或 DNA VAF或 RNA 比率),但MRD检测阈值至少应为1×10–3个细胞。经过2个周期的标准强化化疗后,近2/3的完全缓解患者经流式细胞术检测为 MRD 阴性,其复发或死亡的风险显著降低(一项META分析纳入10000例以上患者数据,生存风险比为0.36)。但MRD阴性并不意味着AML细胞根除,应基于特定检测和样本的限制解释 MRD 结果(详见下表)。一般而言,中心实验室框架有助于 MRD 分析的验证和标准化。
基于到 MRD 的重要性,MRD评估已纳入缓解评估中,当前的欧洲白血病网分类专门描述了完全缓解、CRi和CRh伴无残留MRD(CRMRD-、CRi MRD-和CRh MRD-),作为完全缓解的新指标。在强化化疗后和低强度治疗后,均已通过标准化检测确定了 MRD 阴性在形态学缓解中的预后价值。
根据不同技术的相对优势、MRD 靶点以及实时临床检测当前的适用性,欧洲白血病网进一步推荐了一种通过 MRD 检测体系管理个体患者的算法。例如对于融合基因(如核心结合因子白血病)的 MRD 监测,应优先进行RT-PCR;流式细胞术和实时定量 PCR (rt-qPCR)MRD 分析法可监测所有AML亚型,通过二代测序进行分子MRD监测具有额外价值,尤其是可检出靶向突变如FLT3-ITD。
作为MRD阴性缓解的临床重要性日益得到认可的案例,最近的一项临床试验 (NCT05020665) 入组了新诊断NPM1 突变AML患者,将通过 RT-PCR 评估 NPM1 MRD并作为主要研究终点。但应该注意的是,在完成化疗后低水平 NPM1 突变 MRD 的持续存在,未接受额外治疗的患者中有大约40%可能天生无法检测。

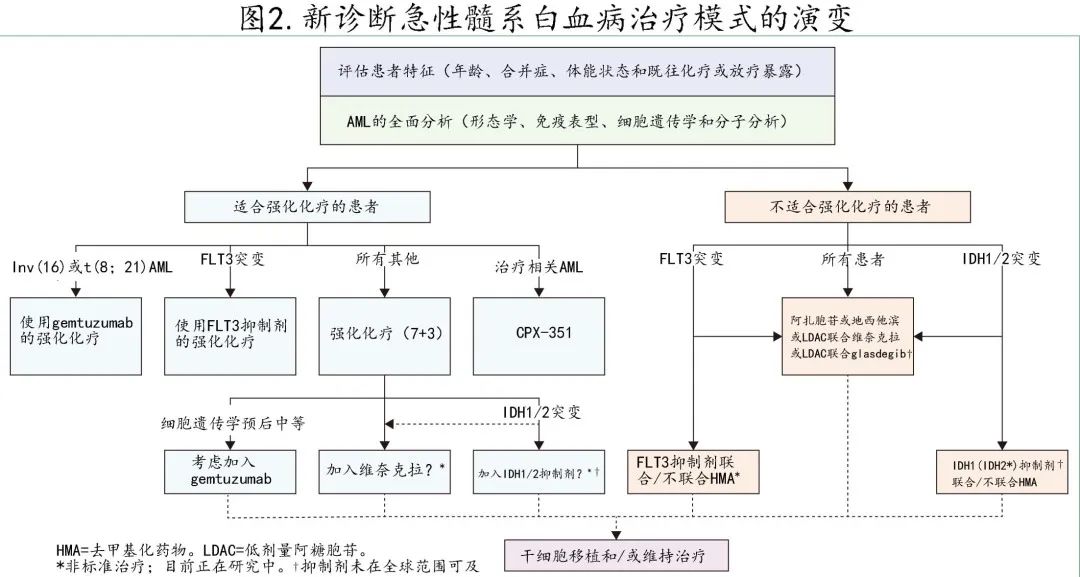
急性髓性白血病的初始治疗决策需要评估fitness(图2),因为不建议将包括阿糖胞苷和蒽环类药物的标准强化治疗方案(即7+3方案)用于高龄(>75岁)、体能状态较差或潜在器官功能障碍患者(发病率和早期死亡率增加)。
尽管尚无公认的用于定义强化急性髓系白血病治疗fitness的单一金标准评估工具,但在临床试验中使用了 Ferrara 标准可区分适合或不适合标准强化化疗的患者(Panel 4)。

诱导方案
急性髓性白血病的强化治疗以治愈为目的,治疗概念包括诱导(以形态学缓解为目标)以及缓解后的巩固治疗(减少或消除残留疾病)。最常见的强化化疗方案仍是7+3方案,包括阿糖胞苷(100-200 mg/m²/天,连续输注7天)和蒽环类药物(伊达比星或柔红霉素)连续给药3天。巩固治疗可包括中剂量或高剂量阿糖胞苷为主的巩固治疗(欧洲白血病网2022 指南推荐3至4个周期的阿糖胞苷1000–1500 mg/m²静脉输注3 h,每 12 h 一次,持续3天,如果> 60岁则为500–1000 mg/m²静脉输注3 h q12,持续3天)、异基因造血干细胞移植 (HSCT) 和维持治疗。HSCT 的决策在很大程度上应基于风险-获益评估,同时考虑估计的复发风险以及与移植相关的发病和死亡风险,通常建议将其用于获得缓解的存在不良风险患者,以及更个体化的用于存在预后中等的患者。缓解期 MRD持续存在(即使是在预后良好的AML患者中)是复发风险的决定因素,有指南建议在经过验证的时间点考虑HSCT。
在过去十年中,强化AML化疗领域发生了多项改变实践的改善,强调了快速获得细胞遗传学和分子特征对于及时开始最佳治疗的重要性。约30%的AML患者携带 FLT3-ITD 或 FLT3-TKD 突变,III 期 RATIFY 研究在7+3诱导和大剂量阿糖胞苷巩固治疗的基础上加用多激酶抑制剂midostaurin可改善长期生存率,midostaurin组的4年总生存率为51%,而安慰剂组为44%,导致2017年midostaurin联合常规化疗的获批。目前正在评估更强效的二代 FLT3 抑制剂,选择性FLT3–ITD抑制剂quizartinib联合强化化疗与单独强化7+ 3化疗相比,完全缓解和总生存期均显著改善。对于20%的 IDH1 或 IDH2 突变患者,正在开展一项标准诱导加靶向 IDH1 抑制剂 (艾伏尼布) 或靶向 IDH2 抑制剂 (enasidenib),随后进行 HSCT 或 IDH 抑制剂维持治疗的安慰剂对照、随机、一线临床试验 (NCT03839771)。
对于新诊断治疗相关AML,或AML伴MDS或慢性粒单核细胞白血病既往史,或存在MDS相关细胞遗传学的患者,推荐使用柔红霉素的阿糖胞苷协同包封的双药脂质体制剂CPX-351。基于随机3期研究的结果显示,在60-75岁的患者中,与标准7+3化疗相比,CPX-351可改善缓解率并延长总生存期。重要的是,CPX-351治疗后转为 HSCT 的患者具有特别优秀的结局,3年估计总生存率为58%,而该高危AML人群随机分配至7+3组的扩展随访分析为29%。值得强调的是,尽管柔红霉素和阿糖胞苷的总累积剂量均较低,但 CPX-351 可改善结局,因此支持该假设:固定摩尔比和脂质体制剂可改善抗白血病活性。
此外,gemtuzumab ozogamicin(连接calicheamicin warhead的 CD33 单克隆抗体)于2017年再次获批,可单独或联合常规化疗联合表达 CD33 的AML患者。法国 ALFA 研究的结果显示,分次给予较低剂量的gemtuzumab ozogamicin联合标准一线化疗可安全递送更高累积剂量的gemtuzumab ozogamicin,从而改善无事件和总生存期。此外,Hills等随后的META分析证实,预后良好的核心结合因子白血病患者(即t[8;21] 或inv[16])加用gemtuzumab ozogamicin具有显著生存获益:加用gemtuzumab ozogamicin后5年总生存率从55%改善至78%,改善超过20%。相比之下,在预后中等细胞遗传学患者中观察到统计学显著但适度的5年总生存期获益(未使用gemtuzumab ozogamicin时的5年总生存率为36%,使用时为41%);而在预后不良细胞遗传学患者中未观察到获益(5年总生存率分别为8% vs 9%)。gemtuzumab ozogamicin一般在诱导周期的第1、4和7天以及巩固周期的第1天以3 mg/m²的剂量给药。
造血干细胞移植和维持治疗
即使在初始诱导或巩固治疗后获得完全缓解,复发也很常见,大多数诊断为AML的患者将最终死于该疾病。有助于改善无复发生存期的强化方法包括异基因 HSCT 和维持治疗。
一般而言,对于估计复发风险超过35%的患者(包括预后不良的患者,以及其他欧洲白血病网风险类别(尤其是持续存在MRD)),建议进行异基因HSCT。由于移植前存在持续 MRD 与不良结局相关,因此MRD患者转至干细胞移植均须考虑清髓性预处理方案、早期逐渐减少免疫抑制和干细胞移植后维持治疗的临床试验。值得关注的是,移植前 MRD 阳性患者估计死亡风险还取决于AML亚型(FLT3–ITD突变AML的4年总生存率<30%,但核心结合因子AML的4年总生存率>60%)、处于首次还是第二次完全缓解以及残留 MRD 的程度。
没有足够数据支持在移植前进一步化疗(或替代化疗)可减少MRD。目前NCRI-AML18 研究 (NCT02272478) 正在评估fit老年患者接受 MRD 驱动化疗强化治疗的获益:在第1个诱导疗程后达到MRD+缓解的患者随机接受标准再诱导(7+3或CPX-351)或第2个强化疗程治疗。
对于不适合异基因 HSCT 的患者,维持治疗具有预防复发和改善患者总生存期的明确获益。一项欧洲老年患者的对比研究中,两个周期强化诱导治疗后首次完全缓解的患者(未进一步巩固治疗)随机接受阿扎胞苷皮下给药与无治疗,结果随机接受阿扎胞苷治疗的患者无病生存期改善但无总生存期获益。随机和安慰剂对照的 QUAZAR 研究表明,在≥55岁的标准诱导或巩固治疗后患者中,与安慰剂相比,阿扎胞苷口服制剂 (CC-486,每28天为1周期,给药14天)维持治疗可改善无复发生存期和中位总生存期(中位总生存期 25 vs 15 个月;p<0.001)(包括维持治疗前MRD阳性的患者)。目前尚未确定维持治疗的最佳持续时间,但口服制剂可使相当大比例的患者继续维持治疗超过2-3年,这也是大多数AML复发的时间范围。
低强度急性髓系白血病治疗
不适合强化化疗的新诊断AML患者的标准治疗发生了改变实践的变化,这是最有影响力的更新。对于该人群,既往标准治疗包括去甲基化药物(即阿扎胞苷或地西他滨)或低剂量阿糖胞苷的姑息治疗,仅少数患者治疗有效,中位生存期不足1年。而阿扎胞苷联合和不联合维奈克拉的随机安慰剂对照3期研究 (VIALE-A) 显示缓解率和生存率均显著改善,66%(vs 28%)的患者达到复合缓解率 (CR+CRi),中位总生存期改善则至14.7个月(vs 9.6个月)。与去甲基化药物单药相比,去甲基化药物联合维奈克拉的血细胞减少和血细胞减少相关并发症(如中性粒细胞减少性发热)更常见,尤其是在前1-2个周期;支持性治疗指南包括推荐的维奈克拉剂量调整,有助于减轻该方案的强骨髓抑制和 CYP3A4 相互作用。
VIALE-A 研究的相关分析显示,通过流式细胞术达到 MRD 阴性状态的治疗缓解患者,具有特别优秀的缓解持续时间和总生存期,12个月持续缓解率和总生存率估计值分别为81%和94%。基线基因组学也可预测缓解持续时间,携带 NPM1 或IDH2(或两者)突变的患者对维奈克拉特别敏感且与持续缓解相关,而信号传导突变(即FLT3–ITD、KRAS、NRAS、PTPN11)和 TP53 突变可预测继发性耐药和总生存期更短。
3期随机安慰剂对照 AGILE 研究显示,对于新诊断患者中约8%的IDH1突变患者,阿扎胞苷联合艾伏尼布与阿扎胞苷单药相比,缓解率(完全缓解或CRh:53% vs 18%)、无事件生存期和中位总生存期(24 vs 8个月)均改善。并且该联合方案较少发生血细胞减少和血细胞减少相关并发症,其值得注意的不良事件包括艾伏尼布相关的异柠檬酸脱氢酶 (IDH) 相关分化综合征(14%)和 QTc 间期延长(从心室开始收缩至舒张的时间)(10%)。对于过于虚弱而无法耐受去甲基化药物为基础的治疗的患者,IDH1抑制剂艾伏尼布单药治疗也已在FDA获批用于新诊断的 IDH1 突变AML。
其他联合方案已获批用于不适合强化化疗的患者,即使用低剂量阿糖胞苷为基础治疗。在既往接受过去甲基化药物治疗的患者或去甲基化药物给药在后勤或医学上具有挑战性的患者(例如肾衰竭)中,可考虑基于低剂量阿糖胞苷的治疗。与低剂量阿糖胞苷单药治疗相比,低剂量阿糖胞苷联合维奈克拉(VIALE-C研究)和低剂量阿糖胞苷联合 hedgehog 抑制剂 glasdegib 均显示缓解和生存期改善,应考虑用于计划接受低剂量阿糖胞苷为基础治疗的患者。
髓外病变
髓外病变最好应归类为在非造血组织中识别出白血病聚集物,从而导致正常组织结构变形;它也(错误地)被称为髓系肉瘤或粒细胞肉瘤。大约2%的初诊患者会出现髓外病变,其中绝大多数同时合并骨髓病变,并常出现单核或单核细胞分化。复发患者中髓外病变的发生率显著增加,约20%的 HSCT 后复发患者发生髓外病变。髓外病变患者的结局主要与AML的细胞遗传学和分子特征相关,而髓外病变本身似乎与较差的生存期无关。其治疗通常推荐标准的全身治疗;髓外白血病通常对电离辐射很敏感,可考虑采用放射治疗进行快速局部控制或用于全身治疗后的持续性髓外病变。
复发或难治性急性髓系白血病的治疗
大多数AML患者会复发,而复发或难治性AML的治疗仍是相当大的挑战。多数复发发生于第一年内且随时间下降,接受强化治疗后第4年和第5年的复发风险低于10%。一般而言,对阿糖胞苷为基础标准再诱导或挽救治疗方案(即FLAG-IDA、MEC和HIDAC)有反应的患者属于少数预后良好、首次缓解持续时间较长(≥12个月)且既往未接受异基因干细胞治疗的患者。对于既往未接受维奈克拉的患者,FLAG-IDA联合维奈克拉可作为挽救治疗时一种强化治疗方案,具有较高的流式细胞术 MRD 阴性完全缓解率,并可成功转为异基因干细胞治疗。
除强化挽救治疗外,获批上市的多种口服靶向治疗也改善了结局,因此在复发时和每个新治疗时间点进行分子学再评估,对于确定患者是否应接受FLT3、IDH1或 IDH2 靶向治疗至关重要。已知 FLT3 突变在AML治疗过程中的稳定性特别易变:既往 FLT3 野生型患者中高达20%的患者可识别出新的 FLT3 突变,而诊断时FLT3 突变患者可发生FLT3 阴性克隆复发,尤其是使用含 FLT3 的方案进行有效治疗后高达40%。尽管 IDH1 和 IDH2 突变通常是早期克隆事件,且一般认为随时间推移较稳定,但也有报告高达10-15%的患者发生获得性 IDH1 或 IDH2 突变,尤其是在MDS或骨髓增殖性肿瘤转化为AML时。
对于携带FLT3–ITD或FLT3–TKD突变的急性髓系白血病患者,口服小分子激酶抑制剂吉瑞替尼已获批上市,根据 III 期随机 ADMIRAL 研究,与研究者选择的挽救治疗相比,吉瑞替尼的完全缓解率(21% vs 10.5%)、复合缓解率(54% vs 25%)和总生存期(9.3个月vs 5.6个月)均有改善;此外吉瑞替尼组更多患者能够成功接受HSCT (25·5% vs 15%)。值得注意的是,小分子FLT3–ITD抑制剂quizartinib的随机 III 期研究也显示,FLT3–ITD突变复发或难治性AML患者的生存期在统计学上显著改善(6.2个月vs 4.7个月),但quizartinib仅在日本获批用于治疗复发性或难治性FLT3–ITD突变患者。
约20%的AML患者携带 IDH1 或 IDH2 突变,约8%携带 IDH1 突变,12%携带 IDH2 突变。对于 IDH 突变的复发性或难治性AML,IDH1抑制剂艾伏尼布或 IDH2 抑制剂enasidenib(仅美国)分别被批准作为单药治疗,其依据是单臂研究显示约30%的患者出现复合缓解,以及约40%的总缓解率包括血液学改善。一项3期非盲随机研究显示,enasidenib可改善缓解率(CRi 30% vs 6%)和非输血依赖率,但总生存期的主要终点不显著且与医生选择的挽救治疗重叠(两组均为6个月);但该总生存期终点可能受到早期治疗中止和使用替代治疗的混淆,后者在对照组中的发生频率更高。事后亚组分析表明,enasidenib在IDH2–R172变异患者中具有特别疗效。
尽管去甲基化药物联合维奈克拉方案目前仅获批用于不适合强化化疗患者的一线治疗,但这些方案在复发患者中也显示出疗效,多用于强化化疗后复发的患者。在一项包含55例复发性或难治性AML患者的单臂研究中,患者既往接受过中位2种治疗,地西他滨联合维奈克拉治疗10天后的 CRi率为42%,另外18%的患者达到形态学无白血病状态。维奈克拉敏感性基因组学(即二倍体细胞遗传学和 NPM1 和 IDH2 突变)也与挽救治疗的缓解率相关。
正在进行的新型治疗研究对于继续改善AML结局至关重要。目前正在探索的几类新型治疗初步数据令人鼓舞,NPM1突变或 KMT2A 重排患者中 menin 抑制剂的早期结果尤其好,通过分化和非细胞毒性机制,患者可对单药治疗产生 MRD 阴性完全缓解。CD47-SIRPα巨噬细胞检查点抑制剂联合阿扎胞苷也显示对新诊断AML和MDS患者的初步反应,且在 TP53 突变中具有良好的生存结局。
免疫疗法(如双特异性 T 细胞衔接抗体、CAR-T 或NK细胞疗法或检查点抑制剂)的研究正在进行中,在最小疾病负荷(如 MRD阳性缓解或早期挽救治疗)患者中可能最有效,最近的几项临床试验正在对此类患者进行评估。T 细胞免疫治疗AML的靶点包括CD33、CD123、CLL-1和CD70,但这些靶点仍存在相当大的挑战,如原始细胞表达的可变性和预期的毒性。对于不适合强化化疗的新诊断患者以及复发或难治性但未接受过维奈克拉治疗的患者,包括去甲基化药物、维奈克拉联合第三种药物的三联疗法在临床试验设计中会越来越常见。
重要的是,进行中的随机研究正在解决一个越来越有意义的问题,那就是在接受异基因 HSCT 的老年fit患者中,对比标准细胞毒性化疗(如7+3或CPX-351)和低强度维奈克拉联合方案。回顾性真实世界数据表明,CPX-351对比去甲基化药物联合维奈克拉作为一线治疗(移植或不移植),其结局有所重叠;此外10天地西他滨对比7+3的 EORTC 随机研究显示,4年总生存率相似 (26% vs 30%)且总体移植成功率相似(两组均>50%)。正如可能预期的那样,在 EORTC 研究中接受治疗的>70岁患者接受地西他滨治疗后生存期改善,而<65岁或 NPM1 突变患者接受7+3治疗后生存期改善。这些研究提示,除了fitness,评估对标准强化化疗的预期敏感性也可适用于确定AML治疗强度。
最后,鉴于AML重要的分子和基因组亚分类,以及越来越多可用的试验性靶向治疗,未来的临床试验也必须适应不断变化的治疗格局。涉及多个生物标志物驱动臂的创新平台设计和基于精确度的倡议(initiative)也越来越重要,例如 BEAT 急性髓性白血病研究和国家癌症研究所 MyeloMATCH 倡议,旨在实现一个伞型方案(umbrella protocol)内研究多种治疗。
参考文献
Courtney D DiNardo,et al. Acute myeloid leukaemia.Lancet.2023 Apr 14;S0140-6736(23)00108-3. doi: 10.1016/S0140-6736(23)00108-3.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言