【Am J Hematol】2024更新:大B细胞淋巴瘤的风险分层和治疗进展
2023-09-06 聊聊血液 聊聊血液 发表于上海
《American Journal of Hematology》近日发表一篇综述,描述了DLBCL的分类、风险分层和治疗,重点介绍了该领域的最新进展。现翻译全文供参考。
大B细胞淋巴瘤
新诊断弥漫性大B细胞淋巴瘤(DLBCL)的标准方案为R-CHOP。虽然50%-60%的患者可通过该方案治愈,但有10%-15%的患者出现原发难治性疾病,30%-40%的患者在诊断后的前2年内复发。直到最近,复发/难治性DLBCL (R/R)的唯一治愈性选择仍是挽救性化疗和造血细胞移植(HCT)。
《American Journal of Hematology》近日发表一篇综述,描述了DLBCL的分类、风险分层和治疗,重点介绍了该领域的最新进展。现翻译全文供参考。

遗传学和分子学分类
免疫组化(IHC)和荧光原位杂交(FISH)是对DLBCL进行分类的常规方法,基于细胞起源、MYC和BCL2/BCL6重排以及MYC/BCL2/ BCL6表达。这些分类有助于识别高危疾病和对标准R-CHOP反应较差的患者,但无法解释对治疗的异质反应的全部问题。
细胞起源
基于细胞起源(cell of origin, COO), DLBCL可分为三种不同的亚型。生发中心B细胞样(GCB) DLBCL来源于正常生发中心B细胞,其特征为CD10表达和BCL2重排(例如t(14;18)引起的IGH::BCL2融合);活化中心B细胞样(ABC) DLBCL来源于生发后B细胞,其特征为B细胞受体依赖、构成性NF-κB激活和IRF4/MUM1表达;“无法分类型DLBCL”不属于GCB或ABC。在三种亚型中,ABC亚型与R-CHOP后的低生存率相关。
虽然COO是通过Affymetrix微阵列的基因表达谱(GEP)发现的,但由于需要新鲜或新鲜冷冻组织,该方法的适用性受到限制。Hans算法是IHC开发的一种更实用的COO评估方法,也是临床实践中最常用的分析COO的方法。Lymph2Cx是一种新颖的平台,可以在福尔马林固定、石蜡包埋(FFPE)组织上进行数字GEP。经Affymetrix鉴定,其与GEP具有显著的一致性,因此它在预测患者预后方面优于IHC,并在与IHC结合时显示出更大的潜力。但其使用目前仅限于研究目的,很少有真实世界的报道。
双打击/三打击淋巴瘤
根据2017年WHO的分类,根据MYC和BCL2和/或BCL6重排定义了一种更具侵袭性的DLBCL亚型,即双打击或三打击淋巴瘤(DHL/THL)。然而根据2022年WHO分类(WHO-HAEM5)和国际共识分类(ICC),MYC/BCL6不再归类为BCL2重排性疾病(MYC/BCL2和MYC/BCL2/BCL6)。WHO-HAEM5将MYC/BCL6分类为DLBCL,NOS,将MYC/BCL2(包括THL)分类为“DLBCL/HGBCL-MYC/BCL2”,而ICC将MYC和BCL2/6分类为高级别B细胞淋巴瘤(HGBCL),并将MYC/BCL6与HGBCL,NOS和MYC/BCL2区分开来。
对220例患者进行的一项回顾性分析评估了新的WHO和ICC分类方案的预后意义,结果显示MYC/BCL6患者的总生存期(OS)(未达到[NR] vs. 15个月,p=0.005)和至下次治疗时间(TTNT) (NR vs. 7个月,p=0.0065)优于MYC/BCL2重排和THL。此外,治疗强化与MYC/BCL2和THL的TTNT和OS改善相关,而MYC/BCL6 DLBCL没有改善。还需要进一步的研究来确定高强度治疗是否应仅限于MYC/BCL2患者。
双表达淋巴瘤
双表达淋巴瘤(DEL,通过IHC)共表达MYC(≥40%)和BCL2 (>50%),但不同时携带MYC和BCL2重排。DEL占新发病例的20%-35%,并与更具侵袭性的表型相关。据报道,采用R-CHOP治疗的DEL患者的5年OS仅30%,但该不良结果尚未得到一致。在R/R DLBCL中,DEL的存在也与挽救性化疗和自体干细胞移植(ASCT)的预后较差有关。与“DHL/THL”相比,该免疫表型虽然与非DEL DLBCL相比预后更差,但目前似乎并未从化疗强化中获益。此外,DHL/THL在GCB亚型中富集,DEL在ABC亚型中富集。
其他分子学亚型
DLBCL是一种异质性疾病,至少有150个遗传驱动因素。RNA测序已揭示104个基因的双击标记(DHITsig),可识别GCB患者中的高危DLBCL,这些高危患者中只有一半携带MYC/BCL2重排;但没有MYC/BCL2的高危患者中75%存在隐性重排(cryptic rearrangements),可导致MYC失调,而这是FISH无法检测到的。
为了解ABC和GCB疾病的遗传复杂性,Chapuy及其同事对304例新诊断DLBCL进行了全外显子组测序,并确定了5个不同的cluster (C1-C5)。C2为与ABC/GCB无关的亚组,C3和C4区分高危和低危GCB, C1和C5区分低危和高危ABC。只有4%的病例缺乏明确的遗传驱动因素(“clusters 0”)。然而该分类方案尚未得到前瞻性的验证。
为研究COO无法分类的患者的疾病生物学,Schmitz等人对574例DLBCL进行了DNA拷贝数分析、全外显子组、转录组和深度测序,确定了4个不同的cluster (N1、MCD、BN2、EZB)。该研究的结果在一定程度上被LymphGene复制,并统一了两种分类方案;然而LymphGene只能对59.4%的病例进行分类。因此,虽然这些分类方案已经阐明了DLBCL的分子学亚型,但迄今为止还没有一个纳入临床实践。不幸的是,常规学术实践中使用二代测序panel 进行cluster还无法提供除预测外的临床有意义的信息;目前正在开发多种检测方法来解决这些限制。
风险分层
IPI和CNS IPI常用于预测DLBCL的预后和中枢神经系统复发风险。IPI评分与3年OS的相关性分别为91%、81%、65%和59%,CNS IPI预测中枢神经系统2年复发风险分别为0.6%、3.4%和10.2%。这些评分还存在更多变化,如NCCN-IPI。基于人工智能(AI)的方法评估各种PET/CT参数(包括总代谢肿瘤体积,TMTV)正在研究中,以改进肿瘤影像学数据的风险分层。例如基于人工智能的TMTV可改善IPI的风险分层,独立于IPI识别高危人群,并识别2年CNS复发率为17.1%的高危患者(相对于使用CNS IPI的8.9%)。
ctDNA
ctDNA是肿瘤细胞凋亡释放到外周血中的游离DNA,在92%-98%的大B细胞淋巴瘤(LBCL)患者中可检测到,可提供一种非侵入性的方法来预测患者、跟踪治疗反应、并确定疾病复发,而不考虑治疗方式和治疗线。目前存在多种ctDNA分析方法,包括CAPP-Seq靶向测序和克隆免疫球蛋白检测。
在2个R-EPOCH周期后,ctDNA与5年至进展时间(TTP)和OS相关(可检测ctDNA vs无法检测ctDNA:TTP为42% vs 80%,OS为65% vs 83%)。早期和主要分子学反应似乎可以预测24个月无事件生存(EFS)和OS,在一线和挽救环境中独立于IPI。此外,ctDNA似乎可以有效预测无进展生存期(PFS)和OS:维泊妥珠单抗、利妥昔单抗、环磷酰胺、阿霉素和泼尼松(Pola-R-CHP) (PFS HR=3.0;OS HR=2.7),axicabtagene ciloleucel(中位PFS 3个月vs. NR,中位OS 19个月vs. NR, p=0.008)和ASCT(无法检测和可检测ctDNA ;5年PFS和OS:52% vs. 13%和68% vs. 52%) 。
ctDNA也可以有效地识别复发风险高的患者。在126例接受R-EPOCH治疗的患者中,经过2个周期治疗后,可检测ctDNA的患者中有63%发展为进展性疾病,而无法检测ctDNA的患者只有20%。在CAR-T中也有类似的观察结果,在axicabtagene ciloleucel治疗的第28天,可检测ctDNA和无法检测ctDNA的患者中,分别有83%和17%的患者在中位随访237天时出现疾病进展。
ctDNA也可以为一线免疫化疗和ASCT后的监测提供信息。在一项对107例R-EPOCH后达到CR的患者开展的研究中,所有在监测期间出现重现性ctDNA阳性的患者均出现疾病进展,早期和晚期复发患者的中位提前期分别为1.6个月7.4个月;监测期间可检测ctDNA的患者发生临床进展的风险是无法检测ctDNA的患者的228倍(p<0.0001)。另一项研究中相似,在ASCT后重现性ctDNA阳性的患者中91%复发,中位提前期为62天。
总的来说,ctDNA在追踪治疗反应和识别疾病复发方面似乎比影像学更有优势,但尚不清楚这种优势是否能产生有临床意义的获益。此外,实验室之间缺乏液体活检技术的标准化和协调,当下也阻碍了ctDNA的广泛实施。有关ctDNA在DLBCL中的更详细讨论,参见Lauer EM, Mutter J, Scherer F. Circulating tumor DNA in B-cell lymphoma:technical advances, clinical applications, and perspectivesfor translational research. Leukemia. 2022;36(9):2151-2164.。
一线治疗
根据FLYER、S1001和ECOG 1484在局限期疾病中的研究结果,R-CHOP仍是初治DLBCL的主要治疗方法,而放疗的周期和使用取决于分期和肿瘤体积。该方法可在60%的患者中实现持久缓解。加强R-CHOP强度的努力大多疗效有限。近二十年来,一线中最大的进展为确定强化治疗DHL/THL患者的临床益处,使用的方案包括DA-EPOCH-R、R-CODOX-M/IVAC和R-HyperCVAD。维泊妥珠单抗现在已被批准与R-CHP和各种药物联合使用,并且正在一线中评估联合使用(图1)。
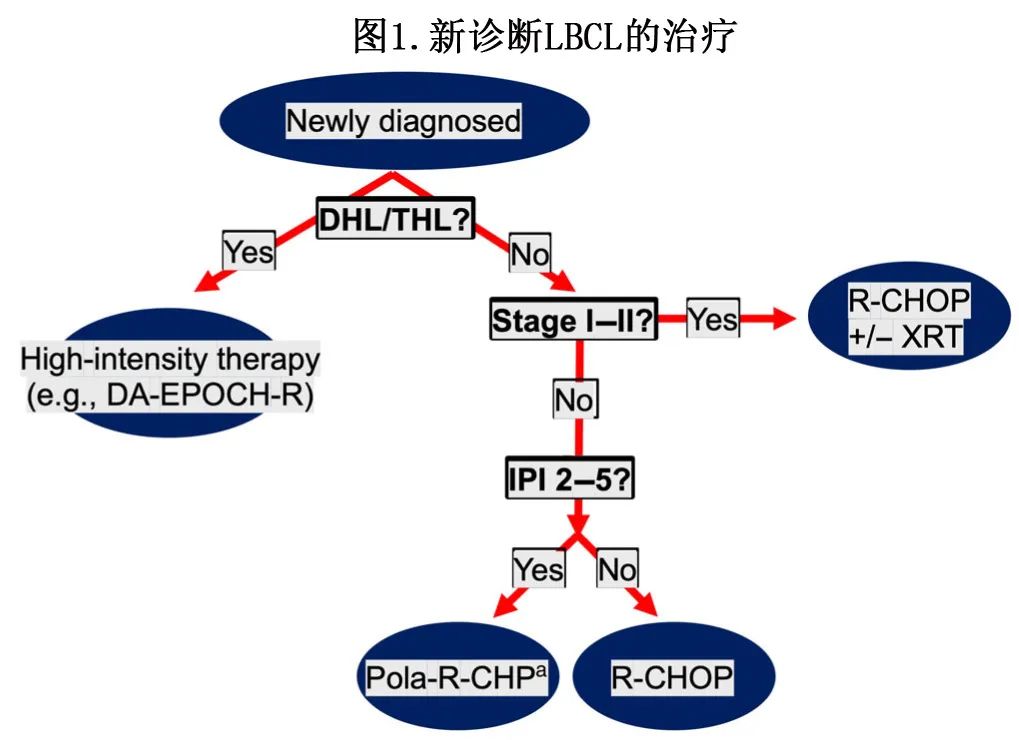
抗体-药物偶联物
维泊妥珠单抗(Polatuzumab vedotin)是一种抗体-药物偶联物(ADC),与R-CHP (Pola-R-CHP)联合使用安全有效。在Ib-II期临床试验中,Pola-R-CHP的ORR和CR分别为89%和77%。POLARIX III期研究将中、高危患者随机分为Pola-R-CHP和R-CHOP两组,结果显示2年PFS获益为6.5%,且疾病进展、复发和死亡风险均较低;在亚组分析中,>60岁的ABC型DLBCL患者和IPI评分较高(3-5)的患者获益最大。最高的3-4级不良事件为中性粒细胞减少(28.3% vs. 30.8%,Pola-R-CHP vs. R-CHOP)和中性粒细胞减少性发热(13.8% vs. 8%,Pola-R-CHP vs. R-CHOP),未增加3-4级感染的风险;两组的周围神经病变发生率相似。在28个月的随访中未观察到OS获益。
BTK抑制剂
BTK抑制剂可有效阻断BCR依赖性NF-kB激活。伊布替尼已被评估用于non-GCB DLBCL的治疗。伊布替尼+R-CHOP (I-RCHOP)的III期PHOENIX研究未达到其主要PFS终点,但在预先计划的亚组分析中,在<60岁患者中I-RCHOP与更优的36个月EFS、PFS和OS相关;此外还与更频繁的不良事件(如发热性中性粒细胞减少症)有关。肿瘤样本的事后基因表达分析显示,<60岁的DEL、MCD和N1 non-GCB患者的EFS和OS优于其他患者。24例EBV+ DLBCL患者的单臂II期IVORY研究中,与R-CHOP治疗的匹配病例相比,65岁患者的I-RCHOP同样具有更高的CR(87% vs. 69%)。但由于不可接受的毒性,老年患者的临床疗效有限。因此,I-RCHOP可能成为年轻的MCD、N1或DEL DLBCL患者的选择;但还需要前瞻性随机试验来证实这一获益。毒性更低的二代BTK抑制剂正在探索中(NCT04546620, NCT04002947, NCT03571308, NCT04529772)。
蛋白酶体抑制剂
虽然一项I期研究显示硼替佐米联合R-CHOP (RB-CHOP)的疗效有希望,但两项III期研究(PYRAMID和REMoDL-B)在30-34个月的随访中未能显示PFS和OS的改善。然而REMoDL-B的长期随访表明,硼替佐米可为ABC型DLBCL患者提供了显著的PFS和OS获益(5年PFS 69% vs. 54%;5年OS 80% vs 67%),而DHL和DEL具有获益的趋势。因此当使用基因表达谱鉴定时,硼替佐米似乎可为ABC患者提供长期生存获益。
免疫调节剂
来那度胺在DLBCL中的结果不一致。一项纳入64例non-GCB DLBCL患者的随机II期研究显示,来那度胺和R-CHOP (R2CHOP)与R-CHOP相比, 24个月PFS和OS有所改善。两项单臂II期研究也证实了R2CHOP对老年患者的潜在获益。然而两项大型III期RCT(ROBUST和ECOG-ACRIN E1412)显示相互矛盾的结果:E1412显示ORR和CR无差异,但3年PFS和OS获益分别为73% vs. 61% (p=0.03)和83% vs. 75% (p=0.05),而ROBUST研究未显示任何获益。来那度胺给药差异和从诊断到启动治疗的延迟时间(因此可以选择侵袭性较小的疾病)可能是导致结果差异的原因,这与ROBUST研究中IPI 3-5、大包块疾病和晚期患者较少相一致。此外,在82例MYC重排患者的HOVON II期研究中,R2CHOP提供了与其他剂量递增方案相当的2年EFS和OS。因此,R2CHOP在“DHL/THL”患者中仍待评估。
对于R-CHOP缓解患者,来那度胺维持治疗可以改善老年患者的PFS,但未改善OS,并且联合利妥昔单抗和BTKi (RLI)也有前景。在II期SMART研究中,RLI给药2个周期,然后RLI联合标准R-CHOP 共6个周期,获得了令人印象深刻的95%的CR且2年PFS和OS分别为91%和97%;重要的是本研究中62%的患者为DEL。SMART STOP研究目前正在招募,将评估来那度胺、利妥昔单抗、阿可替尼和tafasitamab的无化疗诱导 (NCT04978584)。
CAR-T疗法
CAR-T在高危LBCL患者的一线治疗中显示出希望。在II期ZUMA-12研究中,40例中期PET/CT Deauville评分4-5、DHL/THL或IPI评分≥3分的患者接受了axicabtagene ciloleucel治疗,ORR和CR分别为89%和78%,12个月PFS和OS分别为74.6%和90.6%,中位OS为24.5个月;8%和23%的患者出现≥3级细胞因子释放综合征(CRS)和神经毒性(免疫效应细胞相关神经毒性综合征[ICANS]),所有≥3级毒性均得到缓解,无治疗相关5级事件。III期随机ZUMA-23研究正在积极招募(NCT05605899),将高危患者随机分配到axi-cel(R-CHOP/DA-EPOCH-R桥接)和标准治疗。
双特异性抗体
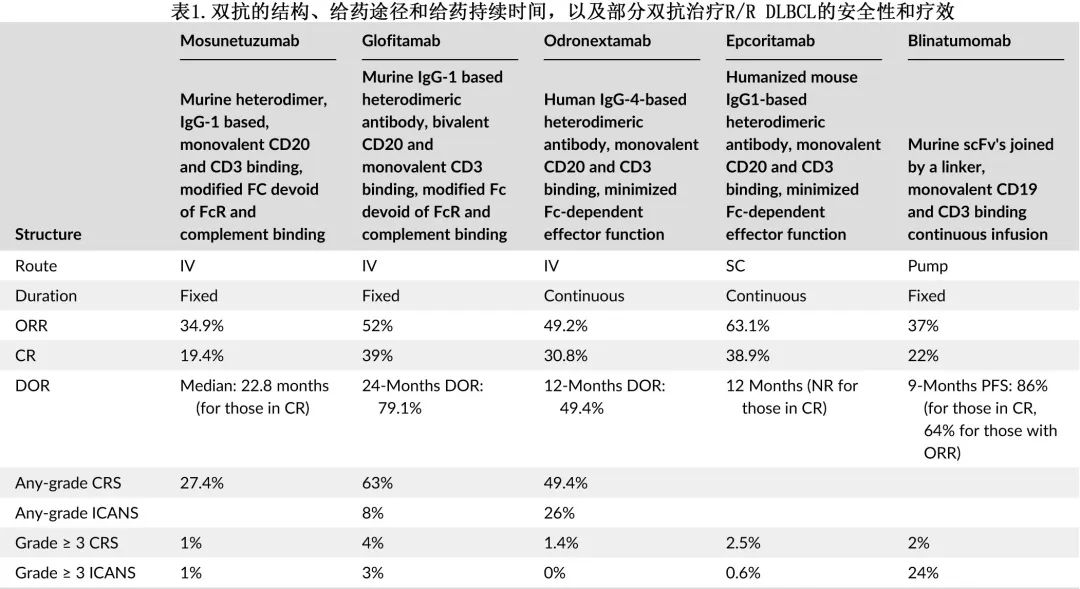
LBCL中的双特异性抗体(bsAb)是一种激活T细胞对抗B细胞的免疫疗法,不需要制造CAR-T系细胞。靶向CD19的贝林妥欧单抗缺乏抗体Fc区,持续给药,而mosunetuzumab、odronexamab、epcoritamab和glofitamab与CD20结合,具有修饰的Fc区域,并且不需持续给药(表1)。Mosunetuzumab、glofitamab和贝林妥欧单抗正在一线中进行研究。
Mosunetuzumab
在一项纳入54例高龄/unfit的高危DLBCL或HGBCL患者的研究中,mosunetuzumab的ORR和CR分别为56%和43%;达到CR的患者中约65%的患者超过12个月仍处于CR状态,中位缓解持续时间(DOR)为35个月。此外所有亚组中均观察到反应,non-GCB和DEL的结局更好。所有CRS事件均为低级别且仅限于第1周期,未报告ICANS。12个月OS为75%,而接受非蒽环类药物治疗的老年/unfit患者的12个月OS为65%;然而与历史对照相比,mosunetuzumab的ORR/CR较低。因此,正在研究mosunetuzumab与其他一线疗法联合治疗和用于巩固治疗(NCT03671018、NCT03677154、NCT03677141)。
Glofitamab
在一项纳入56例新诊断的高疾病负荷DLBCL患者的I期研究中,Glofitamab联合R-CHOP的ORR和CR分别为93.5%和76.1%,且在所有IPI风险组中均有良好反应。最常见的不良事件为中性粒细胞减少和低级别CRS,12%的患者发生中性粒细胞减少性发热,16%的患者发生重度感染。未观察到ICANS,所有CRS事件为1-2级。Glo-R-CHOP与Pola-R-CHP治疗高危患者的Ib/II期COALITION研究正在积极招募(NCT04914741)。
贝林妥欧单抗
在一项II期研究中,28例高危DLBCL (IPI 3-5、DHL/THL和/或DEL)患者接受贝林妥欧单抗巩固治疗,在标准免疫化疗后给予84天/周期输注(输注56天,无治疗间期28天),随后根据研究者判断额外给予28天/周期输注。在一线治疗PR或SD患者中,一个周期的贝林妥欧单抗巩固可获得87.5%的CR。未观察到≥3级CRS事件;10.7%的患者出现3级ICANS,无4-5级ICANS。因此,贝林妥欧单抗可能使一线治疗未能达到CR的高危患者受益;但还需要随机研究来验证,并需要更长的随访时间来确定生存获益。
CD19单克隆抗体
Tafasitamab是一种CD19定向单克隆抗体,对新诊断DLBCL有效。在Ib期First-MIND研究中,66例患者随机分配到R-CHOP联合Tafasitamab联合来那度胺(T/L)或不联合来那度胺(T);ORR分别为93.9%和90.9%,18个月PFS和OS分别为79.9% vs. 66%和93.8% vs. 90.3%。91%和73%的患者(T/L vs. T)发生≥3级治疗相关不良事件,最常见的不良事件两组均为骨髓抑制;发热性中性粒细胞减少症或感染的发生率无差异。R-CHOP联合T/L与R-CHOP联合T和L安慰剂的III期Front-MIND研究正在进行中。
BCL2抑制剂
II期CAVALLI研究比较了口服BCL2抑制剂维奈克拉联合R-CHOP (ven-RCHOP)与匹配的历史R-CHOP对照。在整个队列中ORR与2年PFS获益趋势相似,但BCL2+患者的ORR和2年PFS有获益(ORR: 83% vs. 77;2年PFS: 78% vs. 62%);3-4级血细胞减少的发生率较高,但死亡率没有增加。相比之下,虽然维奈克拉联合DA-EPOCH-R治疗侵袭性B细胞淋巴瘤的I期研究产生了有希望的ORR和CR,但一项II期研究显示DHL/THL的治疗相关死亡率过高。因此,维奈克拉联合R-CHOP可能对BCL2+患者有效,但与DA-EPOCH-R联合用药会导致明显的毒性。目前维奈克拉正在与Pola-R-CHP联合治疗新诊断BCL2+ DLBCL。
检查点抑制剂
检查点抑制剂在DLBCL中的研究结果大多令人失望,但生物标志物驱动的检查点抑制和在免疫抑制治疗之前启动治疗可能有效。虽然度伐利尤单抗联合R-CHOP和R2CHOP治疗高危患者未显示获益,但帕博利珠单抗与R-CHOP联合治疗的ORR、CR和2年PFS分别高达90%、77%和83%,特别是在PD-L1+患者中。此外,所有PD-L1+表达的患者在25.5个月的随访中保持缓解。在28例II-IV期患者的II期单臂AvR-CHOP研究中,发现用avelumab进行免疫启动(immune priming),然后进行R-CHOP和avelumab巩固是安全有效的,ORR和2年OS分别为89%和82%。此外,原发性纵膈B细胞淋巴瘤(PMBCL) (n=7)和EBV+ DLBCL (n=3)中的疗效最高(ORR为67%和100%)。因此,免疫启动和生物标志物驱动的检查点抑制剂的使用可能在特定疾病亚群中发挥作用(例如EBV+ DLBCL和PMBCL),可能具有不同的敏感性。
去甲基化药物
去甲基化药物口服阿扎胞苷已显示出与R-CHOP联合的前景。在一项纳入59例患者的I期研究中,阿扎胞苷联合R-CHOP治疗中-高危DLBCL的ORR为95%,CR为88%;中位随访28.9个月,1年和2年PFS分别为84%和79%。中性粒细胞减少(63%)和发热性中性粒细胞减少(25%)是最常见的3-4级毒性。一项评估阿扎胞苷联合R-miniCHOP治疗老年患者疗效的II/III期研究正在招募中(NCT04799275)。
复发/难治患者的治疗
历史上R/R DLBCL患者预后一直较差。最近对2010年至2022年间诊断为R/R DLBCL患者的真实世界结局分析显示,既往接受≥1、≥2和≥3线全身治疗的患者中位OS分别为12.9个月、6.2个月和5.1个月。然而治疗前景在不断发展,自2020年以来,FDA至少批准了6个新的R/R DLBCL药物、CAR-T进入早期治疗线,并且有多种药物正在药物管线中(作者提出的治疗策略见图2、3和4)。因此,因为上述研究中只有2.8%的患者接受过CAR-T,没有患者接受过最近FDA批准的药物,如维泊妥珠单抗、glofitamab或epcoritamab,这些结果不太可能准确地捕捉到采用新策略治疗的患者的当前结局。
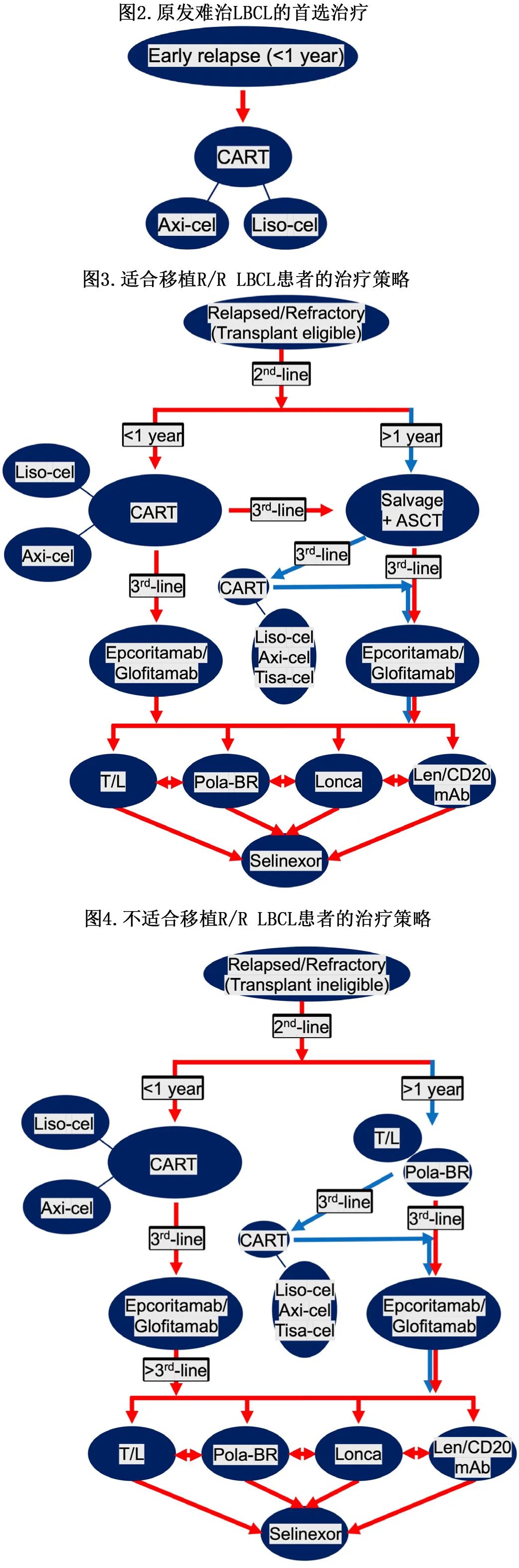
挽救化疗和ASCT
在CORAL研究中,396例首次复发的患者随机分配到R-ICE或R-DHAP,然后进行ASCT。中位随访27个月,3年EFS、PFS和OS分别为31%、37%和49%,此外,因复发接受ASCT治疗的DLBCL的患者经历超额死亡直至ASCT后5年。因此,虽然首次复发超过12个月或CAR-T失败的患者中应考虑挽救性化疗+ASCT,但对于大多数原发难治或首次治疗后12个月内复发的患者,CAR-T现在广泛认为是三线和二线治疗的标准治疗方案。
CAR-T
三种CAR-T产品,axicabtagene ciloleucel(axi-cel)、tisagenlecleucel(tisa-cel)和lisocabtagene maraleucel (liso-cell)已批准用于治疗≥2线的R/R LBCL,axis-cel和liso-cel也批准用于原发难治和早期复发的二线治疗(表2)。而BELINDA研究未能显示出tisa-cel在二线中优于标准治疗,可能是由于资格标准、桥接疗法和终点的差异。关于CAR-T在LBCL二线治疗中的更详细讨论详见Bommier C, Lambert J, Thieblemont C. Comparing apples and oranges: the ZUMA-7, TRANSFORM and BELINDA trials. Hematol Oncol. 2022;40(5):1090-1093.。
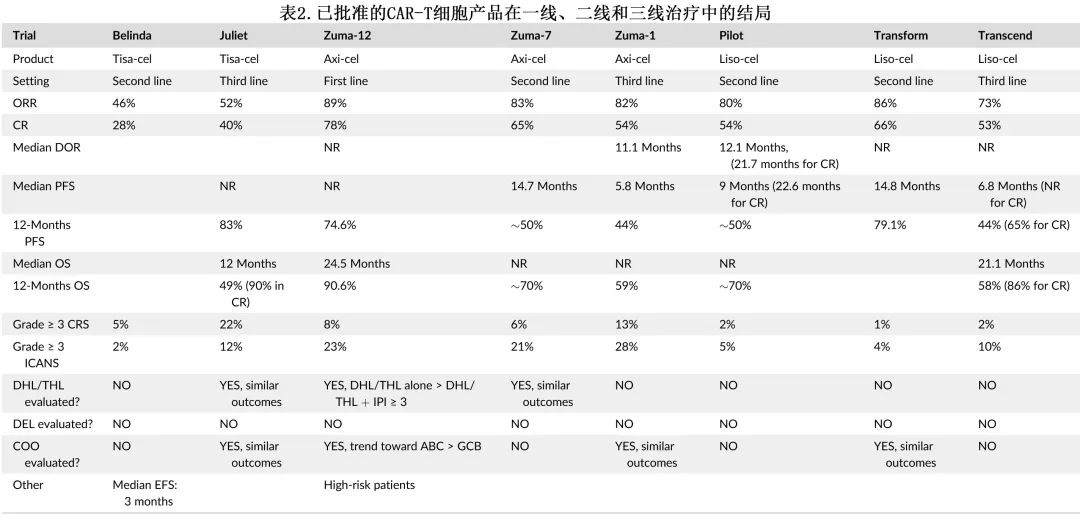
CAR-T在二线中的ORR和CR分别为80%-86%和54% - 66%,三线中分别为42%-82%和52%-54%;长期数据显示axi-cel、 tisa-cel和liso-cel在63、40和24个月随访中,中位OS分别为25.8个月、11.1个月和27.3个月。CAR-T毒性大多可控,在大多数临床试验中,≥3级CRS和ICANS介于1%-13%和4%-12%。此外根据真实世界数据,含有4-1BB共刺激结构域的CAR-T(例如tisa-cel和liso-cel)相对于CD28(例如axi-cel)可能具有更佳的副作用(≥3级CRS和ICANS为5% vs 9%和3% vs 14%),从而允许tisa-cel或liso-cel在门诊安全给药。
目前批准的自体CAR-T产品的局限性包括生产时间较长和T细胞采集不足,此外耗尽的T细胞表型可能导致更糟糕的结局,因此人们正在探索新的平台来解决这些问题。例如,rapcabtagene autoeucel (YTB323)是一种自体CD19 CART,利用二代平台在2天内制造CAR-T细胞。虽仍处于早期开发阶段,但其在三线治疗中显示出良好的疗效(CR 83%)和耐久性(中位DOR为16个月,12个月PFS为50%)。低剂量的CAR-T似乎也可改善CAR-T的扩增和持久性,而不会导致更明显的毒性。
ALLO-501和ALLO-501A是从健康献血者外周血中获得的“现成”异基因CAR-T,两种产品都经过改良以尽量减少移植抗宿主病(GVHD)风险。ALLO-501A与第一代ALLO501的不同之处在于它不存在利妥昔单抗识别结构域,因此可用于最近暴露于利妥昔单抗的患者。与先前批准的使用氟达拉滨/环磷酰胺或苯达莫司汀清淋的CAR-T不同,ALLO-501/501A正在评估使用FCA90(氟达拉滨、环磷酰胺和抗CD52单克隆抗体ALLO-647)清淋。ALLO-501治疗LBCL的安全性和有效性的数据最初发表于2020年,并于2021年发表B细胞NHL数据。在12例R/R LBCL患者的I/II期ALPHA/ALPHA2更新中,从入组到治疗的中位时间为3天,ORR为66.7%,CR为58.3%,中位DOR为23.1个月;未观察到GVHD、ICANS或3+级CRS。
NK CAR-T是另一种异基因CAR-T,它们缺乏T细胞受体来将毒性降到最低,并且迄今为止仅在少数接受治疗的患者中具有良好的反应和最小的毒性。在NK CAR-T治疗NHL的I/II期研究中,7例NHL患者(2例DLBCL, 4例转化型惰性淋巴瘤,1例滤泡性淋巴瘤)和4例慢性粒细胞白血病患者接受脐带血来源NK CAR-T治疗。约73%的患者有反应,CR为88%。NX019是另一种新型NK CAR-T,已被评估用于侵袭性B细胞淋巴瘤。由于CRS和ICANS,该药物分多次给药(第0、7和14天),部分患者接受多个周期。在一项I期研究中,7例侵袭性LBCL患者的ORR和CR分别为42%和29%。最常见的3+级不良事件为骨髓抑制,而没有观察到ICANS、GVHD或3+级CRS
综上所述,新型CAR-T的快速周转、可及性和低毒性带来希望,但这些药物还处于药物开发的早期阶段。Ali等人对CAR-T在侵袭性B细胞淋巴瘤中的作用进行了深入的综述,详见Ali A, Goy A, Dunleavy K. CAR T-cell therapy in highly aggressive B-cell lymphoma: emerging biological and clinical insights. Blood.2022;140(13):1461-1469。
双特异性抗体
在R/R LBCL中评估bsAb的研究通常纳入多线治疗患者,这些患者大多为III-IV期疾病且既往治疗至少三线。贝林妥欧单抗、mosunetuzumab和odronexamab是目前正在研究的最先进的药物,epcoritamab和glofitamab最近被FDA批准用于三线治疗(表1)。
Epcoritamab
Epcoritamab是一种皮下给药的bsAb, I/II期EPCORE NHL-1研究使用Epcoritamab直到疾病进展或不可接受的毒性,157例患者接受治疗,其中61%为原发难治。中位随访10.7个月,ORR、CR和中位DOR分别为63%、39%和12个月(CR患者中NR)。Epcoritamab对既往CAR-暴露患者有效(+/-CAR-T患者的ORR 54% vs 69%;CR为34% vs 42%),≥3级CRS和ICANS仅有2.5%和0.6%。
Epicoritamab也被评估联合利妥昔单抗、地塞米松、阿糖胞苷和奥沙利铂/卡铂(RDHAX/C)随后进行ASCT。在I/II期EPCORE NHL-2研究中27例患者接受治疗,其中大多数(70%)为原发难治。ORR和CR分别为85%和67%;中位随访12.6个月时,接受ASCT治疗的患者未见进展,且在中位随访13.6个月时,接受单药而ASCT治疗的患者中有80%仍处于CR中。12个月OS为90%;未发生≥3级ICANS。因此,epcoritamab-R-DHAX/C在这一高危人群中似乎安全有效,然而尚不清楚该方案在二线治疗中是否优于CAR-T。
Glofitamab
在I期研究中,推荐的II期剂量glofitamab治疗下,ORR 65.7%和CR 57.1%,只有3.5%和4.1%发生3级CRS和≥3级ICANS。在II期研究中,155例既往3线治疗的患者接受奥妥珠单抗预处理,然后固定时间的glofitamab(最多12个周期)。中位随访12.6个月,ORR和CR分别为52%和39%,其中78%的CR维持12个月,12个月PFS为37%,CRS和ICANS的发生率与I期相似。GCB、DHL和DEL患者似乎获益最大,且疗效不受既往CAR-T暴露的影响。
Mosunetuzumab
在一项纳入129例mosunetuzumab治疗的LBCL患者的I期剂量递增研究中,ORR和CR分别为34.9%和19.4%。无论之前是否接受CAR-T治疗均获得缓解(总队列vs.既往CAR-T治疗:ORR为35% vs. 37%,CR为19% vs. 26%),获得CR的患者中位DOR为22.8个月。治疗耐受性良好,接受剂量递增治疗的患者中有27.4%发生CRS且主要局限于第1周期,只有1%的患者发生≥3级事件,无4-5级事件;剂量递增下只有1%的患者发生3级ICANS,无4-5级神经毒性。在一项63例R/R DLBCL患者的II期研究中,Mosunetuzumab也与维泊妥珠单抗(M-Pola)联合进行了评估;缓解率较高特别是在老年患者中(≥65 vs. <65岁:ORR 72% vs. 54%,CR 56% vs. 38%),老年患者中36%既往接受过CAR-T治疗,但年轻患者既往治疗线更多(既往≥3线治疗67% vs 56%)。
Odronextamab
odronexamab在I期ELM-1研究中显示出良好的安全性和有效性,CR率为53%,CRS和ICANS仅限于1-2级,然而既往CAR-T暴露的患者中缓解率较低;发生4例治疗相关死亡。相比之下,在II期ELM-2研究的130例患者ORR为49%、CR为31%,与CAR-T暴露无关, 随访21.3个月,18个月PFS为26%;原发难治和双重难治患者获益最大。无≥3级ICANS事件,只有1.4%的患者发生3级CRS,没有4-5级事件。关于CAR-T暴露的I期和II期研究结果的差异可能源于随访时间的差异(4.2个月对17个月)。总的来说,无论患者是否有CAR-T暴露史,odronexamab都可能成为患者的一种选择。
贝林妥欧单抗
在一项R/R DLBCL的I期研究中,贝林妥欧单抗的ORR和CR分别为43%和19%。在一项包含41例高危患者的II期研究中,由于疾病进展,只有59%的患者接受了≥80%的预期剂量;ORR和CR分别为37%和22%,但达到CR的患者在短期随访中有持久缓解。2%和24%的患者中发生3级CRS和ICANS,未发生4级或5级CRS或ICANS事件。GCB、DHL和DEL亚型患者获益最大。
Epcoritamab和glofitamab已被批准作为三线高效疗法,即使在既往多线治疗患者中也是如此。bsAb的优点是可快速获得、严重CRS和ICANS发生率低。虽然在复发和难治性情况下,免疫疗法的理想排序(如CAR-T和bsAb)目前尚不清楚,但正在探索中,且它们的使用可能是有益的。目前,随着CAR-T在二线治疗中使用的增加,bsAb通常用于CAR-T后或不适合CAR-T的患者;但bsAb也可能是CAR-T的一个有价值的替代方案,特别是对于需要紧急治疗的患者。
抗体药物偶联物
维泊妥珠单抗
在一项Ib/II期研究中,Pola-BR在所有亚组的CR、PFS和OS方面优于苯达莫司汀/利妥昔单抗,且与COO和DEL状态无关;中位PFS和OS分别为9.2个月和12.4个月。虽然1-2级神经病变和3-4级细胞减少率较高,但大多数患者的神经病变消退,且血细胞减少与感染率增加无关。重要的是,虽然维泊妥珠单抗单药治疗在初始I期研究中治疗的25例患者中缺乏疗效,但对50例患者的回顾性分析表明,它可能与苯达莫司汀或利妥昔单抗同时给药产生相当的反应,使其成为桥接CAR-T的一种选择,而不会出现苯达莫司汀的淋巴细胞耗竭。此外维泊妥珠单抗在二线治疗中与异环磷酰胺、卡铂和依托泊苷(PolaR-ICE)联合的ORR和CR分别为92%和52%。需要更长的随访时间来评估缓解持续时间,其益处可能仅限于未接受一线Pola-R-CHP的患者。
Loncastuximab tesirine
Loncastuximab (Lonca)是靶向CD19表达细胞,携带细胞毒性吡咯苯二氮卓类药物。II期LOTIS-2研究显示ORR为48.3%,缓解患者中半数为CR。最常见的≥3级不良事件为中性粒细胞减少症、血小板减少症和GGT升高,无治疗相关5级不良事件。评估Lonca联合伊布替尼的LOTIS-3研究已停止。Lonca单用或联合使用正在被评估作为CAR-T巩固、ASCT维持和一线治疗(NCT05464719、NCT04384484、NCT05222438、NCT05270057)。
CD19单克隆抗体
Tafasitamab联合来那度胺(T/L)治疗R/R DLBCL的II期L-MIND研究显示,在不适合ASCT且没有CAR-T失败史的患者中,ORR为60%,CR为43%。但该研究纳入了很少的原发难治患者且DHL/THL很少。因此,真实世界的数据显示CR、中位PFS和中位OS分别为9%、2个月和6.6个月,结果较差。51%的患者发生严重不良事件,包括肺栓塞(4%)、心房颤动(2%)和充血性心力衰竭(2%)。因此,尽管Tafasitamab批准用于二线治疗,但通常用于后线治疗。目前正在研究多种药物的组合(NCT04824092、NCT05626322、NCT04978584、NCT02763319、NCT05328102)。
核出口抑制剂
口服核输出抑制剂塞利尼索的SADAL研究显示,多线治疗患者的ORR为28%,在中位随访14.8个月时,缓解者的中位OS未达到。但研究设计需要较长的(≥60天和98天)洗脱期,因此选择了较惰性的患者。此外塞利尼索具有显著毒性,特别是血细胞减少,因此在临床实践中的应用受到限制。
总结
DLBCL是一种异质性疾病,预后不一,分子学和遗传特征有助于预测和鉴定新的生物靶点。一线治疗正在发展,但高危患者的预后仍然不理想。优化对新诊断DLBCL标准免疫化疗早期治疗失败的识别,以及有效的新免疫疗法(如CAR-T和bsAb)的扩大作用,将有助于改善预后。同样,确定可受益于针对特定亚型发病机制的靶向药物的患者亚群,有望摆脱一刀切的方法,并在不久的将来使更多的DLBCL患者得到治愈。
参考文献
Tavakkoli M, Barta SK.2024 Update: Advances in the risk stratification and management of large B-cell lymphoma.Am J Hematol . 2023 Aug 30. doi: 10.1002/ajh.27075.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













