BJH:利妥昔单抗-硼替佐米-地塞米松在临床实践中诱导iMCD的高反应率
2023-08-09 将军的九分裤 MedSci原创 发表于上海
这是首个证明这种特殊的联合治疗对iMCD患者有显著疗效的研究。虽然对于这组临床异质性的iMCD患者有很多限制,但也证明了利妥昔单抗和硼替佐米的联合治疗是安全且耐受性良好的
特发性多中心Castleman病(iMCD)的治疗选择目前是有限的,特别是对白细胞介素-6抑制剂无反应或耐药的患者。一研究团队创新性地设计了一种方案,即使用利妥昔单抗-硼替佐米-地塞米松(RVD)作为新诊断的iMCD患者的一线巩固治疗。

研究根据国际共识诊断标准,病根据临床、实验室和病理结果,所有于2022年1月-2022年12月诊断为iMCD的患者均在获得知情同意后接受RVD方案治疗。患者接受利妥昔单抗(375mg/m)治疗2[第0天]),硼替佐米(1.3mg/m2[第1、8、15和22天])和地塞米松(40mg[第8、15和22天]。

图1 (A)处理方案 (B)5例iMCD患者采用RVD方案治疗的临床结果 (C)基线和RVD治疗
此外,研究采用非维持治疗策略,以简化缓解后的护理。5例iMCD患者(包括1例TAFRO综合征患者)接受RVD治疗,所有患者均达到部分缓解(PR)或更好。RVD治疗4个周期后,3例(60%)患者获得PR,1例(20%)患者获得完全缓解。这5名患者达到PR或更好,停止治疗,但中位随访时间保持稳定,随访时间为11个月,反应持续时间分别为7、7、10、12和13个月。观察期内,所有患者均无≥3级不良事件发生。总的来说,这些发现表明RVD方案可能是iMCD患者的一种有前途的治疗选择。
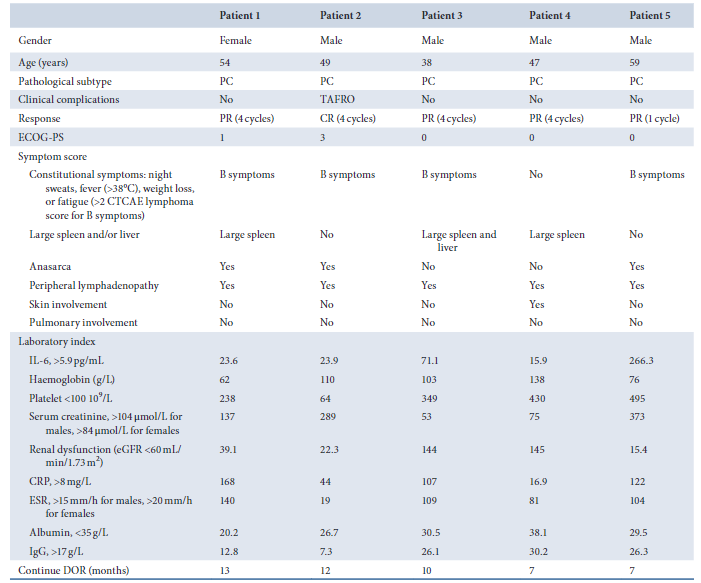
图2 iMCD患者基线特。简称:DOR,反应持续时间;PC,浆细胞
原始出处:
Yin X, Liu Y, Zhong C, Lv Y, Xu D, Zhu L, Jin J, Meng H, You L. Rituximab-bortezomib-dexamethasone induce high response rates in iMCD in clinical practice. Br J Haematol. 2023 Jul 23. doi: 10.1111/bjh.19000. Epub ahead of print. PMID: 37485679.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言