非酒精性脂肪性肝病(NAFLD)是指除外酒精和其他明确肝损伤因素所致的,以肝脏脂肪变性为主要特征的临床病理综合征,包括非酒精性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)、脂肪性肝纤维化、相关肝硬化和肝癌等。目前,NAFLD已经成为最常见的慢性肝病[1]。研究显示,NAFLD在亚洲国家的总体患病率约为29.62%[2],北京地区成人常住人口中NAFLD流行率约为31%[3]。细胞焦亡(pyroptosis)是指一种依赖于半胱天冬酶(caspase)和Gasdermin(GSDM)家族蛋白的可调控的细胞死亡,表现为细胞肿胀、质膜成孔和破裂,但核尚完好,同时伴随大量炎症因子的释放[4]。正常情况下,细胞焦亡是机体的一种天然免疫反应,有利于清除体内的有害病原体,但越来越多的研究证实,细胞焦亡的过度激活会导致细胞、组织和器官损伤[5]。
目前人们最为接受的“多重打击”学说尚不能对NAFLD的发病机制做出完整解释,针对NAFLD的治疗更多依靠于体质量减轻和饮食结构改善,缺乏更为有效的治疗对策[6]。通过深入研究寻找更有潜力的干预治疗靶点对于NAFLD的治疗具有重大意义,细胞焦亡的研究可能成为一个新的、重要的突破口。为此,本文对细胞焦亡在NAFLD中的研究进展进行了综述。
1细胞焦亡的研究背景及机制
细胞焦亡最早于1992年由Sansonetti团队报道;2001年Boise和Collins[7]将其命名为“Pyroptosis”;2015年,邵峰团队和Dixit VM团队分别在Nature杂志发表相关研究证实了GasderminD(GSDMD)是caspase-4/11的关键下游分子[8-9]。至此,细胞焦亡开始成为了热点领域,其作用机理和病理生理学功能也被逐渐阐明。
细胞焦亡与细胞凋亡(apoptosis)、细胞自噬(autophagy)、坏死性凋亡(necroptosis)、铁死亡(ferroptosis)以及中性粒细胞胞外诱捕网(NET)相关死亡NETosis等一样都属于细胞程序性死亡的范畴,它们之间相互区别(表1)[4, 10-14]又彼此联系:(1)细胞焦亡和凋亡都由caspase家族介导,且有共同的caspase-3/8参与[15];(2)发生坏死性凋亡的细胞破裂后释放出K+可通过NEK7驱动NLRP3炎症小体组装,促进细胞焦亡发生[16];(3)坏死性凋亡或细胞凋亡的发生主要取决于caspase-8的作用,只有当caspase-8受到抑制时,在外来刺激(如TNFα)作用下才可诱发坏死性凋亡,反之则引起细胞凋亡[12]。在某些代谢性炎性疾病(如NAFLD)中,细胞焦亡和其他程序性死亡发挥着重要的促进作用,细胞死亡后释放的一些细胞成分可引起强烈炎症反应,促进炎症细胞募集和肝星状细胞(HSC)活化,进而加重疾病的进展[17]。
目前报道的细胞焦亡发生机制(图1)包含由微生物和宿主细胞损伤因素诱导的经典炎症小体途径[5, 18-19]、由革兰阴性细菌脂多糖诱导的非经典炎症小体途径[20]以及其他途径[15, 21-22],其中对经典炎症小体途径和非经典炎症小体途径的研究相对较为清晰,并在NAFL、NASH和肝纤维化、HCC中均有体现,且以NASH的研究最为丰富。
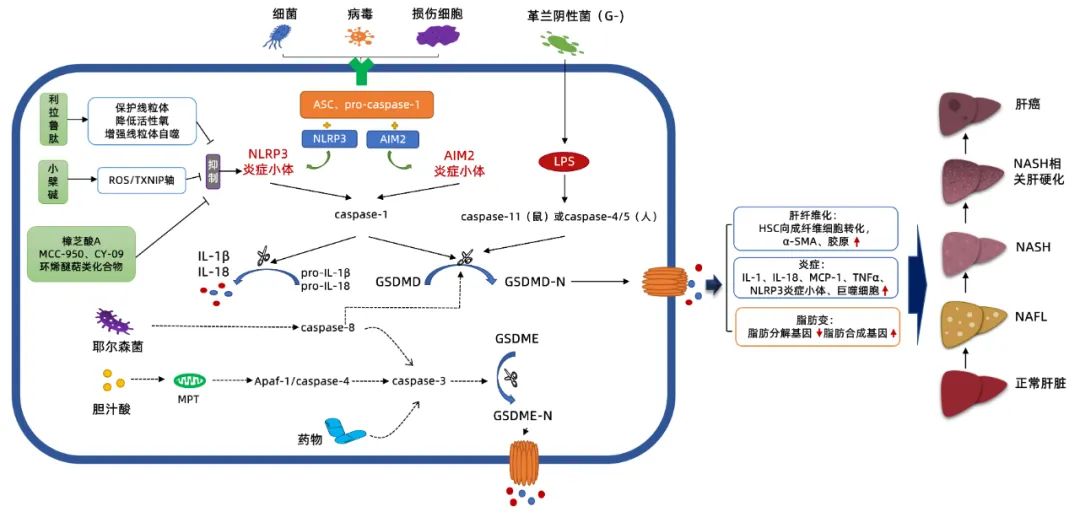
图1 细胞焦亡及其阻断剂在NAFLD中的调控机制示意图
注:Apaf-1,凋亡酶激活因子-1;AIM2,一种DNA感受器;ASC,凋亡相关斑点样蛋白;DAMP,损伤相关分子模式;dsDNA,双链DNA;GSDMD-N,GSDMD的N端结构域;GSDME-N,GSDME的N端结构域;LPS,细菌脂多糖;MPT,线粒体通透性转换;MCP-1,单核细胞趋化蛋白-1;PAMP,病原相关分子模式;pro-caspase-1,前半胱天冬酶-1;TXNIP,硫氧还蛋白结合蛋白。虚线箭头:表示尚未有证据显示参与NAFLD的过程。
2细胞焦亡在NAFLD中的作用
2.1 NAFL和NASH
在病理上,NAFL主要以肝细胞内脂肪过度沉积为特征,而NASH则表现为肝细胞内脂质沉积、气球样肝细胞、炎症和纤维化。
脂肪生成和降解失衡导致的脂质积累是NAFLD发生发展过程中的重要生理病理机制, 也是NAFL向NASH进展的关键因素。研究显示,细胞焦亡可以负向调控脂质累积过程。Xu等[23]发现GSDMD敲除小鼠肝脏脂肪含量下降,脂肪分解基因Pparα、Aco、Lcad、Cyp4a10和Cyp4a14的表达水平明显上调,脂肪合成基因Srebp1c表达下降。Zhu等[24]的研究也显示,脂肪变性小鼠肝脏中caspase-11的mRNA和蛋白表达水平增加;caspase-11敲除可以减少肝组织脂肪变性和气球样变,而过表达则可以加重脂质堆积,提示caspase-11的水平和肝脂肪变性之间呈正相关;然而caspase-11具体通过何种机制来诱导脂肪变性尚需进一步阐释。
炎症作为NASH诊断的另一个标志性特征,与细胞焦亡也有着密切联系。Xu等[23]还指出,NASH患者肝组织caspase-1/4/5、GSDMD、GSDMD-N、IL-1β以及IL-18等表达水平升高,且GSDMD-N与小叶炎症呈正比,可作为NASH的潜在诊断标志物;此外,GSDMD敲除小鼠促炎因子IL-1β、TNFα、MCP-1表达水平、以及NF-κB活化和巨噬细胞浸润程度均显著下降,炎症得到明显改善,而GSDMD-N过表达时则与上述结果相反。Mitsuyoshi等[25]提示,NASH患者肝组织pro-caspase-1、IL-1β和IL-18的mRNA水平明显升高,且NLRP3炎症小体仅在NASH患者肝组织表达,而其组成蛋白pro-caspase-1在非NASH组表达低于NASH组,且NAFLD患者血清中pro-caspase-1 mRNA水平显著高于对照组。在高脂饮食或蛋氨酸和胆碱缺乏饮食诱导NASH模型中,炎症小体NLRP3和AIM2等以及它们相关的组成蛋白水平均上调,炎症小体的激活显著促进了细胞焦亡的发生和炎症的进展[26]。但也有研究[27]指出,AIM2与脂质堆积和细胞炎症呈负相关,AIM2敲除后小鼠肥胖症状和炎症反应加剧,考虑这一现象可能与AIM2不依赖于AIM2炎症小体的形成而独立发挥作用有关,具体机制还有待进一步研究。
一直以来,阻断NASH进展都是NAFLD治疗的核心目标。研究证实,通过药物抑制细胞焦亡可以显著延缓NASH进展,其中以NLRP3炎症小体的相关报道居多。长效GLP-1类似物利拉鲁肽通过保护功能性线粒体、降低ROS产生和增强线粒体自噬抑制NLRP3炎症小体诱导的肝细胞焦亡[28]。TXNIP可在ROS诱导下从TRX中解离并与NLRP3结合将其激活,小檗碱的体外研究发现它正是通过ROS/TXNIP轴抑制了NLRP3炎症小体激活和细胞焦亡[29]。三萜类化合物樟芝酸A可抑制NLRP3炎症小体的激活和组装,显著降低Kupffer细胞中NLRP3、caspase-1和GSDMD-N表达,减少细胞焦亡和炎症因子释放,抑制小鼠肝组织炎症反应、减少脂质沉积[30]。此外,MCC-950、CY-09以及某些中药环烯醚萜类化合物等皆可作为NLRP3的抑制剂阻止细胞焦亡发生[31]。上述药物已在动物或体外实验中获得明显效果,具有治疗NASH的潜在价值,未来对它们的进一步研究有望为NASH的治疗提供新的策略。
2.2 肝纤维化
肝纤维化是细胞外基质过度沉积的结果,HSC在这一过程中发挥着关键作用。受到外来刺激时,HSC出现增殖活化,产生的大量细胞外基质沉积在肝组织中,最终导致肝纤维化甚至肝硬化,其发生机制基本相同。
细胞焦亡及其产物可促进HSC的活化,并对HSC活化标志分子α-SMA和活化产物胶原蛋白表达产生影响[32]。与野生小鼠相比,GSDMD敲除小鼠α-SMA、TGFβ1以及胶原水平和纤维含量明显减少[23]。细胞焦亡发生后,破损细胞释放的IL-1β、IL-18和TGFα等炎症因子以及其他DAMP与HSC上受体结合可导致HSC活化,诱导纤维化标志物上调,促进肝纤维化发生[33]。在离体实验中,NLRP3炎症小体以独立于炎症和损伤的方式诱导HSC激活,上调肝纤维化标志物水平,诱导其向肌成纤维细胞转化[34]。2021年Gaul等[35]证实,HSC可内化细胞破裂后释放的NLRP3炎症小体寡聚体,而后HSC活化并向肌成纤维细胞样细胞分化,同时IL-1β分泌和α-SMA表达增加,最终导致纤维化形成和早期纤维化改变。
2.3 肝细胞癌(HCC)
细胞焦亡与多种肿瘤的发生发展存在着密切、复杂的联系。研究显示,细胞焦亡可促进乳腺癌[36]和胃癌[37]的增殖和转移,这可能与细胞焦亡发生后释放大量炎症介质形成的炎性微环境有关[38],但也有研究[39-40]指出细胞焦亡的激活抑制了这两种肿瘤的进展。
HCC是各种慢性肝病发展的后期阶段,NAFLD的任何阶段均可直接进展到HCC,相比于其他病因所致的HCC而言,NASH相关HCC的存活率更低[41]。从表型结果来看,细胞焦亡似乎是HCC发生发展中的有利因素:Chen等[42]通过比较HCC和正常组织的caspase-1、IL-1β和IL-18发现,HCC组织中的含量明显低于周围正常组织。Wei等[43]也发现NLRP3炎症小体及其组成成分在HCC组织中的表达低于癌旁组织,并随HCC患者病理分级和临床分期的增加而减少;此外,他们还发现雌二醇的抗癌作用部分依赖于激活NLRP3炎症小体介导的细胞焦亡[44]。从药物干预来看,细胞焦亡的激活或许也是HCC治疗的一个新策略。对高山杉木异黄酮(AIF)处理的肝癌细胞研究后发现,细胞NLRP3、caspase-1、IL-1β和IL-18的表达量随AIF浓度升高而增加,抑制NLRP3后AIF的抗癌效果减弱,提示AIF通过诱导NLRP3炎症小体介导的细胞焦亡可抑制肝癌细胞的生长和转移[45]。但是,考虑到HCC的病因、发生发展机制、治疗反应等诸多异质性因素,细胞焦亡与HCC的关系仍有进一步深入研究的空间。
3小结与展望
随着NAFLD患病人群逐渐增多,高效的治疗措施愈加关键。细胞焦亡作为一种新型的程序性死亡方式,其在NAFLD各阶段尤其是NASH相关肝纤维化、HCC中的认识还不全面,希望未来通过深入、系统地研究能够为NAFLD的预防和治疗开辟新途径。此外,对GSDME、capase-11等细胞焦亡执行分子,以及AIM2等既往关注较少的炎性小体的功能作用的阐释,也会成为今后有价值的研究方向。
全文下载
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.01.027
引证本文
尹静亚, 杨冰清, 李越. 细胞焦亡在非酒精性脂肪性肝病中的作用[J]. 临床肝胆病杂志, 2023, 39(1): 175-180.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












好文章,值得一读。
28