Lancet Haematol:皮下Dara-Pd对比Pd治疗RRMM的3期研究延展随访
2023-10-13 聊聊血液 聊聊血液 发表于上海
近日《The Lancet Haematology》报道了APOLLO研究最终的总生存期(OS)和更新的安全性分析结果。
Dara-Pd对比Pd
在新诊断多发性骨髓瘤(NDMM)和复发难治多发性骨髓瘤(RRMM)患者的 III 期研究中,达雷妥尤单抗联合标准治疗方案均显著降低了疾病进展或死亡的风险,并产生了深度且持久的缓解,包括完全缓解或更好的缓解率(≥CR)和微小残留病(MRD)阴性率显著高于单独标准治疗。
静脉剂型达雷妥尤单抗联合泊马度胺和地塞米松治疗RRMM的1b期研究也获得优异结果,基于此开展了3期APOLLO研究,以评估达雷妥尤单抗(包括皮下剂型和静脉剂型)联合泊马度胺和地塞米松(Dara-Pd)对比泊马度胺和地塞米松(Pd)治疗RRMM的疗效和安全性。APOLLO研究中位随访16.9个月的初步分析中,与泊马度胺和地塞米松单独给药相比,达雷妥尤单抗皮下或静脉给药联合泊马度胺和地塞米松显著延长了无进展生存期(PFS,中位12.4个月 vs 6.9个月;风险比 [HR]=0.63;p=0.0018),客观缓解率(ORR)也更高(69% vs 46%;比值比2.7;p<0.0001);深度缓解率也更高:≥VGPR率分别为51%和20%,≥CR率分别为25%和4%(p均<0.0001);MRD阴性率分别为13/151[9%]和3/153[2%](OR=4.7;p=0.010)。
近日《The Lancet Haematology》报道了APOLLO研究最终的总生存期(OS)和更新的安全性分析结果。

研究方法
APOLLO研究是一项开放标签、随机3期研究,纳入≥18岁、ECOG 体能状态评分为0-2分、既往接受过至少一线治疗(包括来那度胺和蛋白酶体抑制剂)且既往接受过一线或多线抗骨髓瘤治疗后达到≥PR的RRMM患者,如果既往仅接受过一线治疗则为来那度胺难治。
使用交互式网络应答系统随机分配患者 (1:1) 接受达雷妥尤单抗+泊马度胺和地塞米松或泊马度胺和地塞米松治疗;根据既往治疗线数(1 vs 2–3 vs ≥4)和国际分期系统疾病分期((ISS I、II、III))对患者进行分层。
所有患者口服泊马度胺(4mg,每日1次;第1-21天)和地塞米松(40mg,每日1次;第1、8、15和22天;≥75岁患者为20mg),28天为1周期,直至疾病进展或出现不可接受的毒性;Dara-Pd组给予达雷妥尤单抗(1800 mg皮下给药或 16 mg/kg 静脉给药)每周给药一次(第1-2周期),之后每2周给药一次(第3-6周期),此后每4周给药一次。
在意向治疗(ITT)人群中评估主要终点无进展生存期(PFS,既往已报道),预先计划的次要终点包括总生存期(OS)、安全性、MRD阴性状态、至缓解时间(TTR)、缓解持续时间(DOR)、至后线治疗时间(TTNT)、患者报告结局、客观缓解率(ORR)、≥VGPR率、≥CR率等。
研究结果
患者
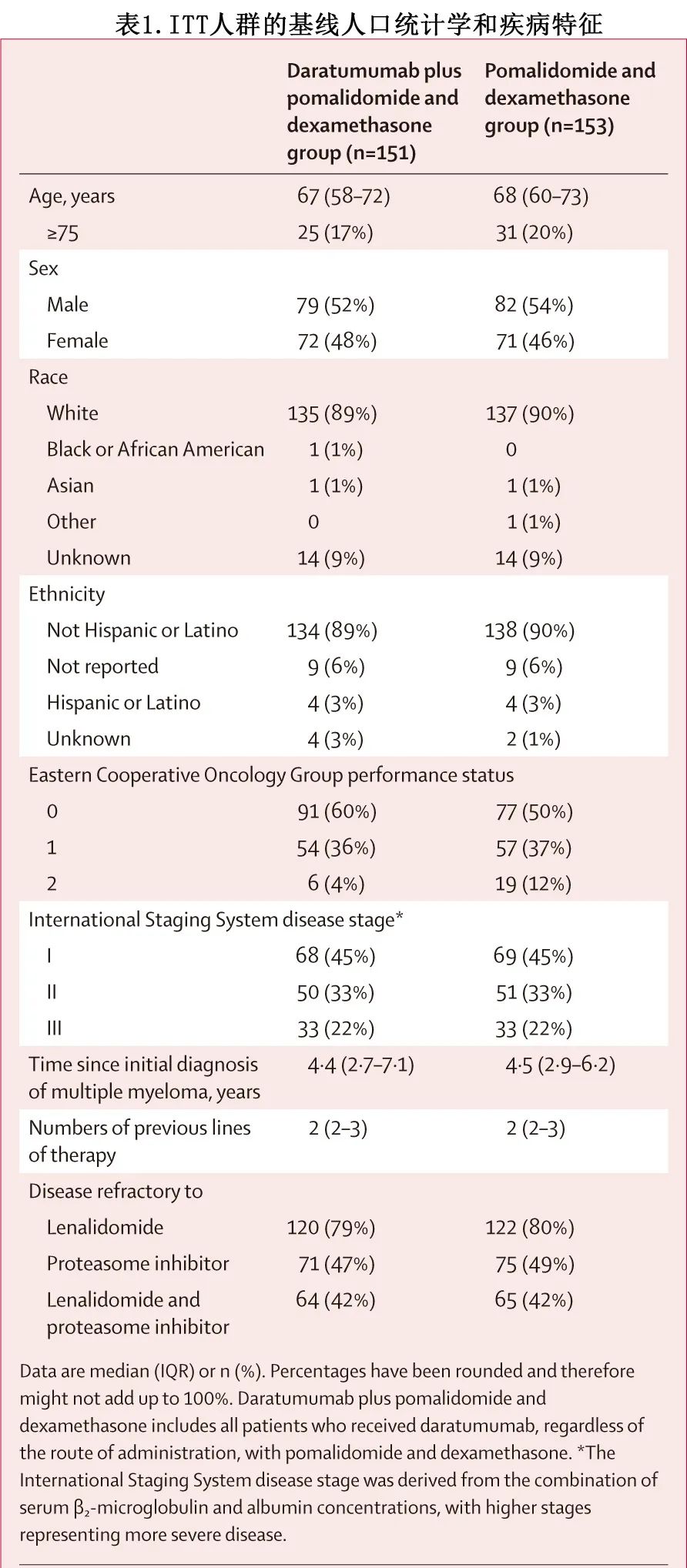
入组流程见图1。在304例合格患者中,151例随机分配接受达雷妥尤单抗+泊马度胺和地塞米松治疗,153例随机分配接受泊马度胺和地塞米松治疗。达雷妥尤单抗 + 泊马度胺和地塞米松组中142/149例 (95%) 患者仅接受达雷妥尤单抗皮下给药;7/149例 (5%) 患者开始接受达雷妥尤单抗静脉给药,其中4例患者转换为达雷妥尤单抗皮下给药,3例患者在转换前接受达雷妥尤单抗静脉给药时发生疾病进展,根据方案修订案允许转换。
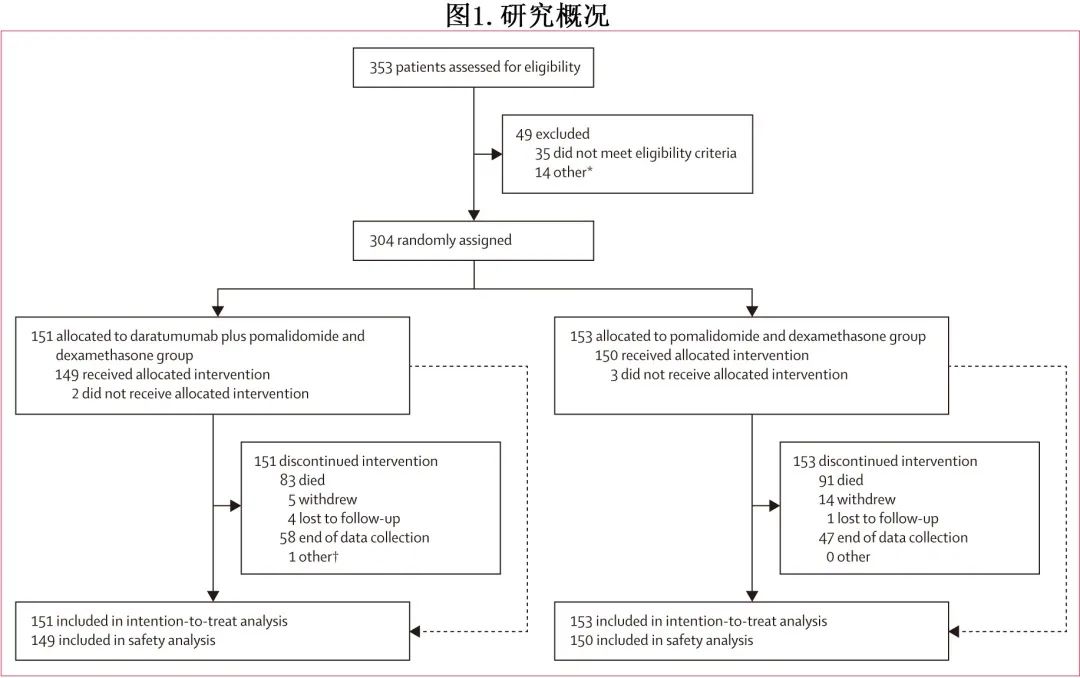
入组时治疗组之间的患者基线人口统计学分布均衡(表1)。患者的中位年龄为67岁,自多发性骨髓瘤初次诊断后的中位时间为4.4年,患者既往接受过中位2线治疗,包括自体干细胞移植、蛋白酶体抑制剂和免疫调节治疗。当比较治疗组(Dara-Pd vs Pd)时,研究中纳入的许多患者对来那度胺(151例患者中的120例 [79%] vs 153 例患者中的122例 [80%])、蛋白酶体抑制剂(47% vs 49%)或两药(42% vs 42%;表1)难治。
暴露量
在安全性人群中,Dara-Pd组的泊马度胺中位相对剂量强度为74%,而Pd组为91% (p<0.0001)。对于地塞米松,Dara-Pd组的中位相对剂量强度为78%, Pd组为87% (p=0.0278)。达雷妥尤单抗皮下给药的中位相对剂量强度为95%,达雷妥尤单抗静脉给药的中位相对剂量强度为86%。
Dara-Pd组的研究治疗中位暴露持续时间为11.5个月, Pd组为6.6个月。Dara-Pd组68/151例 (45%) 患者被删失(censored),其中5例 (7%) 撤回知情同意,而Pd组153例患者中的62例 (41%) 删失,其中14例 (23%) 由于撤回知情同意。
疗效
中位随访39.6个月,Dara-Pd组151例患者中的83例 (55%) 和Pd组153例患者中的91例 (59%) 死亡,主要死因为疾病进展、与研究治疗无关的不良事件或COVID-19。Dara-Pd组的中位OS为34.4个月,而Pd组为23.7个月(HR=0.82;p=0.20;图2A。无显著差异可能是因为Pd组更多患者后续接受了CD38单抗)。
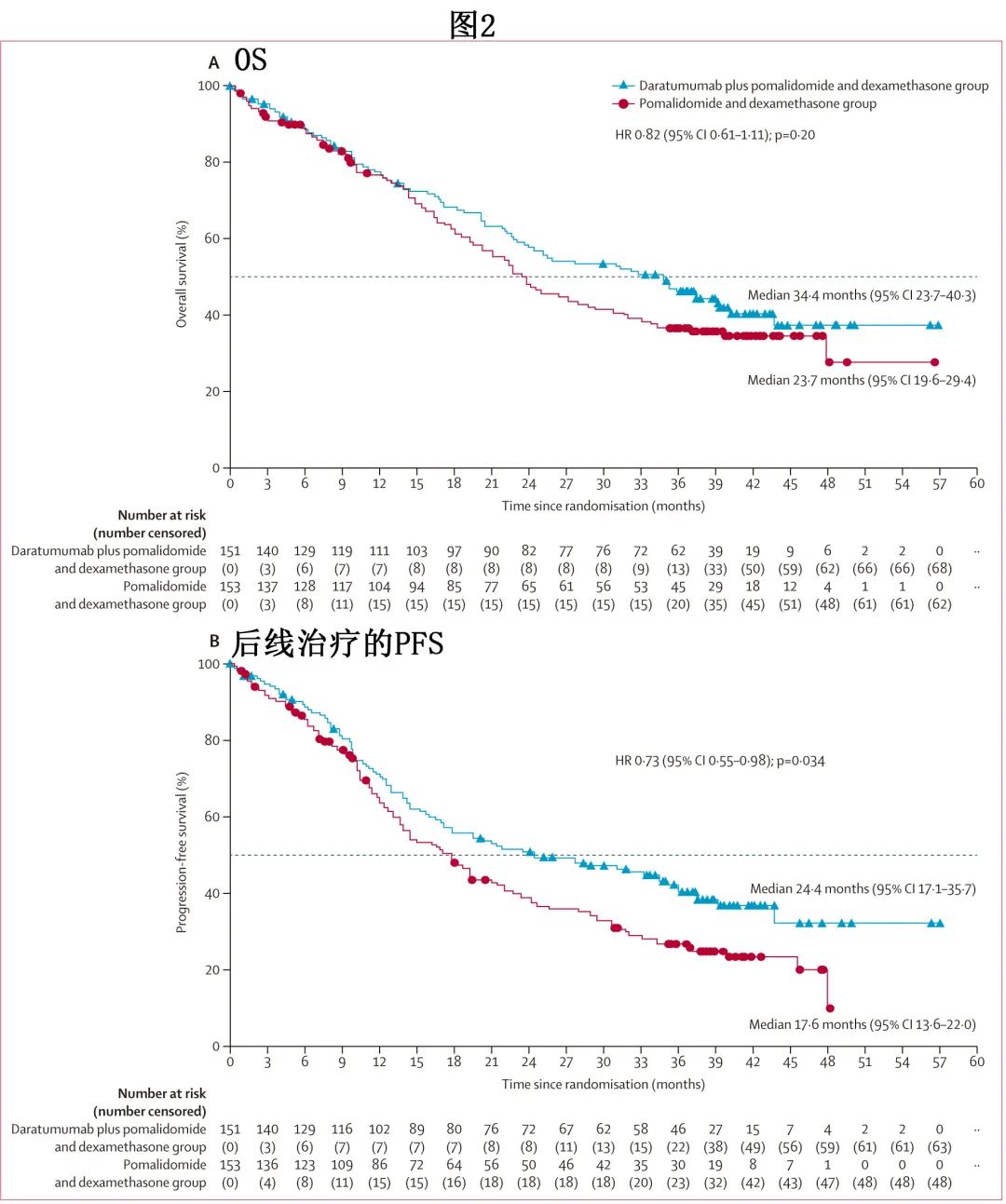
后线治疗的PFS(从随机化至后线治疗进展或全因死亡的持续时间)是预先计划的探索性终点。Dara-Pd组的后线治疗中位PFS显著长于Pd组(24.4个月 vs17.6个月;HR=0.73;p=0.034;图2B);后线治疗的36个月PFS率也更长 (41.4% vs 27.0%)。
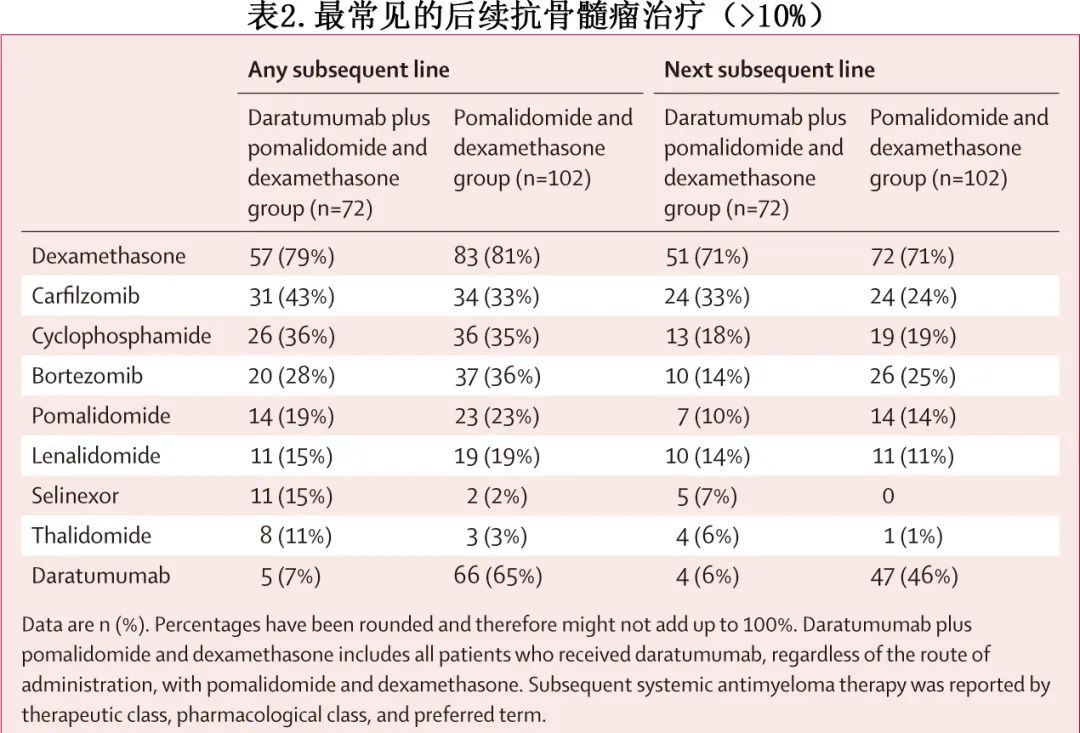
Dara-Pd组至后线治疗的中位时间显著长于Pd组(20.0个月 vs 11.8个月;HR=0.61;p=0.0008)。在安全性人群中,Dara-Pd组72/149例 (48%) 患者和Pd组102/150例 (68%) 患者接受了任何线的后续抗骨髓瘤治疗(表2)。在接受任何线后续治疗的患者中,Pd组和Dara-Pd组中分别有69%(70/102例)和10%(7/72例)的患者接受了抗 CD38 靶向治疗。对于Dara-Pd组以及Pd组,地塞米松是最常见的下一线和任何线后续全身性抗骨髓瘤治疗(表2)。
安全性
Dara-Pd组和Pd组的安全性人群分别纳入149和150例患者,额外随访未发现新的安全性问题(表3)。Dara-Pd组vs Pd组,3种最常见的1-2级治疗期间出现的不良事件为上呼吸道感染 (25% vs 14%)、发热 (21% vs 17%) 和贫血 (20% vs 23%);Dara-Pd组最常见的3级治疗期间出现的不良事件为中性粒细胞减少 (25%)、贫血 (17%) 和白细胞减少(11%),而中性粒细胞减少(32%)、贫血 (21%)、血小板减少(13%)是Pd组最常见的3个事件;Dara-Pd组三种最常见的4级治疗期间出现的不良事件为中性粒细胞减少(44%)、血小板减少(9%) 和白细胞减少 (6%),Pd组超过2例患者报告的唯一4级治疗期间出现的不良事件为中性粒细胞减少(19%)和血小板减少(5%)。Dara-Pd组与Pd组超过1例患者报告的唯一5级治疗期间不良事件为感染性肺炎(2% vs 1%)。Dara-Pd组54%的患者及Pd组40%的患者发生了治疗期间出现的严重不良事件,最常见的是肺炎 (15% vs 9%)。
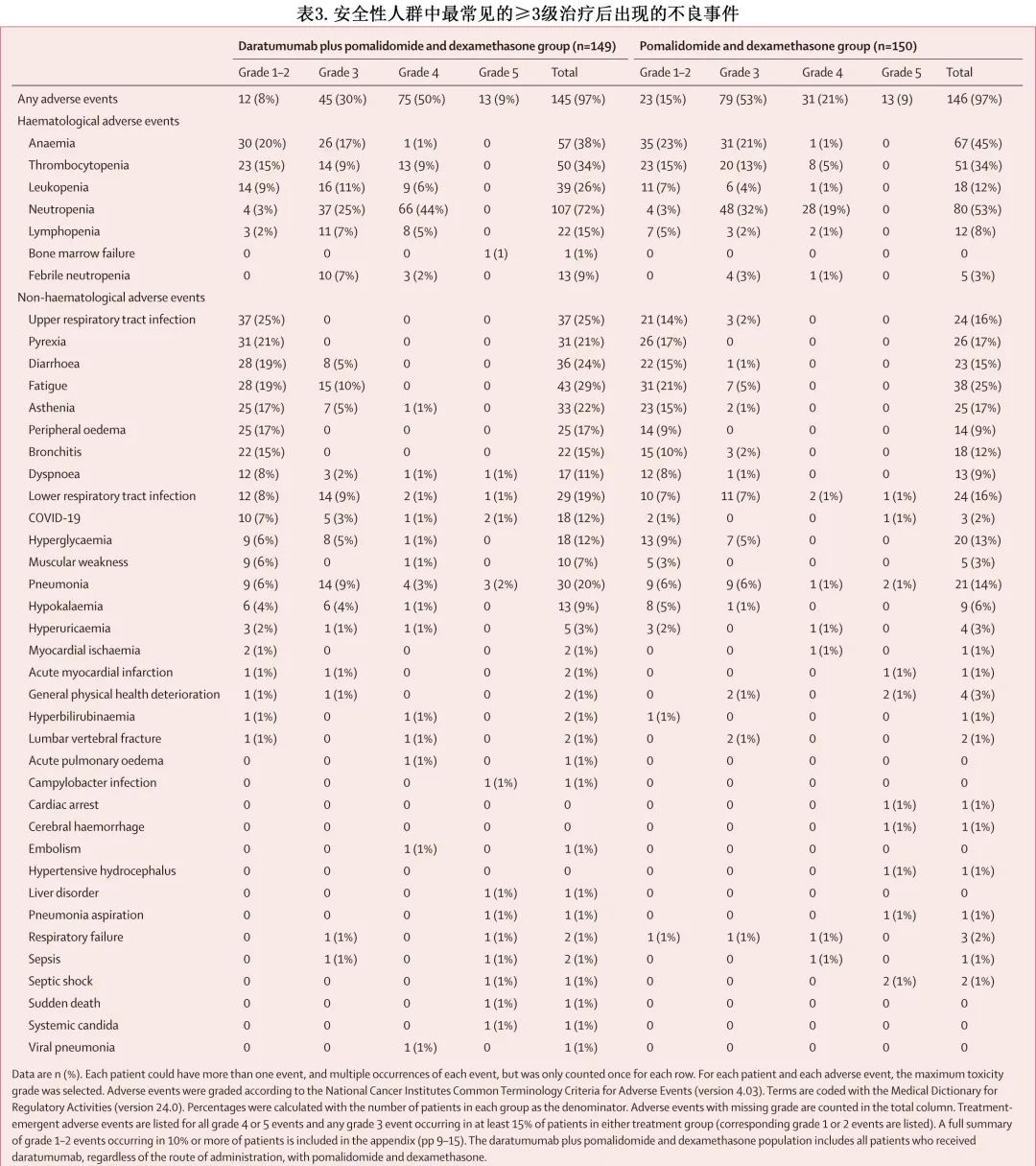
Dara-Pd组(130/149例 [87%])的治疗调整频率高于Pd组(112/150例 [75%])。治疗期间出现的不良事件导致的停药率仍较低,且组间相似(Dara-Pd组3/149[2%] vs Pd组6/150[4%])。每组各有1例患者 (1%) 因感染中止治疗,其中Dara-Pd组的患者感染了脑膜脑炎细菌感染,而Pd组的患者感染了COVID-19。
Dara-Pd组13/149例 (9%) 患者及Pd组13/150例 (9%) 患者发生了导致死亡的治疗期间的不良事件(表3);Dara-Pd组末次治疗给药后30天内发生的4/151例 (3%) 导致死亡的不良事件与研究治疗相关(脓毒性休克 [n=1];脓毒症 [n=1];骨髓衰竭、弯曲杆菌感染和肝脏疾病 [n=1]和肺炎 [n=1]),而Pd组末次治疗给药后30天内导致死亡的不良事件均与研究治疗无关。结局为死亡的最常见的治疗期间出现的不良事件为感染性肺炎(Dara-Pd组3/149[2%] vs Pd组2/150[1%])和COVID-19(2[1%] vs 1[1%])。
随着随访时间的延长,Dara-Pd组4/149(3%)(自初步分析以来有1例新发病例)和Pd组6/150(4%)(自初步分析以来有3例新发病例)报告了第二原发恶性肿瘤(皮肤、侵袭性、血液)。Dara-Pd组149例患者中各有1例 (1%) 报告了胆管癌、恶性黑色素瘤和鳞状细胞癌,而Pd组150例患者中各有1例 (1%) 报告甲状腺肿瘤、恶性黑色素瘤、急性髓性白血病、转移性肾细胞癌。
总结
3期APOLLO研究共纳入304例患者随机分配:151例分配至Dara-Pd组,153例分配至Pd组。中位年龄为67岁;143例 (47%) 患者为女性,161例 (53%) 为男性,272例 (89%) 为白人。中位随访39.6个月,Dara-Pd组的中位总生存期为34.4个月,而Pd组为23.7个月(HR=0.82;p=0.20)。最常见的3-4级治疗期间出现的不良事件为中性粒细胞减少(Dara-Pd组103/149[69%],Pd组76/150[51%])、贫血 (18% vs 21%) 和血小板减少 (18% vs 19%)。Dara-Pd组80/149例 (54%) 患者及Pd组60/150例 (40%) 患者发生了治疗期间的严重不良事件,其中最常见的是肺炎 (15% vs 9%)。Dara-Pd组13/149例 (9%) 患者及Pd组13/150例 (9%) 患者发生了导致死亡的治疗期间的不良事件;Dara-Pd组末次治疗给药后30天内发生的4/151例 (3%) 导致死亡的不良事件与研究治疗相关(脓毒性休克 [n=1];脓毒症 [n=1];骨髓衰竭、弯曲杆菌感染和肝脏疾病 [n=1]和肺炎 [n=1]),而Pd组均无关。
APOLLO研究随访3年以上后,观察到达雷妥尤单抗联合泊马度胺和地塞米松与泊马度胺和地塞米松相比,中位总生存期差异为10.7个月。达雷妥尤单抗+泊马度胺和地塞米松组患者在下一线治疗中的36个月无进展生存率高于泊马度胺和地塞米松组,治疗中出现的不良事件与既往报告的一致。本研究中观察到的10.7个月总生存期差异不显著,可能是因为泊马度胺和地塞米松组患者后续更多接受了CD38单抗治疗(69% vs 10%)以及撤回知情同意的患者更多(14例 vs 5例),但安全性特征以及ALCYONE、MAIA、CASTOR和 POLLUX 研究中含达雷妥尤单抗治疗方案观察到的显著总生存期获益,继续支持达雷妥尤单抗用于多发性骨髓瘤患者。
参考文献
Dimopoulos MA, et al.Subcutaneous daratumumab plus pomalidomide and dexamethasone versus pomalidomide and dexamethasone in patients with relapsed or refractory multiple myeloma (APOLLO): extended follow up of an open-label, randomised, multicentre, phase 3 trial.Lancet Haematol . 2023 Oct;10(10):e813-e824. doi: 10.1016/S2352-3026(23)00218-1.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言