抗体偶联药物药学研究与评价技术指导原则(征求意见稿)
2023-06-21 国家药品监督管理局药品审评中心(CDE) 国家药品监督管理局药品审评中心 发表于加利福尼亚
国家药品监督管理局药品审评中心在结合既往国内已申报ADC产品审评技术要求的基础上,通过前期调研、文件撰写、专家咨询以及部门讨论,形成了《抗体偶联药物药学研究与评价技术指导原则(征求意见稿)》。
抗体偶联药物药学研究与评价技术指导原则(征求意见稿)
2023-06-21
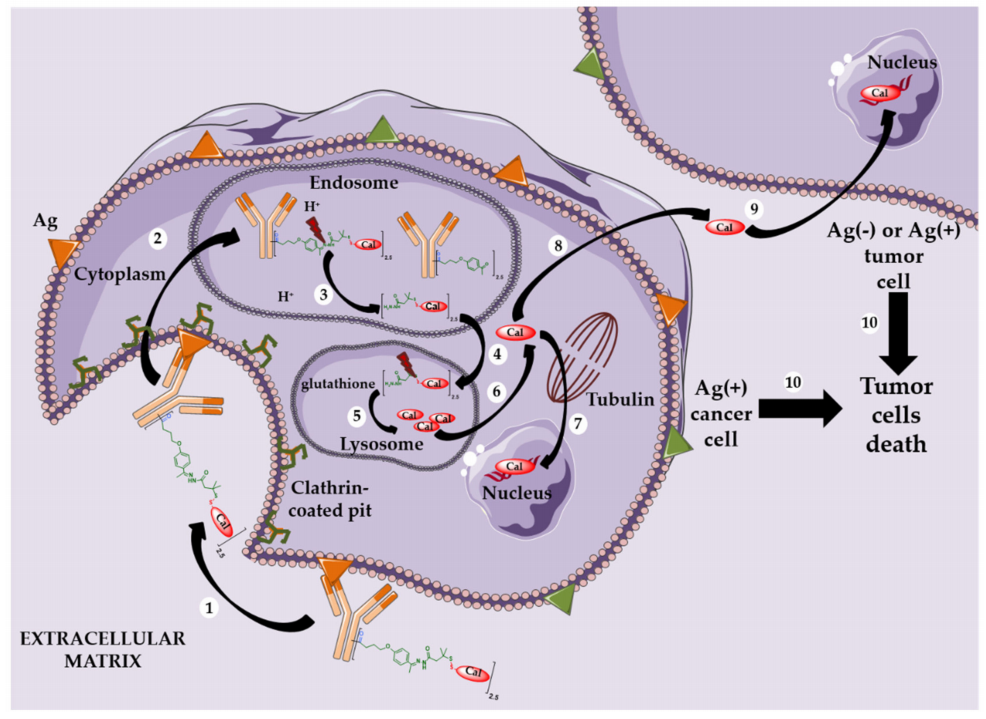
抗体偶联药物(Antibody-Drug Conjugate,ADC)经过一百多年的研发和技术迭代,进入了高速发展阶段。近年来,全球已批准15个ADC药物上市,国内也有1个本土创新ADC药物获批上市,并有数十个ADC药物获批开展临床研究。目前,国内外尚无ADC产品针对CMC部分的指导原则,为规范和指导抗体偶联药物的研发和申报,我中心在结合既往国内已申报ADC产品审评技术要求的基础上,通过前期调研、文件撰写、专家咨询以及部门讨论,形成了《抗体偶联药物药学研究与评价技术指导原则(征求意见稿)》。