德琪医药与Karyopharm Therapeutics正式启动战略合作,正式进军血液肿瘤领域
5月29日,德琪医药(德琪)与纳斯达克上市公司Karyopharm Therapeutics(纳斯达克上市代码:KPTI)(Karyopharm)在上海浦东丽思卡尔顿酒店签署协议,正式启动战略合作,
MedSci - 德琪医药,Karyopharm,therapeutics - 2018-05-29
FDA批准Karyopharm的Xpovio(selinexor)用于治疗多发性骨髓瘤
FDA已批准Xpovio(selinexor)联合硼替佐米和地塞米松用于治疗多发性骨髓瘤成年患者,这些患者至少接受过一种疗法。
MedSci原创 - 多发性骨髓瘤,复发/难治性多发性骨髓瘤,Karyopharm,Xpovio(selinexor) - 2020-12-20
FDA批准Karyopharm的核输出抑制剂Xpovio用于治疗复发或难治的多发性骨髓瘤
Karyopharm Therapeutics宣布FDA批准Xpovio(selinexor)联合地塞米松用于复发或难治性多发性骨髓瘤的成人患者。
MedSci原创 - Karyopharm,核输出抑制剂,Xpovio,多发性骨髓瘤 - 2019-07-04
Karyopharm的口服核出口选择性抑制剂XPOVIO针对多发性骨髓瘤的III期临床试验达到终点
Karyopharm宣布其口服核出口选择性抑制剂XPOVIO(selinexor)针对多发性骨髓瘤的III期BOSTON研究达到终点。
MedSci原创 - Karyopharm,口服核出口选择性抑制剂,Xpovio,多发性骨髓瘤,III期临床试验,达到终点 - 2020-03-05
FDA接受Karyopharm的口服核出口选择性抑制剂XPOVIO的补充新药申请,用于治疗复发或难治的弥漫性大B细胞淋巴瘤
Karyopharm Therapeutics宣布,美国食品药品监督管理局(FDA)已接受其补充新药申请(sNDA)寻求将口服核出口选择性抑制剂XPOVIO(selinexor)片剂,用于先前已接受过至少两种治疗方案的复发或难治的弥漫性大FDA还批准了Karyopharm的优先审查请求。
MedSci原创 - FDA,Karyopharm,Xpovio,补充新药申请,复发或难治的弥漫性大B细胞淋巴瘤 - 2020-02-20
FDA批准首个治疗复发或难治性大B细胞淋巴瘤患者的口服药物:核出口抑制剂XPOVIO
“这项批准标志着XPOVIO成为先前治疗过的DLBCL患者首个获批的口服药物,也是针对这种高度侵袭性淋巴瘤的首个获批的单一药物。”
MedSci原创 - 核出口抑制剂XPOVIO,复发或难治性弥漫性大B细胞淋巴瘤(DLBCL) - 2020-06-23
骨髓瘤治疗新进展,全新作用机制药物Selinexor(ATG-010)三种治疗方案入选最新版NCCN®多发性骨髓瘤诊疗指南
12月15日,德琪医药有限公司(简称“德琪医药”)宣布,美国国家综合癌症网络(NCCN®)在最新版多发性骨髓瘤临床实践指南(NCCN Guidelines®)中添加了三种selinexor(ATG-0
医药魔方 - 多发性骨髓瘤,德琪医药 - 2020-12-16
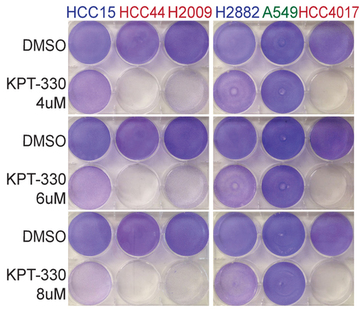
Nature:发现难治性肺癌的致命性弱点
在一项新的研究中,来自美国德州大学西南医学中心四家实验室的研究人员发现所谓的无药可靶向的(undruggable,也译作无药可治的,无药可用的)肺癌的一个弱点,并且发现一种现存的药物可能被用来治疗这种癌症。相关研究结果于2016年9月28日在线发表在Nature期刊上,论文标题为“XPO1-dependent nuclear export is a druggable vulnerability
生物谷 - 难治性肺癌 - 2016-10-05
NEJM:XPOVIO(Selinexor)治疗难治性多发性骨髓瘤的IIb期STORM研究
Karyopharm是一家专注于肿瘤学的制药公司,近日宣布,XPOVIO(Selinexor)治疗难治性多发性骨髓瘤患者的IIb期STORM研究结果已经发表于《新英格兰医学杂志》。
MedSci原创 - 多发性骨髓瘤,Xpovio,selinexor - 2019-08-22
第17届国际骨髓瘤研讨会(IMW):XPOVIO(Selinexor)的最新临床数据将被披露
Karyopharm Therapeutics是一家专注于肿瘤学的制药公司,近日宣布,将在9月12日至15日举行的第17届国际骨髓瘤研讨会(IMW)上发表五篇重点介绍XPOVIO™(selinexor)
MedSci原创 - selinexor,骨髓瘤,Xpovio - 2019-09-16
Chemistry & Biology :靶向Exportin-1的新型抗癌药
一项最新研究发现:基因修饰的癌细胞可以澄清新癌症药物的作用机制。在人类细胞中,细胞核含有我们的DNA,并作为一个“控制中心”,而细胞质充当细胞的“体”。正是在这里,蛋白质得以生成和回收。 但是否蛋白质有活性或无活性依赖于它在细胞中的位置。细胞使用运输系统,以确保蛋白质达到需要它的部位。在健康的细胞中,蛋白质不断地在细胞核和细胞质之间被输送。 在各转运蛋白的协助下,运输进出细
生物谷 - 抗癌药,靶向治疗 - 2015-03-06
Clin Cancer Res:口服Selinexor治疗复发性胶质母细胞瘤
每周一剂塞利尼索 (selinexor) 可诱导复发性胶质母细胞瘤成人患者获得缓解
MedSci原创 - 复发性胶质母细胞瘤,塞利尼索(selinexor) - 2021-11-12
ATG-010(selinexor)完成首例复发难治性外周T和NK/T细胞淋巴瘤患者给药
9月14日,德琪医药宣布口服选择性核输出抑制剂ATG-010(selinexor)用于治疗复发难治性外周T细胞淋巴瘤(PTCL)和NK/T细胞淋巴瘤(NKTL)患者的Ib期临床试验(代号:TOUCH)
医药魔方 - 淋巴瘤,德琪医药,ATG-010 - 2020-09-14
2020年生物医药领域发展趋势预测
2019年,FDA共批准48款创新药,多款first-in-class疗法争相获批,生物类似药快速发展。2019年,医药行业投资热度持续,两起大宗医药并购占据了全年并购金额的2/3,各项技术相继走向成熟,小型药企的临床试验呈现积极结果。步入2020年,生物医药行业将会如何发展,以下五点值得关注。
CPhI制药在线 - 生物医药,发展趋势 - 2020-01-16
最新临床失败、加速评估被撤、用药被限制 诺华最近有点背!
诺华重磅心衰药物Entresto已被批准用于治疗射血分数降低的心力衰竭(HFrEF),该公司一直在努力希望扩大适应症,用于治疗另一种类型的心力衰竭——射血分数保留的心力衰竭(HFpEF)。
新浪医药新闻 - 诺华,临床试验,用药限制 - 2019-07-31
为您找到相关结果约21个