健赞及Isis公司宣布提交HoFH药物KYNAMRO新药申请
2012年3月30日,健赞(Genzyme),赛诺菲(Sanofi)旗下公司,与Isis制药公司今天宣布称,健赞公司已向FDA提交新药申请(New Drug Application,NDA),寻求批准KYNAMRO
生物谷 - 新药,FDA - 2012-04-16
透皮避孕贴片Twirla:已向FDA提交新药申请(NDA)
Agile是一家女性医疗保健公司,近日宣布已向美国食品和药品监督管理局(FDA)重新提交了其主要产品候选药物Twirla®的NDA。Twirla是一种研究性联合低剂量激素的避孕贴片(AG200-15)。
网络 - Twirla,避孕贴片,FDA - 2019-05-18
XenoPort向FDA提交XP23829研究性新药申请
2012年5月24日,XenoPort生物制药公司宣布,已向FDA提交XP23829的研究性新药申请(INDA),用于复发-缓解型多发性硬化症(RRMS)的治疗。
生物谷 - 新药,FDA - 2012-05-28
FDA批准Heron的补充新药申请以扩大CINVANTI的标签
致力于通过开发一流的治疗方法来改善患者的生活,以解决一些最重要的未满足的患者需求,Heron今天宣布美国食品和药品监督管理局(FDA)批准了Heron对CINVANTI(Aprepitant)可注射乳剂的补充新药申请
网络 - Heron,化疗,恶性,呕吐 - 2019-02-27
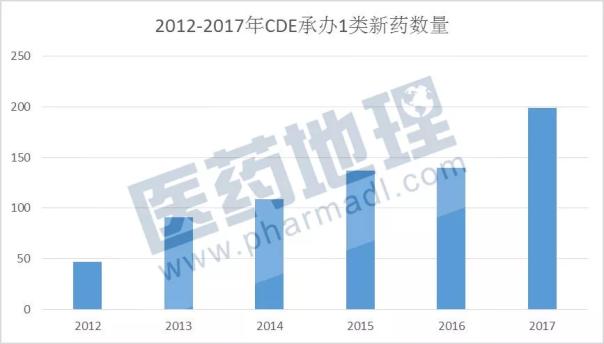
一大波重磅新药申请临床获CDE受理
solanezumab注射液 solanezumab一种抗被淀粉样蛋白单抗,也是礼来现有管线药物中最有“钱景”的一个,若能成功上市,预计2020年将给礼来带来近14亿美元的销售收入。 尽管solanezumab之前的两项 III 期临床研究EXPEDITION1(n=1012)和 EXPEDITION 2(n=1040 )均告失败,均未能改善AD患者的认知和生活自理能力,礼来最终还是决定再
医药魔方数据 - 新药,临床申请 - 2016-06-16
EMA接受辉瑞新药BZA/CE上市许可申请的审查
nbsp;欧洲药品管理局(EMA)表示,已接受对辉瑞(Pfizer)药物BZA/CE(bazedoxifene/conjugated estrogens,bazedoxifene/共轭雌激素)上市许可申请的审查BZA/CE是一种潜在的新药物,用于绝经后女性雌激素缺乏症及具骨折风险的女性骨质疏松症的治疗。辉瑞预计在2013年得到EMA的
生物谷 - 新药,FDA - 2012-07-24
Medivation与Astellas提交前列腺癌药物enzalutamide新药申请
2012年5月23日,Medivation公司及合作伙伴安思泰来(Astellas)公司向FDA提交了实验性前列腺癌药物enzalutamide(又名MDV-3100)的新药申请,并有望在6个月内获得审批此次申请并不出人意料,但对于总部位于旧金山的Medivation公司来说,是重要的一步。2年前,该公司实验性阿尔茨海默氏症药物Dimebon在III期试验中惨遭失败。不过,其前列腺癌药物en
生物谷 - 新药,FDA - 2012-05-24
EMA接受审查阿斯利康新药naloxegol上市许可申请
阿斯利康(AstraZeneca)9月27日宣布,欧洲药品管理局(EMA)已接受审查实验性药物naloxegol上市许可申请(MAA)。
生物谷 - 新药,FDA - 2013-09-30
阿尔茨海默症新药aducanumab上市申请又有新动态
日前,渤健和卫材联合宣布,欧洲药品管理局(EMA)已确认接受阿尔茨海默病研究性治疗药物aducanumab的上市授权申请(MAA),如若获得批准,aducanumab将成为减少阿尔茨海默氏病临床下降的
医谷网 - 阿尔茨海默症,aducanumab,新动态 - 2020-11-03
FDA 受理Momelotinib用于治疗骨髓纤维化的贫血新药申请
根据 3 期 MOMENTUM 试验的结果,FDA 已经接受了用于骨髓纤维化患者的 momelotinib 新药申请。
MedSci原创 - 贫血,骨髓纤维化,momelotinib - 2022-08-25
FDA接受了全球首个早衰症治疗药物Zokinvy的新药申请
Zokinvy是法呢基转移酶的口服抑制剂,通过阻断早老蛋白的法尼基化来发挥作用。
MedSci原创 - 早衰症,Zokinvy(lonafarnib) - 2020-06-03
肺病新药Bevespi Aerosphere®3期试验结果积极,明年申请中国上市
阿斯利康(AstraZeneca)近日公布了Bevespi Aerosphere® 的3期临床试验PINNACLE 4的积极顶线结果。结果显示,通过测量患者一秒钟的强制呼气量( FEV1),Bevespi Aerosphere®(格隆铵14.4 微克+富马酸福莫特罗9.6微克)与其单药成分和安慰剂相比,可以显着改善慢性阻塞性肺病(COPD)患者的肺功能。根据PINNACLE 4以及以前的试验数据,
药明康德 - 阿斯利康,Bevespi,Aerosphere®,慢性阻塞性肺病 - 2017-12-07
FDA已接受ONC206的研究性新药申请(IND)
Oncoceutics制药公司近日宣布,美国FDA已接受该公司的ONC206的研究新药申请(IND),允许对该化合物进行首次人体试验。
MedSci原创 - ONC206,研究性新药申请,FDA - 2019-08-27
Gabapentin口服液仿制药新药申请获得美FDA批准
Acella医药公司Gabapentin口服液仿制药申请(ANDA)获得美国食品药监局(FDA)批准。 FDA发现Acella仿制药申请的生物等效性上和治疗效果,和推荐药的是一样的。
中国医药123网 - 新药,FDA,Gabapentin - 2012-05-06
为您找到相关结果约500个