药物临床试验的一般考虑指导原则
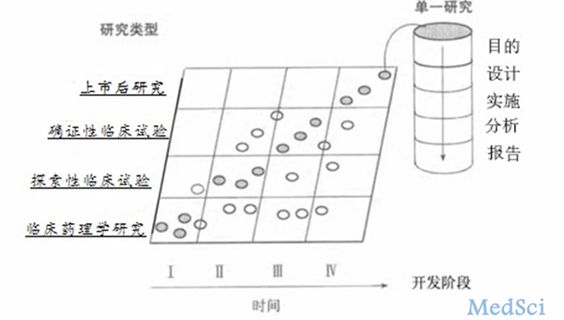
药物临床试验的一般考虑指导原则一、概述药物临床试验的一般考虑指导原则(以下称指导原则),是目前国家食品药品监督管理总局关于研究药物在进行临床试验时的一般考虑。制定本指导原则的目的是为申请人和研究者制定药物整体研发策略及单个临床试验提供技术指导,同时也为药品技术评价提供参考。另外,已上市药品增加新适应症等进行临床试验时,可参照本指导原则。本指导原则主要适用于化学药物和治疗用生物制品。二、临床试验
CFDA - 临床试验,指导原则 - 2018-01-10
CFDI最新分享了核查中发现的常见问题总结,探讨了新形势下申办方的应履职责
从药物临床试验数据核查看申办者的职责履行情况 作者:高荣王安娜唐静方翔王佳楠 国家药品监督管理局食品药品查验中心 来源:中国新药杂志 2019 年第 28 卷第 8 期摘要:申办者作为药物临床试验的发起组织者、经费提供者和试验监查者,在药物临床试验中发挥着至关重要的作用。本文根据《药物临床试验质量管理规范》(GCP)的相关规定及药物临床试验监督检查新形势下对申办者的职责要求,结合药物临床
网络 - 药物临床试验,药物临床试验质量管理规范,数据核查,申办者,职责 - 2019-06-09
证候类中药新药临床研究技术指导原则发布
11月6日,国家药监局官网更新关于发布证候类中药新药临床研究技术指导原则的通告(2018年第109号)。为继承和发扬中医药诊疗特色和优势,完善符合中药特点的技术评价体系,落实《药品注册管理办法》《中药注册管理补充规定》的相关规定,国家药品监督管理局组织制定了《证候类中药新药临床研究技术指导原则》,现予发布附件:1.证候类中药新药临床研究技术指导原则证候(简称证)是对疾病(泛指非健康)发展到一
新浪医药新闻 - 证候类中药 - 2018-11-07
临床研究统计学中常见的“坑”
随机对照临床试验(Randomized Controled Trial, RCT)是常见的重要的循证医学证据,为临床诊治提供重要依据。在临床试验设计中,专业设计和统计学设计都很重要。统计学设计包括:确
网络 - 统计 - 2020-03-16
临床研究电子管理公共平台(ResMan)介绍
基于互联网的临床研究电子管理公共平台(Research Manager, ResMan)一、什么是临床试验电子管理公共平台?临床研究电子管理公平台(Research Manager, ResMan)是指将临床试验的管理流程及试验过程中记录的受试者基线资料包括人口学资料和入组时检查的基线数据、试验过程中的实施情况、结果数据等相关资料即“临床试验病例记录表(case record form, CR
MedSci原创 - ResMan,临床研究 - 2013-09-24
如何开展新药临床试验:从GCP,SOP到临床试验管理和质量控制
GCP的原则与内容 GCP(Good Clinical Practice),即药物临床试验质量管理规范,它是临床试验过程的标准规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告。其目的是保证药品临床试验过程规范,结果科学可靠,保护受试者的权益并保障其安全。 一、GCP的发展过程 19世纪末化学制药工业的兴起,开创了化学药品开始用于临床治疗的新纪元。
上海交通大学医学院附属第九人民医院 - 新药,临床试验 - 2015-07-04
临床新药研究的若干统计问题
临床研究的设计 (一) 专业原则(统计前提) 一、医学论理学 起步-发展-重视,SOP 二、研究基础 研究者手册、文献资料、毒性、疗效、ADR 三、目的明确 方案合理,疗效提高,提高,ADR减少 四、一致性检验
临床研究,统计 - 2011-12-10
NMPA临床试验技术指导原则汇总
总的官方查询链接:点击查询总体原则:临床试验的一般考虑指导原则的通告(2017年第11号)总局关于发布药物临床试验的一般考虑指导原则的通告(2017年第11号) (2017-01-20)
MedSci原创
-
临床试验,技术,指导原则
-
2018-11-07
NMPA:抗抑郁药的药物临床试验技术指导原则(2018年第39号)
一、概述 治疗抑郁症(Major Depressive Disorder,MDD)的药物(以下简称抗抑郁药)是全球药物研发的热点领域之一。在我国,抗抑郁药研发方兴未艾,但在临床试验设计和实施中存在诸多问题。为更好地鼓励我国抗抑郁药的创新研发,提高新药研发的质量和效率,特制订本指导原则。本指导原则主要适用于在我国研发的抗抑郁创新药,着重对确证性临床试验设计的考虑要点提出建议,供药物研发的申
MedSci原创 - 抑郁,临床试验 - 2018-11-07
临床试验常见问题
一、课题负责人/主要临床研究者的职责 ? 准备研究方案 ? 确定CRF和需要记录问题的设计 ? 提出统计分析要求 ? 定期访问个参加试验的分中心,监督研究进展 ?&nbs
MedSci原创 - 试验 - 2013-04-16
确证性临床试验中数据缺失的处理指南
1 前言 确 证性临床试验是在探索性临床试验基础上,通过开展多中心临床试验,进一步确证药物临床疗效,为获得上市许可获得充足证据。该阶段试验通常要求纳入较多的样 本例数,设计随机双盲对照试验,并在此基础上进行数据统计以客观评价新药疗效。然而,受各种因素影响,在确证性临床试验中出现数据缺失是不可避免的,例 如:患者拒绝继续研究、治疗失败/成功或出现不良事件导致退出试验、患者移居,以及观测指标
中国新药杂志 - 临床试验,数据缺失 - 2014-08-09
临床试验中缺失数据的预防与处理
缺失数据在临床试验中是非常常见且不可避免的。它一般是由于受试者在试验中失访、依从性差、不良事件、缺乏疗效等原因提前退出试验而造成,也可能是因为采集标本或测量中的问题,如疫苗临床试验中因采取的血液样本过少而未能检测到有效的抗体滴度值所造成的疗效指标缺失等缺失数据不仅会降低试验的把握度,而且会给试验结果的评价带来偏倚。因此,一方面,在数据统计分析时,采用适当的统计分析方法提高试验的检验效能,减小
药学学报 - 缺失,数据 - 2017-05-12
中国临床医学真实世界研究施行规范
前言真实世界研究(real world study,RWS)是指在真实临床、社区或家庭环境下,获取多种数据, 从而评价某种治疗措施对患者健康真实影响的研究[1]。RWS包括观察性RWS和试验性RWS,并具有如下特点:相比于随机对照研究(randomized control trial,RCT),RWS的纳入人群均为临床实际的患者群体,对患者的病情限定较宽泛,覆盖人群广
中华实验和临床感染病杂志(电子版) - 真实世界研究,规范 - 2017-12-26
2015 小儿急性上呼吸道感染中药新药临床试验设计与评价技术指南
指南从研究背景、研究目标、总体设计、诊断标准、受试者的选择、给药方案、安全性评价、有效性评价、试验流程、数据管理与统计分析、质量保证、相关伦理学要求、试验结束后的医疗措施、资料保存等方面阐述了小儿急性上呼吸道感染中药新药临床试验的设计与评价技术要点,期望能为申办者与研究者在临床试验方案设计中提供指导。
药物评价研究.2015,38(2):8-16. - 感染 - 2015-02-08
2015 小儿急性支气管炎中药新药临床试验设计与评价技术指南
本指南从研究背景、研究目标、总体设计、诊断标准、受试者的选择、给药方案、安全性评价、有效性评价、试验流程、数据管理与统计分析、质量保证、相关伦理学要求、试验结束后的医疗措施、资料保存等方面阐述了小儿急性支气管炎中药新药临床试验的设计与评价技术要点,期望能为申办者与研究者在临床试验方案设计中提供指导。
药物评价研究.2015,38(2) - 小儿急性支气管炎 - 2015-03-09
为您找到相关结果约500个