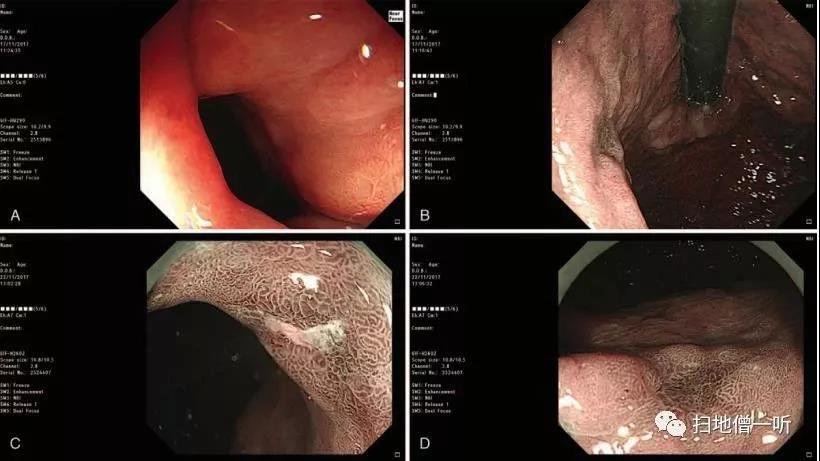
罕见病例 | 同时性双原发胃癌伴深在性囊性胃炎及黏膜下脂肪瘤
同时性双原发胃癌(混合胃肠黏液表型)伴深在性囊性胃炎(gastritis cystica profunda,GCP)及黏膜下脂肪瘤是一种罕见的疾病,发病机制尚不清楚,诊断和治疗难度较大。
扫地僧一听 - 同时性,双原发,胃癌,深在性,囊性,胃炎,黏膜下,脂肪瘤 - 2019-04-15
国家药监局综合司公开征求《药物临床试验机构监督检查办法(试行)(征求意见稿)》意见
为进一步规范药物临床试验机构监督检查工作,加强药物临床试验管理,国家药监局组织起草了《药物临床试验机构监督检查办法(试行)(征求意见稿)》,现公开征求意见。
国家药监局综合司 - 药物临床试验 - 2023-07-04
J Clin Oncol:吉非替尼 vs 吉非替尼+卡铂+培美曲塞治疗EGFR突变的非小细胞肺癌
与单独使用吉非替尼相比,GCP方案明显改善了EGFR突变的非小细胞肺癌患者的无进展生存预后
MedSci原创 - 吉非替尼,EGFR突变型非小细胞肺癌,卡铂+培美曲塞 - 2022-08-17
何严:基因编辑婴儿事件后 临床招募该何处去
近日,一则“基因编辑婴儿”的新闻一石激起千层浪,迅速成为各大媒体的头版头条,进而引发全球科学家和伦理学家的关注。贺建奎在接受采访时称,自己通过北京的艾滋病权益组织“白桦林”招募到了参加实验的夫妇。而该公益组织创始人对记者表示:“我感觉挺冤枉的,有种被欺骗的感觉。招募启事发布两个月后,有100多个意向者联系我们,经过我的初步筛选,我留下了其中50个,然后把这些人的微信推给贺建奎的团队。”
健康号 - 基因编辑,婴儿事件,临床招募 - 2018-11-30
Braz Oral Res:牙周炎对口腔健康相关生活质量的影响
研究共纳入52例患有侵袭性牙周炎(AP)或慢性牙周炎(CP)的患者:9例局限性侵袭性牙周炎(LAP),33例广泛侵袭性牙周炎(GAP)和10例广泛性慢性牙周炎(GCP)。
MedSci原创 - 2018-03-03
【英文】E6(R3):药物临床试验质量管理规范(原则及附件1草案)
E6(R3)指导原则及附件1英文原文和中文译文见附件,现就该指导原则内容及中文译文向社会公开征求意见。
国家药品监督管理局药品审评中心 - 药物临床试验 - 2023-07-09
国家药监局药审中心关于发布《临床试验中的药物性肝损伤识别、处理及评价指导原则》的通告(2023年第39号)
本指导原则仅代表药品监管部门当前的认识和观点,不具有强制性法律约束力。随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
国家药品监督管理局药品审评中心 - 临床试验,药物性肝损伤 - 2023-07-10
中文】E6(R3):药物临床试验质量管理规范(原则及附件1草案)
E6(R3)指导原则及附件1英文原文和中文译文见附件,现就该指导原则内容及中文译文向社会公开征求意见。
国家药品监督管理局药品审评中心 - 药物临床试验 - 2023-07-09
GMP等认证将取消 落地后如何监管?
近日,有消息称,国家食品药品监督管理总局副局长吴浈在刚刚结束的全国食品药品监督管理工作座谈会上提出,今后取消GMP、GCP、GLP、GSP,实现两证合一,不再发认证证书。
E药经理人 - GMP,GSP,CFDA,认证取消 - 2017-08-01
药物临床试验研究参与者知情同意权的保护
知情同意权是药物临床试验中研究参与者的基本权利,国际条约与国内法律法规相继形成了基本的权利保护框架,但目前仍存在规范设置不健全、实务操作不完善等问题。为应对未来挑战,需要进一步完善立法、规范告知程序、
中国医学伦理学 - 药物临床试验,伦理审查,知情同意权 - 2023-10-10
韩雅玲:临床研究的指导原则(视频)
在第十届中国介入心脏病学大会上,沈阳军区总医院韩雅玲教授在第四届临床研究专题研讨峰会上介绍了临床研究的指导原则,包括药物临床试验质量管理规范(GCP)、人体试验委员会(IRB)、知情同意、培训等内容韩教授指出,临床研究是以人为研究对象,其结果应用于人,首先应严格遵守赫尔辛基宣言,并遵循GCP。GCP是临床试验全过程的标准规定,包括方案设计、组织实施、监察、稽查、记录、分析总结和
MedSci原创 - 临床研究 - 2012-06-26
新药临床试验中遇到的100个问题(上)
1、什么是 GCP? GCP(Good Clinical Practice)中文译为“药品临床试验管理规范”,它是一种对涉及人类受试者的临床试验的设计、实施、记录及报告的国际性道德和科学质量标准。
佰荣泰华 - 临床试验,新药 - 2017-04-25
SOP(中英文对照)
1.3 STANDARD OPERATING PROCEDURES 标准操作程序 One of the requirements of GCP is that sponsors and any
SOP - 2010-07-14
临床试验数据管理之数据记录
一.数据记录的作用 记录是安全性、有效性的评价和报告依据,也是遵循GCP的证据, 只有存在记录: 1.才能证明相关行为发生过; 2.才能在发生任何问题时追根溯源; 3.才能证明试验是严格按照GCP、
MedSci原创 - 数据管理 - 2012-12-13
为您找到相关结果约321个