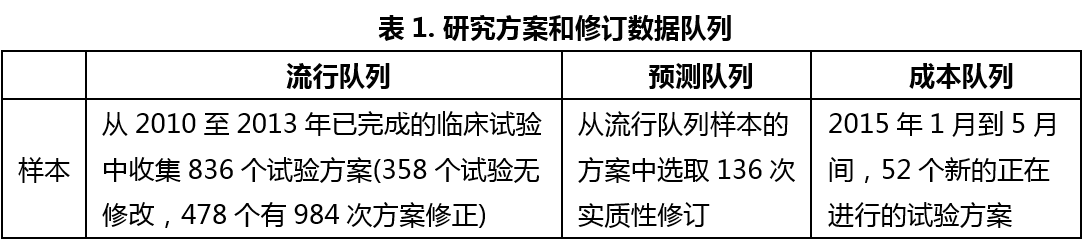
临床试验方案修订对临床试验结果和费用的影响
临床试验方案是保证临床试验顺利有序开展的前提,其一经制订并批准就应严格执行。在实际的临床试验开展过程中,有时对临床试验方案确有必要进行修订。但是,如果修订不够谨慎的话,就可能影响到试验结果、试验周期和试验经费。长期以来,对于制药公司和CRO公司而言,因临床试验方案的修订而导致的计划外的推迟、中断和花费都是很大的挑战。
国际药品检查动态研究 - 试验方案,修订 - 2019-12-26
临床试验用药品(试行)
根据《药品生产质量管理规范(2010年修订)》第三百一十条规定,现发布《临床试验用药品(试行)》附录,作为《药品生产质量管理规范(2010年修订)》配套文件,自2022年7月1日起施行。
国家药品监督管理局官网 - 临床试验 - 2023-06-10
ASCO2017:溶瘤病毒临床试验客观缓解率荟萃分析
溶瘤病毒疗法对于实体瘤具有显著的抗肿瘤效果,目前疱疹病毒和柯萨奇病毒表现出最佳的临床效果
MedSci原创 - 肿瘤免疫,溶瘤病毒,客观缓解率 - 2017-06-06
JACC:各中心入组例数差异影响临床试验结果分析
一项针对EVEREST试验(加压素治疗心力衰竭疗效:托伐普坦转归研究)进行的分析表明,纳入较多和较少受试者的中心之间基线特征、试验方案和患者转归显著不同,提示每个中心纳入的受试者数量可能影响试验结果
JACC - 临床试验,心脏病,受试者 - 2012-12-14
早期临床试验扩展至统计分析计划内容指南
本文报告了早期临床试验统计分析计划内容的指南,确保了最低报告分析要求的规范,在各利益相关者审查后详细说明了对现有指南的扩展(11 个新项目)和修改(25 个项目)。
BMJ. 2022; 376: e068177 - 早期临床试验 - 2022-06-15
临床试验设计时需关注的问题(两个案例分析)
MedSci说明:临床试验设计是临床试验的核心问题,如果设计考虑不周,可能会导致临床试验的失败,或需要大量的重复试验或补充试验,减慢临床试验进程,提高临床试验的费用。因此,及时跟踪国际研究动态,在临床试验中考虑到各种潜在的风险,并进行有效监测,从而提高临床试验的成功率。
临床试验,设计 - 2011-12-10
中国CDE临床试验登记与信息公示平台:常见问题分析
2013年9月6日,国家食品药品监督管理总局发布2013年第28号公告,要求“凡获国家食品药品监督管理总局临床试验批件并在我国进行临床试验(含生物等效性试验、药代动力学试验、I、Ⅱ、Ⅲ、Ⅳ期试验等)的,均应登陆信息平台,按要求进行临床试验登记与信息公示”。本平台按照上述公告执行试验登记的各项要求,包括要求登记试验的范围和类型、登记时间等。在“药物临床试验登记与信息公示”平台(w
MedSci原创 - 临床试验,登记,信息,公示 - 2016-03-21
揭露临床试验数据内幕
近日,一系列临床试验敏感数据的公开计划使制药公司、药物监管机构与研发团队们陷入了僵局。然而就在这场“斗争”似乎即将白热化时,一项研究揭示了为什么这些保密资料对于研究者而言是极其重要的。这项研究的分析结果表明,大多数公开的临床试验数据都缺少一些至关重要的信息(例如死亡率与严重的副作用)。但是这些信息却通常能在制药行业制定的、非公开化的标准文件中找到,而这类文件被称为临床研究报告(
生物探索 - 临床试验数据 - 2013-10-29
临床试验也能做公益?
有数据显示,近年来随着国家对生物医药技术创新领域的投入不断加大,药品生产企业及科研单位研发新药的热情日益高涨,我国每年所做的药物临床试验的数量以40%的惊人速度增加,我国正日益成为全球临床试验服务中心。然而与企业和科研单位高涨的热情相比,我国患者参与临床试验的程度的不高,其中的原因:(1)由于患者对临床试验不了解担心患者招募的安全性,(2)患者想参与临床试验,但缺乏途径。仔细分析其中的原因就是临床
MedSci原创 - 2017-07-18
临床试验有关SOP汇总
临床试验方案修改SOP1. 申办者(包括药厂、CRO等)向中心药物临床试验办公室提出修改申请,填写“药物临床试验修改申请表”。2.提供资料,包括:药物临床试验前研究资料,含试验药物的化学、药学、毒理学、药理学和临床的(包括以前的和正在进行的试验)资料和数据、研究者手册、试验药品药检报告、申办者资质证明、SFDA药物临床试验批文、试验方案和知情同意书药物临床试验办公室根据
MedSci原创 - 临床试验,SOP - 2014-03-28
临床试验常见问题
一、课题负责人/主要临床研究者的职责 ? 准备研究方案 ? 提出统计分析要求 ? 定期访问个参加试验的分中心,监督研究进展 ?&nbs
MedSci原创 - 试验 - 2013-04-16
临床试验中的自查
自从15年起国家局对临床试验的一大波动作之后,对临床试验行业的震慑力不用言语,首先是一小批项目被查出数据质量问题公示了,之后是各省局纷纷召集业界开会,一大批项目的自查四起,一时间医院机构神兵降临、烽烟
Clinical Discovery - 2020-03-29
CCTS 专家共识:临床试验统计分析计划及统计分析报告的考虑 2015
统计分析计划( statistical analysis plan,SAP) 是对 临床试验的统计学考虑及拟对数据进行统计分析的清 晰描述。统计分析计划可以是独立的文件,其内容涵 盖试验中所涉及的所有统计学考虑,且具有技术性和 可操作性,包括了设计的类型、比较的类型、随机化与 盲法、主要指标和次要指标的定义与测量、检验假设、 数据集的定义、疗效及安全性评价和统计分析的详细 计划。
CCTS,统计 - 2015-06-17
如何开展新药临床试验:从GCP,SOP到临床试验管理和质量控制
GCP的原则与内容 GCP(Good Clinical Practice),即药物临床试验质量管理规范,它是临床试验过程的标准规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告。其目的是保证药品临床试验过程规范,结果科学可靠,保护受试者的权益并保障其安全。 一、GCP的发展过程 19世纪末化学制药工业的兴起,开创了化学药品开始用于临床治疗的新纪元。
上海交通大学医学院附属第九人民医院 - 新药,临床试验 - 2015-07-04
为您找到相关结果约500个