快速缓解抑郁的口服新型药物——舒拉诺龙获FDA优先审评资格
目前,全球范围内约每8人中就有1人罹患精神疾病。其中,抑郁症是最常见的精神疾病之一,全球约2.8亿患者。与此同时,近2/3抑郁症患者无法从现有疗法中获得充分缓解。这反映出以抑郁症为代表的精神卫生问题面
MedSci原创 - 抑郁症,产后抑郁,舒拉诺龙 - 2023-02-07
降低肿瘤转移和死亡风险近60%,前列腺癌新药获优先审评资格
拜耳(Bayer)公司和Orion公司宣布,美国FDA接受了该公司为雄激素受体(AR)拮抗剂darolutamide递交的新药申请(NDA),用于治疗非转移性去势抵抗性前列腺癌(nmCRPC)患者。
药明康德 - 拜耳,雄激素,前列腺癌 - 2019-04-30
阿斯利康达格列净治疗慢性肾病适应症获FDA优先审评资格
1月6日,阿斯利康SGLT2(钠-葡萄糖协同转运蛋白2)抑制剂达格列净上市申请获FDA优先审评资格,用于治疗成人新确诊或恶化的慢性肾病(CKD),无论这些患者是否患有2型糖尿病(T2D)。达格列净有可
医药魔方 - FDA,阿斯利康,达格列净 - 2021-01-10
国产14价宫颈癌疫苗拟纳入优先审评,药审中心:上市尚早
日前,国家药品审评中心官网的一纸公文,让国产14价宫颈癌疫苗的存在为人所知。这份原国家食药监总局第27批拟纳入优先审评程序药品名单中,包括国产重组14价人乳头瘤病毒(HPV)疫苗、13价肺炎球菌多糖结合疫苗等26种药品。“这种创新的药物研发申请临床就给它优先。”
澎湃新闻 - 国产,宫颈癌,评审 - 2018-04-01
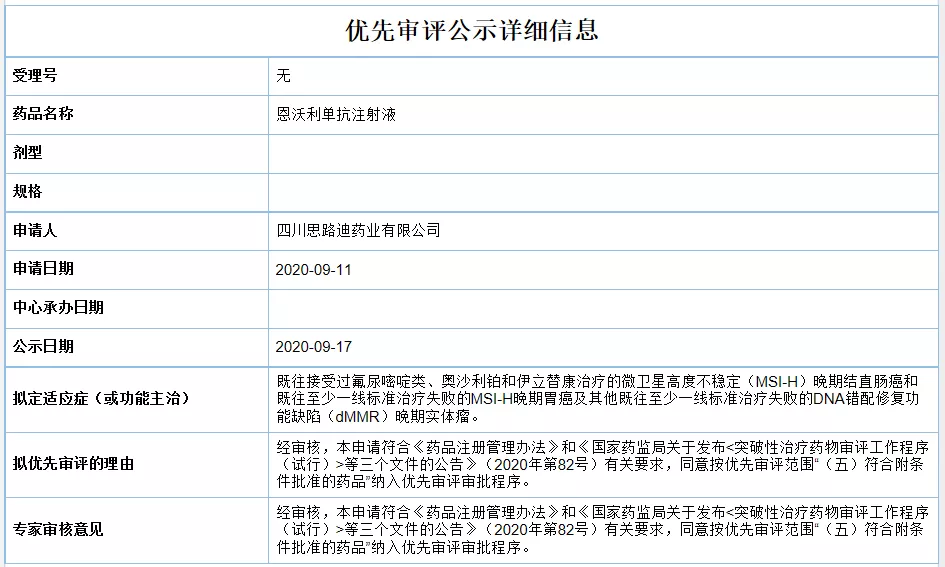
首个皮下注射PD-L1在中国申报上市,拟优先审评
9月17日,思路迪药业恩沃利单抗注射液上市申请拟纳入优先审评,用于既往接受过氟尿嘧啶类、奥沙利铂和伊立替康治疗的微卫星高度不稳定(MSI-H)晚期结直肠癌和既往至少一线标准治疗失败的MSI-H晚期胃癌
医药魔方 - 晚期胃癌,PD-L1 - 2020-09-19
百时美施贵宝血液病创新药Luspatercept上市申请获CDE优先审评
2021年2月4日,百时美施贵宝中国宣布,其红细胞成熟剂Luspatercept(英文商品名Reblozyl;自拟中文通用名:注射用罗特西普;自拟中文商品名:利布洛泽)的上市申请已获CDE正式受理。
MedSci - 血液病,luspatercept - 2021-02-04
基石药业RET抑制剂普拉替尼中国上市申请获受理并纳入优先审评
近日,中国国家药品监督管理局(NMPA)正式受理普拉替尼(Pralsetinib)胶囊的上市申请并纳入优先审评,用于治疗经含铂化疗的RET融合阳性的非小细胞肺癌(NSCLC)患者。
医药魔方 - 审评,基石药业,受理 - 2020-09-06
诺和诺德正式提交「口服索马鲁肽」上市申请,并动用优先审评券
诺和诺德为此项申请还使用了优先审评券,使得该申请的审批周期缩短至6个月。该申请走标准审评程序,审批周
医药魔方 - 诺和诺德,索马鲁肽,GLP-1,糖尿病 - 2019-03-21
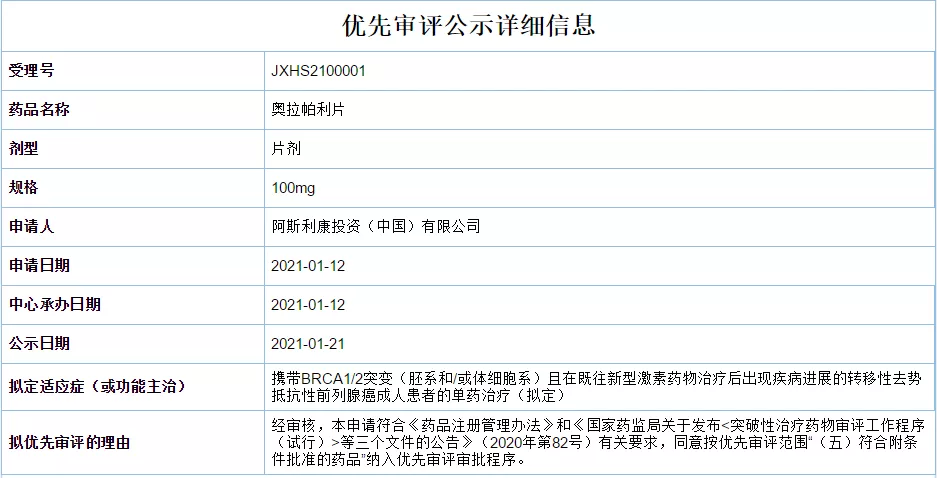
奥拉帕利新适应症上市申请拟纳入优先审评,治疗前列腺癌
1月21日,CDE官网显示阿斯利康奥拉帕利片新适应症上市申请拟纳入优先审评,单药用于治疗携带BRCA1/2突变(胚系和/或体细胞系)且在既往新型激素药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌成人
医药魔方 - 奥拉帕利 - 2021-01-22
奥希替尼新适应症上市申请获FDA优先审评资格
阿斯利康宣布FDA接受其提交的奥希替尼补充新药申请(sNDA),并授予优先审评资格,用于对接受过完全肿瘤切除术的早期(IB、II和IIIA期)表皮生长因子受体突变(EGFRm)非小细胞肺癌(NSCLC
医药魔方 - FDA,中枢神经系统,优先审评 - 2020-11-04
纳入优先审评!恒瑞医药创新药吡咯替尼新适应症——新辅助治疗
近日,恒瑞医药创新药马来酸吡咯替尼片联合曲妥珠单抗加多西他赛用于表皮生长因子受体 2(HER2)阳性早期或局部晚期乳腺癌患者的新辅助治疗的注册申请获国家药品监督管理局受理,被国家药品监督管理局药品审评
恒瑞医药 - 吡咯替尼 - 2021-09-26
罗氏的PD-L1单抗获优先审评权,有望今年9月获批上市
FDA对膀胱癌治疗单抗药物atezolizumab的审评开绿灯,罗氏有望在今年秋季拿到新药批文。罗氏在声明中说,FDA监察员已经接受了公司的BLA申请,并且表示会对atezolizumab用于治疗膀胱癌某些患者的申请进行优先审批。
生物谷 - 罗氏,PD-L1,单克隆抗体,百时美施贵宝,默沙东,阿斯利康 - 2016-03-21
我国首个第三代EGFR抑制剂马来酸艾维替尼进入优先审评
8月9日,国家食品药品监督管理总局药品审评中心(CDE)发布公告,杭州艾森医药研究有限公司自主研发的马来酸艾维替尼被纳入新药上市优先审评程序。
美通社 - EGFR抑制剂 - 2018-08-10
CDE发布了《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见
本周五,CDE发布关于《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见的通知,对突破性治疗药物工作程序和优先审评审批工作程序做了说明。突破性治疗药物程序、附条件批准程序、优先审评审批程序、特别审批程序是为我国鼓励创新和满足临床急需而设立的四个加快通道。其中,突破性治疗药物程序定位于药品临床试验研制阶段;优先审评审批程序定位于药品上市注册阶段。 这让人不禁联想到美国FDA的四种加快
网络 - CDE,突破性治疗药物 - 2019-11-09
为您找到相关结果约500个