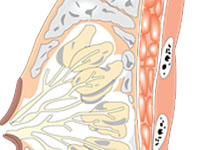
阿斯利康向CFDA提交便秘新药linaclotide上市申请,将成中国首个IBS-C处方药!
Ironwood与合作伙伴安斯泰来(Astellas)近日宣布,已向日本卫生劳动福利部(MHLW)提交便秘新药linaclotide(利那洛肽)的上市申请,寻求批准用于便秘型肠易激综合征(IBS-C)成人患者的治疗
生物谷 - 安斯泰来,阿斯利康,便秘,linaclotide,利那洛肽 - 2016-03-02
FDA重新启动针对AD04研究性新药申请的审核
酒精使用障碍(AUD)是一种精神障碍,具有多病因的慢性疾病,与多种的躯体和精神后遗症有关。耐受、戒断、饮酒行为的控制力受损以及不顾不良后果而持续饮酒是酒精依赖的一些重要常见特征。
MedSci原创 - 酒精使用障碍,AD04,酗酒成瘾 - 2020-10-22
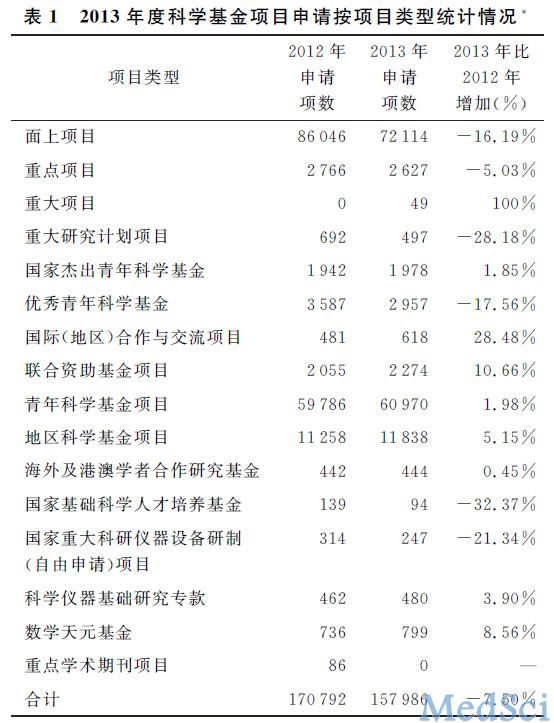
2013年度国家自然科学基金项目 申请与评审工作综述
2013年,国家自然科学基金保持面上项目、青年基金和地区基金三类项目资助经费占总资助经费的比例达70%以上;增强了科学部重点项目和重大项目的调控能力,科学部可以根据实际需求调整重点、重大项目的经费比例;加强了对青年科学基金和国际合作研究项目的支持,更加注重对探索创新性、关键技术培育性科研仪器的资助。科学基金各类项目总体上保持了稳定支持态势。
MedSci原创 - 基金,申请 - 2014-01-08
默克向FDA申请,将Belsomra用于治疗阿尔茨海默氏症患者的睡眠障碍
默克公司向FDA申请批准其失眠药物Belsomra的新适应症,用于治疗轻度至中度阿尔茨海默氏病患者的睡眠障碍。
MedSci原创m - 默克,FDA,Belsomra,阿尔茨海默氏症,睡眠障碍 - 2020-02-04
免疫球蛋白Octagam治疗严重COVID-19患者:FDA已批准研究性新药申请
Octagam是一款人免疫球蛋白液体制剂,用于治疗成人慢性免疫性血小板减少性紫癜(ITP)。
MedSci原创 - 免疫球蛋白,Covid-19,Octagam - 2020-05-21
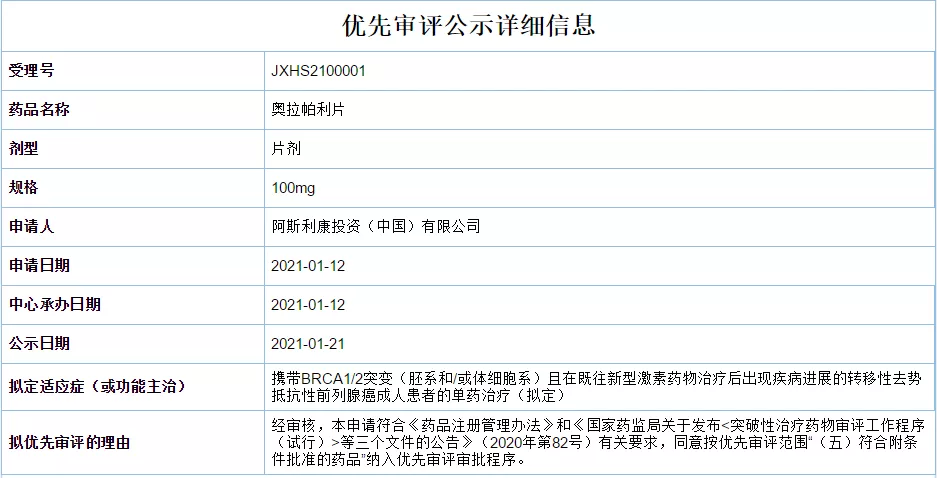
奥拉帕利新适应症上市申请拟纳入优先审评,治疗前列腺癌
1月21日,CDE官网显示阿斯利康奥拉帕利片新适应症上市申请拟纳入优先审评,单药用于治疗携带BRCA1/2突变(胚系和/或体细胞系)且在既往新型激素药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌成人
医药魔方 - 奥拉帕利 - 2021-01-22
FDA批准胃食管反流病第一个仿制药物Nexium上市申请
近日,美国FDA批准了第一个AstraZeneca质子泵抑制剂的仿制药物Nexium。FDA指出,埃索美拉唑胶囊也批准用于降低与类固醇抗炎药相关的胃溃疡风险,联合某些抗生素一起治疗幽门螺杆菌感染,同时治疗胃酸过多,包括佐林格-埃利森综合征。 美国食品药品监督管理局(FDA)已经批准了第一个AstraZeneca质子泵抑制剂的仿制药物Nexium(埃索美拉唑镁缓释胶囊),将它用于治疗成年人和≥1岁
药品资讯网 - 胃食管反流病 - 2015-01-28
Alynlam的RNAi药物lumasiran治疗原发性高草酸尿症,完成向欧盟和美国的申请
如果获得批准,lumasiran将成为1型原发性高草酸尿症(PH1)患者的首个治疗药物。
MedSci原创 - Alnylam,1型原发性高草酸尿症(PH1),RNAi药物lumasiran - 2020-04-08
欧洲药品管理局(EMA)接受曲妥珠单抗生物仿制药营销授权申请
欧洲药品管理局(EMA)已接受Prestige BioPharma公司的曲妥珠单抗生物仿制药Tuznue(HD201)的营销授权申请(MAA)。
MedSci原创 - 欧洲药品管理局,曲妥珠单抗,生物仿制药,营销授权申请 - 2019-06-01
默沙东15价肺炎球菌结合疫苗2项III期研究成功,计划年底申请上市
默沙东宣布其15价肺炎球菌结合疫苗V114 (PCV15) 在PNEU-PATH (V114-016) 和 PNEU-DAY (V114-017)这2项III期研究中取得积极结果,且安全性和耐受性良好
医药魔方 - 肺炎球菌,默沙东,疫苗2项 - 2020-11-04
FDA批准MGB Biopharma的新型抗生素IND申请治疗艰难梭菌相关性腹泻
美国食品和药物管理局(FDA)和加拿大卫生部已经批准MGB Biopharma的候选药物MGB-BP-3的研究性新药申请(IND),用于治疗艰难梭菌相关性腹泻(CDAD)。
MedSci原创 - 艰难梭菌相关性腹泻,CDAD,抗生素 - 2019-01-25
关于2015年度国家自然科学基金项目申请与结题等有关事项的通告
关于2015年度国家自然科学基金项目申请与结题等有关事项的通告 国科金发计〔2014〕86号 为做好2015年度国家自然科学基金项目(以下简称项目)申请和2014年应结题项目结题等工作,现将有关事项通告如下: 一、项目申请 (一)项目申请接收。1.国家自然科学基金委员会(以下简称自然科学基金委)2015年度项目申请集中接收工作自2015年3月2日开始,3月20日16
国家自然科学基金委员会 - 国自然,国家自然科学基金,项目申请 - 2014-12-08
国家自然科学基金申请代码(生命科学与医学部)
链接见:http://www.medsci.cn/sci/nsfc.do 国家自然科学基金申请代码 C.生命科学部 C01 微生物学
MedSci原创 - 国家自然科学基金,代码 - 2012-08-24
单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流技术指导原则(2020年)
为鼓励创新,帮助申请人提高与药审中心的沟通交流效率,保证药品审评的科学性和严谨性,在国家药品监督管理局的部署下,药审中心组织制定了《单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流
NMPA - 单臂试验 - 2021-02-09
Inspiration公司向FDA提交IB1001(重组凝血因子IX)生物制品许可申请
2012年4月17日,路透社,Ipsen公司今天宣布,其合作伙伴Inspiration生物制药公司(Inspiration Biopharmaceuticals)已向FDA提交了IB1001的生物制品许可申请
生物谷 - 新药,FDA - 2012-04-25
为您找到相关结果约500个