FDA批准Reblozyl治疗骨髓增生异常综合症相关的贫血
百时美施贵宝公司(Bristol Myers Squibb)近日宣布,FDA已扩大Reblozyl(luspatercept-aamt)的适应症范围。
MedSci原创 - 贫血,骨髓增生异常综合症,Reblozyl - 2020-04-04
FDA今日批准创新疗法,治疗过度嗜睡
今天,FDA宣布批准Jazz Pharmaceuticals公司开发的Sunosi(solriamfetol)上市,治疗与发作性睡病(n
药明康德 - 2019-03-21
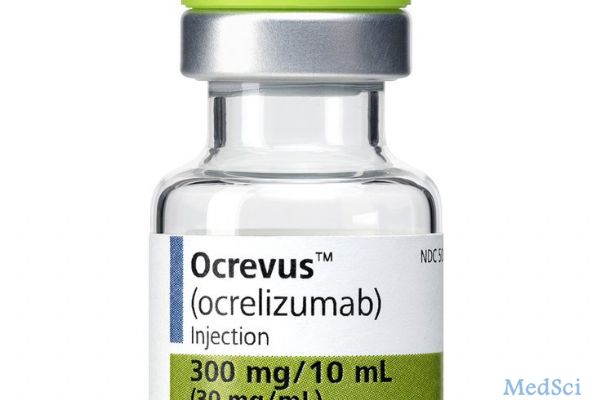
FDA批准首款治疗多发性硬化症新药Ocrevus
3月29日,美国食品药品监督管理局(FDA)官网发布,罗氏集团旗下Genentech公司研发生产的新药ocrelizumab (商品名Ocrevus)获得FDA的批准。Ocrevus这款新药是用于治疗复发性多发性(RMS)和原发进展性(PPMS)硬化症,占硬化症患者总数比例的10%-15%,这也是FDA批准的用于治疗PPMS的首款新药,据了解,该种药物须由专业医师静脉注射给对症患者
医谷 - 硬化症,FDA,Ocrevus - 2017-03-30
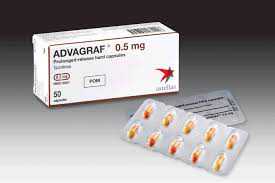
安斯泰来他克莫司缓释胶囊(ASTAGRAF XL)获FDA批准
安斯泰来(Astellas)美国子公司今天宣布,ASTAGRAF XL(他克莫司缓释胶囊,tacrolimus extended release capsules)获FDA批准,与霉酚酸酯(MMF)
生物谷 - 新药,FDA - 2013-07-22
FDA批准年度第44款新药 用于生长激素缺乏症
日前,Aeterna Zentaris公司宣布美国FDA批准其口服生长素释放肽激动剂Macrilen(macimorelin),用于成年生长激素缺乏症(AGHD)患者的诊断,这也是美国FDA药品评估和研究中心(CDER)今年批准的第44个新药分子。
药明康德 - FDA,AGHD,Macrilen - 2017-12-22
FDA批准Amgen的Nplate治疗儿科免疫性血小板减少症
Amgen公司近日宣布,FDA已经扩大了Nplate(romiplostim)的适应症,将其用于1岁及以上患有免疫性血小板减少症(ITP)至少6个月的儿科患者,值得注意的是,这些患者对皮质类固醇、免疫球蛋白或脾切除术均反应不足Amgen研发执行副总裁David Reese表示,“这项批准强调了我们长期致力于罕见且难以治疗的血液病所作出的努力”。
MedSci原创 - Nplate,Amgen,FDA - 2018-12-16
美国FDA批准首个生物仿制药Zarxio(非格司亭-sndz)上市
美国FDA今天批准了美国有史以来第一个真正意义上的生物仿制药Zarxio(通用名:filgrastim-sndz)上市。Neupogen最早在1991年获得FDA批准用于治疗5种情况的中性粒细胞减少(接受骨髓抑制剂化疗的、接受诱导或巩固化疗的急性髓性白血病、接受骨髓移植的癌症患者、接受自体外周血
美中药源 - 药械,生物仿制药 - 2015-03-09
2014年FDA批准新药 抗肿瘤领域有9只药物获批
2014年美国FDA药品评价和研究中心(CDER)批准了41个新分子实体(NME)和生物制品许可申请(BLA)(不包括FDA生物制品评价与研究中心(CBER)批准的疫苗、血液制品等产品),高于2013作为FDA批准药物丰硕的一年,其中抗肿瘤领域有9只药物获批,成为获得批准药物最多的领域。其次,4只糖尿病药物,4只新型抗菌药物,其中新型抗菌药物获
FDA - 基因治疗 - 2015-01-05
FDA批准Novo Nordisk的Victoza治疗2型糖尿病儿童患者
Novo Nordisk宣布,FDA扩大其Victoza(利拉鲁肽)注射剂的适应症,用于治疗10岁或以上的2型糖尿病儿童和青少年患者。这一批准标志着胰高血糖素样肽-1(GLP-1)受体的激动剂首次获批在该患者群体中对该病症的治疗。该公司指出,"Victoza为这一人群提供了二甲双胍和胰岛素以外的新治疗选择,这是19年来的第一次"。
MedSci原创 - GLP-1受体激动剂,Victoza,2型糖尿病,儿童患者 - 2019-06-18
FDA今日批准近十年来首个肝癌药物regorafenib
今日,美国FDA传来重磅消息——拜耳(Bayer)药物Stivarga(regorafenib)获批扩大适应症,治疗那些已使用过肝癌药物sorafenib进行治疗,但疾病依旧出现进展的肝细胞癌患者。值得一提的是,这是美国FDA在近10年来批准的首款肝癌药物。肝细胞癌是最常见的肝癌类型。根据美国国家癌症研究所(NCI)的数据,全美今年将有约40710名新发肝癌患者,并有28290人将死于肝癌。
MedSci原创 - 肝癌,Regorafenib - 2017-04-28
FDA对抗体生物仿制药产品批准在2019年明显增加
抗体协会的调查结果显示,美国食品和药物管理局(FDA)对生物仿制药抗体治疗药物的批准在2019年显着增加。今年前七个月共批准了六种抗体产品。
MedSci原创 - FDA,抗体生物仿制药,批准增加 - 2019-08-10
FDA批准通过索林集团植入式心脏远程监控器SmartVIew
本周,索林集团宣布,FDA已经批准了其为植入有心脏节律管理装置的患者设计的远程监控应用装置SmartView 。
丁香园 - FDA,索林集团,植入,心脏,SmartVIew - 2013-05-16
FDA批准吸入型人胰岛素Afrezza的上市申请
2014年6月27日,美国食品及药物管理局批准了人胰岛素Afrezza Inhalation Powder的上市申请,该药物是一种快速起效的吸入型胰岛素,可改善糖尿病成人患者的血糖控制。
医学专业新闻 - 胰岛素,Afrezza - 2014-06-30
FDA批准首个细胞培养制备季节性流感疫苗上市
11月20日,美国食品与药物管理局(FDA)批准首个通过动物细胞培养技术制备的季节性流感疫苗(Flucelvax)上市,该疫苗适用于年龄18岁及以上人群。
医学论坛网 - 季节性流感疫苗,FDA,动物细胞培养技术 - 2012-11-23
FDA批准阿达木单抗用于儿童节段性回肠炎
美国FDA表示,艾伯维节段性回肠炎(克罗恩氏病)治疗药物阿达木单抗(修美乐)现在可用来治疗6岁大小的患者,而它的这种用途两年前已在欧洲获得批准。
丁香园 - 回肠炎,阿达,节段,FDA,炎症性肠病 - 2014-10-09
为您找到相关结果约500个