基因编辑CRISPR牛文扎堆,离临床还有多远?
2016-05-14 MedSci MedSci原创
基因编辑是近几年来生命科学领域的热门研究方向之一,经典的CRISPR/Cas9系统不仅已经应用到研究领域的多个方向,也有一批基于该技术的商业化公司应运而生。 正如Science文章中所提到的,CRISPR技术真正应用到治愈疾病中还有很长的路要走,还有很多障碍和限制性需要克服。目前,全球各国的科学家们也正积极地致力于对CRISPR系统的改进和发现研究。此前,除了CRISPR/Cas

基因编辑是近几年来生命科学领域的热门研究方向之一,经典的CRISPR/Cas9系统不仅已经应用到研究领域的多个方向,也有一批基于该技术的商业化公司应运而生。
正如Science文章中所提到的,CRISPR技术真正应用到治愈疾病中还有很长的路要走,还有很多障碍和限制性需要克服。目前,全球各国的科学家们也正积极地致力于对CRISPR系统的改进和发现研究。此前,除了CRISPR/Cas9,另一种大家较为熟悉的系统是张锋去年发表的CRISPR/ Cpf1,而最近中国科学家为基因编辑家族带来了新的成员(Cell:第二代基因编辑神器诞生,CRISPR/Cpf1让一切皆有可能!)。
5月2日,发表在Nature Biotechnology上的一项研究中,一个中国科学家小组报告了一种DNA导向的可用于人类细胞基因编辑的核酸内切酶——NgAgo。领导这一研究的河北科技大学副教授韩春雨表示,使用DNA而不是RNA作为引导工具取得一些优势,比如编辑对象所受限制更小、编辑精准度更高等(Nat Biotech:中国学者开发出替代CAS9的新型基因编辑技术,诺奖级别)。
据悉,NgAgo结合24个碱基的gDNA,这比Cas9的gRNA(19个碱基)要长5个碱基,理论上其精确性要提高1024(4的5次方)倍。此外,NgAgo–gDNA系统对向导序列-靶序列错配容忍度很低。gDNA上任何一个碱基的变换都会降低NgAgo的切割效率,如有三个错配则使其完全失活,这在另外一个机制上提高了NgAgo使用的精确性。
近阶段,基因编辑神器CRISPR系统再次展现出了它强大的实力,Nature、Science及Cell等期刊相继发表了多项最新研究进展,第一波基因编辑公司纷纷进行IPO,与医药巨头建立合作,新秀公司备受资本追捧,同时,CRISPR领域的科学家们也得到了各大奖项的青睐。
3月9日,Jennifer Doudna及Emmanuella Charpentier等5位CRISPR领域科学家被授予阿尔珀特奖(Warren Alpert Prize);3月23日,2016加拿大盖尔德纳国际奖也授予了包括张锋、“两大女神”在内的CRISPR领域的5位科学家(CRISPR-Cas9技术发明简史)。
Broad研究所的张锋因其在学术和商业上的突出成就成为基因编辑领域备受瞩目的科学家之一。4月21日,发表在《细胞》杂志上的一项研究中,来自Broad研究所和东京大学的研究人员揭示出了Cpf1/向导RNA/靶DNA复合物的晶体结构。张锋及东京大学的Osamu Nureki教授是这一研究的共同通讯作者(Nature:新型基因编辑Cpf1/CRISPR的RNA复合物被中国学者破译)。
该研究中,科学家们确定了氨基酸球菌属(Acidaminococcus sp)Cpf1(AsCpf1)与向导RNA和靶DNA复合物的晶体结构,分辨率达到2.8 埃(Å)。他们通过比较AsCpf1和Cas9的结构,揭示出一些惊人的相似性和主要的差异,由此解释了它们独特的功能。
CRISPR近期10项专利,张锋占6个

图片来源:MIT官网
一直以来,围绕在张锋与Jennifer Doudna之间的CRISPR专利之争备受瞩目。3月上旬,据《科学》网站报道,美国专利商标局主持召开了一项由法官评判组参与的评审会议,对Borad研究所和加州大学伯克利分校的专利权主张进行审理和裁决。据悉,该评审会议于3月10日启动,或将为期数月。
此前,有报道称,截止到2015年11月,张锋实验室以及Borad研究所关于CRISPR-Cas9的相关专利在美国已经有14个被批准,在欧洲也有4个已经被批准。尽管上述专利之争还未最终定论,但随着技术的不断更新和发展,基因编辑领域的专利分布格局也在不断变化。
5月6日,在线发表在Nature Biotechnology上的一篇文章盘点了近期CRISPR技术相关的十项专利,其中有6项与张锋相关,具体见下表:
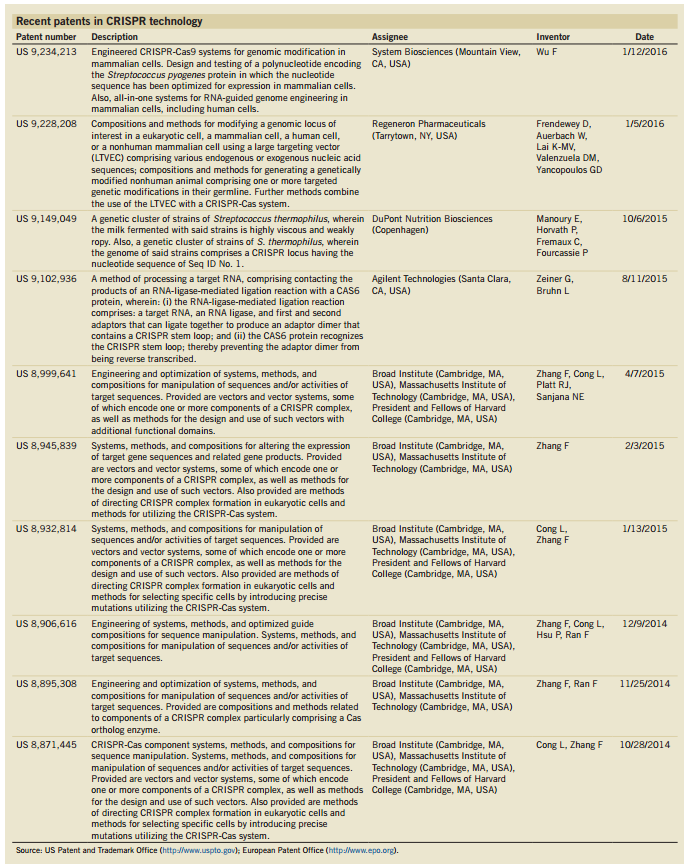
图片来源:Nature Biotechnology
CRISPR治疗疾病还为时尚早
今年3月, 《自然》杂志发表了3篇文章,对超火爆的CRISPR技术进行了讨论,文章表示,基因编辑还只是一个开始,现在已经不是单纯技术问题,已经影响到政策制定和伦理学领域。上周,《科学》网站发表了题为“The gene editor CRISPR won’t fully fix sick people anytime soon. Here’s why”的文章,探讨了这一技术的前景与风险。
文章指出,在能够安全有效的修复人类基因之前,CRISPR还有一段很长的路要走。这是绝大多数人类疾病(如肌肉萎缩症、囊性纤维化)需要面对的事实。基因编辑治疗这些疾病需要在人体中直接修正基因,因为如果先将细胞取出来,再修复好放回体内,很少的细胞能够存活。
在体内直接治疗细胞意味着基因编辑需要面对基因导入方面的障碍。举例来说,研究人员必须找到一种能够将可发挥作用的CRISPR系统导入到人体特定组织中的有效方法。同时,CRISPR还具有安全风险,最常提到的是Cas9酶的脱靶效应,这可能会导致癌症的发生。
CRISPR用于治疗人类疾病还存在一些其它问题,通过该技术删除基因比修正基因要相对容易。这是因为细胞在编辑DNA时需要启动一个叫同源介导修复(homology-directed repair,HDR)的程序,这一程序只会在分裂的细胞中激活。不幸的是,人体中大多数的细胞通常不在分裂状态。
当然,研究者们也在寻找绕过这一限制的方法。张锋表示,HDR相关的基因存在于所有细胞中,那么,也许可以通过添加某种药物到细胞中激活这一程序。此外,另一种途径是寻找一种不依赖于HDR程序的、可替代Cas9的CRISPR系统。
安全隐患
脱靶效应并不是CRISPR技术目前唯一的安全隐患。事实上,研究人员通常是利用病毒载体传递Cas9的DNA到细胞,从而使CRISPR系统在组织中发挥作用。这意味着,在Cas9完成目标切割后,细胞将会继续表达Cas9。对此,张锋表示,Cas9酶将存在超过10年、20年。这带来的问题是,即便是特异性非常高的Cas9也将会产生脱靶切割,从而引发免疫响应。
然而,张锋表示,这可能不会是一个真正的问题。他团队构建了一种一直表达着Cas9基因的小鼠品系,即便是杂交约20代后,小鼠似乎依然“很好”,没有明显的异常健康影响。尽管如此,最理想的情况还是找到一个方法可以在Cas9发挥作用后关闭它。
另一方面,基因疗法长期存在的障碍也是CRISPR需要面对的。基因编辑的细胞最终会死亡,患者不得不接受多次治疗。研究人员使用的基因导入和编辑途径都会受病毒载体可携带DNA量的限制。目前,CRISPR研究者通常必须使用两种不同的病毒载体将CRISPR组件导入到细胞中,这比使用单个载体效率更低。
应用前景
基因治疗研究者Cynthia Dunbar说:“CRISPR技术的出现为基因治疗领域注入了新的活力,这部分是因为与基因导入相比,这一技术有望解决更多的遗传性疾病,其中包括一些免疫性疾病,这类患者的修复蛋白数量必须精确控制。在其它情况下,如镰状细胞病,除非患者的细胞不再产生缺陷蛋白,否则患者不会完全康复,因此,只添加一个基因是不够的。”
基因治疗领域经历了20多年的起起伏伏,这一领域的“老将们”对CRISPR提高疾病治疗的预期持谨慎态度。斯坦福大学的基因治疗研究人员Mark Kay说:“每当有一项新的技术出现,总会带来很大的兴奋,人人都希望它能够用于治愈患者,但,真正实现这一点需要一些时间。”
最近有关基因编辑的重大进展汇集
除上述突破成果外,近阶段,Nature、Science、Cell三大顶级期刊上发布了多项与CRISPR技术相关的最新进展,其中包括了对系统结构的解析、新功能的开发以及对新系统的探索。以下汇总发表在三大主刊上的10篇重要进展:
Cell:突破性CRISPR新技术(5月12日)
High-Throughput, High-Resolution Mapping of Protein Localization in Mammalian Brain by In Vivo Genome Editing
5月12日,发表在cell上的这项研究中,马克斯普朗克佛罗里达神经科学研究所的Ryohei Yasuda博士和他的研究小组开发出了一种他们命名为SLENDR(通过CRISPR/Cas9介导的同源指导修复单细胞标记内源性蛋白)的方法,可利用它来精确改造活体样品中的神经元DNA。
在实验模型中,该研究小组利用了子宫内电穿孔技术——使得他们能够将CRISPR/Cas9系统插入到仍然在发育及分裂的胎儿期脑细胞中。因此,断裂DNA仍然是通过HDR进行修复,这允许了研究人员添加进一个使得目的蛋白在显微镜下可见的基因。他们甚至可以在同一细胞中同时用不同的颜色可靠地标记两种不同的蛋白。研究人员利用各种成像方法以及DNA测序证实了SLENDR方法可以真实、精确地敲入基因。
Science:利用CRISPR/Cas9操纵染色体重组绘制遗传图(5月5日)
CRISPR-directed mitotic recombination enables genetic mapping without crosses
5月5日,发表在Science上的这项研究中,由加州大学洛杉矶分校的Leonid Kruglyak领导的一个研究小组开发出了一项新技术,利用基因编辑系统CRISPR来快速鉴别基因变异。研究人员指出,数十年来尽管绘图研究已揭示出许多性状的基因位点,但鉴别潜在基因和变异却一直滞后。他们开发出了一种新型的CRISPR辅助的绘图方法,有望消除这一缺口。
Nature:科学家利用CRISPR-Cas9技术成功构建出细胞疾病模型(4月27日)
Efficient introduction of specific homozygous and heterozygous mutations using CRISPR/Cas9
4月27日,在线发表于Nature上的这项研究中,来自洛克菲勒大学(Rockefeller University)和纽约干细胞研究所等机构的研究人员利用基于CRISPR的基因编辑技术成功在细胞中重现了疾病发生的过程。
研究描述了一种基于CRISPR/Cas9的基因组编辑框架,它使得能够以高效率及精度选择性引入单等位基因和双等位基因序列改变。研究人员证实,通过整合一些阻断CRISPR/Cas沉默突变及致病突变可以显著提高HDR的精度,并建立了一种叫做“CORRECT”的方法来实现无痕基因组编辑。
利用这种方法,他们构建出了具有杂合子和纯合子显性早发阿尔茨海默病致病APPSwe和presenilin 1(PSEN1M146V)突变的人类诱导多能干细胞及衍生的大脑皮层神经元,这些细胞显示出基因型依赖性的疾病相关表型。
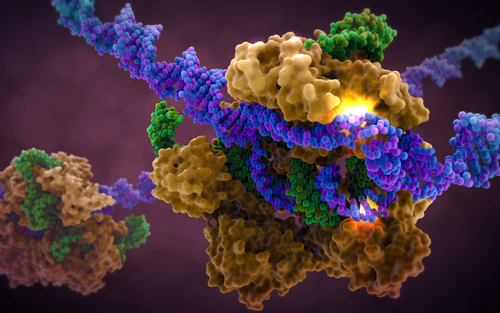
Nature:CRISPR再现“魔剪”实力,这次只“剪”单个碱基(4月20日)
Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage
4月20日,在线发表于Nature上的这项研究中,科学家们报告称,一种经改造的CRISPR基因编辑系统能够赋予研究者们有效改变给定基因中单个DNA碱基的能力。这一研究进展进一步开拓了基因编辑的应用范围,且有望为开发多种疾病的治疗方法带来新的可能。
在这一研究中,科学家们找到一种不用切割就能编辑基因组的方法。他们改造了Cas9酶,使它不再能够切割DNA;然后将其与另一种能够将一种碱基(胞嘧啶,C)转变为另一种碱基(尿嘧啶,U)的酶绑定在一起。U通常存在于RNA中,在DNA中细胞会把它当作T来阅读。在这样一个系统中,导向RNA将经改造的Cas9送到基因组中的目标位置,系统中的另一种酶(碱基修饰酶APOBEC1)发挥改变DNA序列的作用,而不是去切断它们。
结果发现,经改造的这一系统在试管中对单独DNA的作用约达44%的时间,这是一个很大的提高;但在细胞中,最好的效率也只有7.7%。一个问题是,这一系统只是改变了其中一条DNA链,会使其与另一条链不匹配。此时,细胞会开始修复这种“错误匹配”,抵消酶系统的作用。
随后,Liu的团队开始添加另一种蛋白到经改造的Cas9上,用于阻止细胞从DNA上去除U。最终产生的这一碱基编辑器(base editor)纠正了小鼠细胞中阿尔茨海默病相关的突变,有效率高达75%。同时,这一碱基编辑器还纠正了人类细胞中癌症相关基因的突变,效率高达7.6%。此前,标准的CRISPR-Cas9方法从未做到这样。
【3篇文章】“组团”解析CRISPR/Cpf1系统(三篇Nature文章揭示CRISPR/Cas9基因组编辑取得重大进展 )
Cell:张锋新成果解析CRISPR/Cpf1系统(4月21日)
Crystal Structure of Cpf1 in Complex with Guide RNA and Target DNA [文献]
4月21日,发表在Cell杂志上这项研究中,来自Broad研究所和东京大学的研究人员揭示出了Cpf1/向导RNA/靶DNA复合物的晶体结构。张锋及东京大学的Osamu Nureki教授是这一研究的共同通讯作者。
该研究中,科学家们确定了氨基酸球菌属(Acidaminococcus sp)Cpf1(AsCpf1)与向导RNA和靶DNA复合物的晶体结构,分辨率达到2.8 埃(Å)。AsCpf1采用了一种二裂片(bilobed)结构,RNA-DNA异源双链核酸分子束缚在中间通道内。他们通过比较AsCpf1和Cas9的结构,揭示出一些惊人的相似性和主要的差异,由此解释了它们独特的功能。
Nature:Emmanuelle Charpentier解析CRISPR/Cpf1系统(4月20日)
The CRISPR-associated DNA-cleaving enzyme Cpf1 also processes precursor CRISPR RNA [文献]
4月20日,在线发表于Nature上的这项研究中,CRISPR“两大女神”之一的Emmanuelle Charpentier领导的科学家小组证明了Cpf1在定向基因编辑中能执行RNA加工和DNA切割两个活动,这可能打开了对特定序列基因组编辑和沉默的新方向。

黄志伟教授和课题组成员在实验室(图片来源:哈尔滨工业大学官网)
Nature:中国科学家破译CRISPR/Cpf1运行机制(4月20日)
The crystal structure of Cpf1 in complex with CRISPR RNA
4月20日,在线发表于Nature上的这项研究中,哈尔滨工业大学生命学院黄志伟教授及其团队首次揭示了CRISPR-Cpf1识别crRNA的复合物结构。
研究通过结构生物学和生化研究手段揭示了CRISPR-Cpf1识别CRISPR RNA以及Cpf1剪切pre-crRNA成熟的分子机制,这对认识细菌如何通过CRISPR系统抵抗病毒入侵的分子机理具有十分重要的科学意义。研究还发现,Cpf1并不是此前人们推测的二聚体状态,它本身是一个呈三角形的单体,位于该结构中间是一个带有正电荷的凹槽。这些研究为成功改造Cpf1系统,使之成为特异的、高效的全新基因编辑系统提供了结构基础。
Cell:首次利用CRISPR/Cas9靶向活细胞中的RNA(3月17日)
Programmable RNA Tracking in Live Cells with CRISPR/Cas9
3月17日,发表于Cell上的这项研究中,来自美国加州大学圣地亚哥分校的研究人员发现,CRISPR/Cas9有可能最终可用于研究广泛的疾病相关RNA过程,及操控基因转录进行疾病建模。论文通信作者Gene Yeo博士说:“据我们所知,这项研究是首次利用CRISPR-Cas9靶向作用于活细胞中的RNA。“
CRISPR-Cas9技术的特异性依赖于单向导RNA(sgRNA),sgRNA与Cas9酶形成的一种复合物可在靶DNA序列中生成突变。在这项新研究中,研究人员从几个方面改造了CRISPR-Cas9系统,优化它用于RNA追踪。研究人员证实,他们的方法可用于追踪人类细胞中响应细胞应激的RNA活动。
Nature颠覆发现:病毒也有CRISPR样系统(2月29日)
MIMIVIRE is a defence system in mimivirus that confers resistance to virophage
2月29日,在线发表于Nature上的这项研究中,法国科学家们报告称,巨型病毒mimiviruses拥有类似细菌CRISPR系统一样的抵御入侵的防御系统。
科学家们分析了60种mimivirus病毒株的基因组,结果发现,能够抵御Zamilon感染的Mimiviruses拥有与之向匹配的DNA短链。此外,在这些序列附近,研究人员发现了一些基因,它们能够编码降解DNA的酶。在CRISPR系统中,编码Cas酶的基因也在识别病毒的序列附近。研究还发现,阻断这一CRISPR样系统中的不同组件,会使得mimiviruses更易受到Zamilon的攻击。研究者们将这一类似CRISPR的系统命名为MIMIVIRE。
Science: 诺奖得主发现新型CRISPR系统(2月26日)
Direct CRISPR spacer acquisition from RNAby a natural reverse transcriptase–Cas1 fusion protein[文献]
2月26日,发表于Science上的这项研究中,科学家们发现,细菌具有一个可以识别及破坏危险病毒的系统,其利用了涉及核糖核酸(RNA)的一种新机制。它与捕获外源DNA的CRISPR/Cas系统非常相似。
斯坦福大学病理学与遗传学教授Andrew Fire,与德克萨斯大学奥斯汀分校细胞与分子生物学研究所所长lan Lambowitz是这篇论文的共同通讯作者。Andrew Fire因发现RNA干扰而共享了2006年的诺贝尔生理学或医学奖。研究小组第一次发现了细菌可以从病毒入侵者那里夺得一些RNA片段,并将这些RNA整合到自身的基因组中,在未来它们会帮助细菌识别及破坏危险的病毒。
特别备注:本文部分内容参考自生物通、生物谷。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#CRISPR#
34
以前一项新的技术普及起来可能要10年甚至更长,但是现在新的技术很快就同步到全球。
87
现在全球新的技术进展太快了,应用也非常的短。
101