单臂临床试验(single arm trial,SAT)是指在临床试验设计时,不设立平行对照组,并采用开放设计,不涉及随机与盲法。这些特征一方面加速了临床试验的进程,但同时也为试验结果本身带来了不确定性,因此,通过单臂试验加速批准上市的药物,通常要开展上市后的确证研究。为了指导药物研发单位合理使用单臂临床试验设计,基于在审评工作中发现的问题,国家药品监督管理局于2020年发布了《单臂试验支持上市的抗肿瘤药进入关键试验前临床方面沟通交流技术指导原则》和《单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流技术指导原则》。
2021年4月27—29日,美国FDA召开肿瘤药物咨询委员会(oncologic drug advisory committee, ODAC)会议,对6项已通过单臂加速批准上市的肿瘤适应证进行讨论。此次集中的ODAC会议再次将单臂试验推向了风口浪尖。单臂试验为晚期肿瘤患者更早得到有效治疗提供了机会,但这种加速上市的前提,实际是在评估了获益风险后,对循证医学证据级别要求进行了一定程度的妥协。因此,单臂试验不宜滥用。
单臂试验加速了临床试验的进程,显著缩短了药物上市时间,使晚期恶性肿瘤患者可以更快地获得治疗药物,已成为抗肿瘤新药加速获批上市的重要途径。
常见的做法是进行一个单臂II期临床研究,选择ORR/MPR/PFS等短时间可以得到结果的替代终点作为主要研究终点;并将历史数据、或者同期回顾性研究结果作为对标数据,以此论证试验药物的有效性。并以此为依据与监管部门进行沟通。
国内单臂试验审批有条件上市情况
随着新版药品管理法和新版药品注册管理办法的实施,附条件批准的含义进一步明确。《中华人民共和国药品管理法》(2019年修订)第二十六条指出:对治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,可以附条件批准,并在药品注册证书中载明相关事项。2020年7月1日起施行的《药品注册管理办法》(国家市场监督管理总局令第27号)中,设立突破性治疗药物、附条件批准、优先审评审批、特别审批4个加快通道,并在第六十三条中明确了可以申请附条件批准的3种情形。
此前,国内实际已有多个药物以单臂临床试验支持上市,并被要求开展上市后的确证性研究。2014年附条件批准上市的西达本胺为我国首个附条件批准上市的药物。截至2021年5月10日,共有19个药物的26个适应证获得批准附条件上市(表1)。

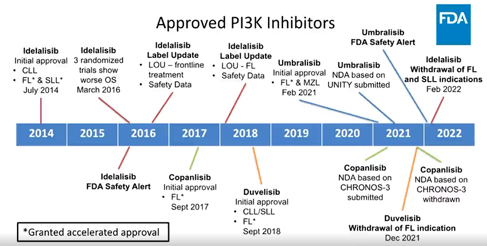
FDA近期单臂批准有条件上市
比如,自2014年起,4款针对血液瘤的PI3K抑制剂陆续获FDA批准上市,适应症主要为滤泡淋巴瘤(FL)、小淋巴细胞淋巴瘤(SLL)等惰性非霍奇金淋巴瘤,其中4项加速获批基于单臂研究,主要终点为ORR;2项常规获批基于随机对照试验(RCT),主要终点为PFS。4种药物均表现出ORR或PFS的改善。
中国CDE发文拟支持“单臂临床试验”
近日,国家药监局药品审评中心(CDE)发布了《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则(征求意见稿)》(以下简称《技术指导原则》)。CDE指出,《技术指导原则》旨在阐明当前对单臂试验用于支持抗肿瘤药上市申请的适用性的科学认识,以期指导企业在完成早期研究后,更好地评估是否适合开展单臂试验作为关键临床研究用以支持后续的上市申请。CDE强调,指导原则中所讨论的“单臂临床试验”,均指支持药物上市申请的关键性单臂临床试验。
单臂试验的潜在风险
单臂试验加速了审批的进程,但我们不能忽视其固有的局限性。因缺乏对照组和随机选择的过程,在单臂试验中,可以特别优选预期效果好的患者加入研究,而摒弃其他预期疗效不好的患者,造成结果“假有效”;可以优选身体条件好,基础疾病少的患者,可以耐受更多的AE,造成药物“假安全”。选择替代终点,只观察短期疗效,而不是长期生存,会忽略因药物AE积累引起的死亡事件。
所以,无论FDA、EMA还是NMPA,对于有条件上市药物,都需要承诺进行随机对照临床研究,以证明药物长期应用的效果。
于是,上文提到的4款FDA批准的针对血液瘤的PI3K抑制剂,上市后进行了6项RCT研究。其结果令人惊诧,全部试验均提示:PI3K使患者无病生存时间(PFS)延长或潜在获益;但却一致性地表现为OS损害,这一结果是史无前例的!
近来PI3K抑制剂在FDA审评中也接连受挫,包括撤回已获批适应症、撤回上市申请或被FDA要求补充临床数据等。

Source:ODAC会议
基于上述RCT研究的长期随访结果,2022年4月22日,FDA针对PI3K类药物的肿瘤药物咨询委员会(ODAC)以17名与会专家中16票赞成,1票弃权通过:未来PI3K抑制剂在血液肿瘤中的适应症批准,需要基于随机试验数据。该结果彻底关闭了PI3K抑制剂在血液肿瘤中基于单臂试验在FDA获批的大门,不仅对该类药物提出了更高的要求,更明确最终临床获益才是药物疗效的金标准。
FDA态度折射临床研究重中之重, 单臂试验局限性凸显
会议提出了单臂试验存在局限性。随机对照研究才是控制以上混杂因素,充分评估药物获益与风险的最有效的方式。因此,安全性是临床研究的基石,而最终的生存获益永远是金标准,ORR甚至PFS等替代终点并不一定能充分预测OS。FDA同时质疑了PI3K抑制剂存在剂量探索不足的问题,未探索是否存在更低的安全有效剂量。
PI3K抑制剂安全性不佳,是主要动因
PI3K抑制剂的安全性问题一直制约其发展,在多项研究中严重不良反应(SAE)发生率超过60%,3级以上AE约85%,严重的毒性反应包括致命性的感染、中性粒细胞减少、免疫相关毒性如腹泻、肠炎、肝毒性、肺炎等。多种PI3K抑制剂有FDA不良反应黑框警告。OS损害可能与毒性相关,其严重的毒副反应也潜在影响患者在疾病进展后/停用该药后接受其他治疗。
Q:对照组选择“标准治疗”的伦理意义?
2021年11月19日,CDE发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则》也明确提出RCT是药物疗效金标准,并进一步明确了单臂试验支持药物上市的前提,应为获益明显大于单臂试验不确定性所带来的风险。因此必须更关注其安全性,需在早期进行充分的剂量探索,发现严重安全性隐患时应及时暂停/终止试验。对于在早期研究即表现出安全性不佳的药物,对批准其上市需提出更高的要求:如提供更多的安全性数据、生存数据,需基于RCT数据才能获批等。
另外,PI3K抑制剂主要针对FL/SLL等,对于生物学行为相对惰性的肿瘤,更应高度关注其药物安全性、患者生活质量、最终生存获益。同时,替代终点能否最终带来生存获益仍是需要关注的重要问题,这与替代终点的选择、药物安全性密切相关。
此次FDA收紧对PI3K抑制剂的审评策略,对该赛道提出挑战,同时也带来机遇。目前国内外仍有十余种PI3K抑制剂处于临床研究阶段,若能提高亚基选择性与安全性,将短期疗效转化为生存获益,真正成为best-in-class药物,必将从激烈竞争中脱颖而出。
单臂试验偏倚是否在可控范围?
RCT是循证医学证据级别最高的研究。单臂试验不设立平行对照,而是采用外部对照(如历史对照),将单臂试验的受试者与研究外的一组受试者进行比较。由于历史对照为不同时期的不同研究,且未设立平行对照,单臂试验在评价时会引入偏倚因素,这导致单臂试验与RCT比较存在不足。
最新一项研究调查了 1992 年 6 月至 2020 年 12 月期间 基于FDA-AA 途径,通过单臂试验授予的所有批准上市的药品。 两名独立审查员确定了单臂研究并从 FDA 全面医疗审查中提取数据。 我们进行了一项荟萃分析来估计效应大小,并将符合 FDA 批准后 RCT 要求的研究与不符合 RCT 要求的研究进行比较。
在总共 254 项批准中,评估了描述 54 种药物对 72 种临床适应症的效果的单臂临床试验。 估计的效应量为 OR:2.22 (CI95%:1.76-2.81) [相对风险 (RR) = 1.63(95CI% 1.38-1.92)]; 53% 的治疗具有较低的 95% CI 界限,越过无效效应。 满足 FDA 要求进行批准后 RCT 的治疗之间的效果大小没有差异。
未来单臂试验加速审批越来越受到局限
6 月 20 日,CDE 发布了《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》征求意见稿,以阐明当前对单臂临床试验用于支持抗肿瘤药上市申请适用性的科学认识,指导企业在完成早期研究后,更好地评估是否适合开展单臂临床试验作为关键临床研究用以支持后续的上市申请。
但是更多学者认为,对单臂试验的要求越来越高了。未来通过单臂试验批准有条件上市的难度越来越大。
参考文献
-
ODAC-20220421-Backgrounder-FDA
-
https://endpts.com/fdas-odac-votes-unanimously-that-future-pi3k-inhibitors-should-include-randomized-data-for-blood-cancers/
-
https://www.fda.gov/advisory-committees/advisory-committee-calendar/updated-information-april-21-22-2022-meeting-oncologic-drugs-advisory-committee-meeting-announcement
-
CDE:《以临床价值为导向的抗肿瘤药物临床研发指导原则》2021
- 唐凌, 周明, 夏琳, 等. 对单臂试验支持抗肿瘤药物上市策略的再思考[J]. 中华肿瘤杂志, 2022, 44(6):587-592.
- Single-arm clinical trials that supported FDA accelerated approvals have modest effect sizes and at high risk of bias. https://www.sciencedirect.com/science/article/abs/pii/S0895435622000257
- https://mp.weixin.qq.com/s/kBbM6B_ZzaT_QnpQyMoAOg
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






