Circ Res: Sox17缺失通过HGF(肝细胞生长因子)/c-Met信号促进肺动脉高压
2022-11-12 肺动脉高压研究进展 肺动脉高压研究进展
肺动脉高压(PAH)疾病的关键特征,如肺动脉血管的高度重构、内皮细胞(ECs)的增生和炎症、右心室肥大和肺动脉压力的升高,即使在常氧环境下,长期休息后也持续存在。
研究背景:
在大规模的基因组测序的研究中,Sox17(一种内皮特异性转录因子)被认为是肺动脉高压(PAH)的一个假定的致病基因;然而,其作用和分子机制仍有待阐明。本研究针对Sox17(SRY-related HMG-box17)通路受损对PAH的功能影响及作用机制进行了探索,并探讨了其作为治疗靶点的潜力。
研究方法:
在成年小鼠中,肺内皮细胞(ECs)中的Sox17缺失在缺氧条件下诱发PAH,其外显率和严重程度都很高,但在常氧条件下则不然。
研究主要结果:
肺动脉高压(PAH)疾病的关键特征,如肺动脉血管的高度重构、内皮细胞(ECs)的增生和炎症、右心室肥大和肺动脉压力的升高,即使在常氧环境下,长期休息后也持续存在。从作用机制上讲,转录组分析预测,Sox17的缺乏和缺氧的结合激活了肺部ECs的c-Met信号。HGF(肝细胞生长因子)是c-Met的配体,在Sox17缺失的肺部ECs中被调高。在预防和治疗方面,药物抑制HGF/c-Met信号的作用减弱并逆转了PAH的特征。与动物模型的研究结果相似,26.7%的PAH患者(15人中的4人)肺部ECs中的Sox17水平被抑制,而所有14个非PAH对照组中的Sox17水平都很高。86.7%的PAH患者(15人中的13人)肺动脉血管中的HGF水平增加,但对照组未显示这种情况。
研究结果细节:
-
Sox17缺陷和缺氧共同诱发持久性PAH的高外显率。
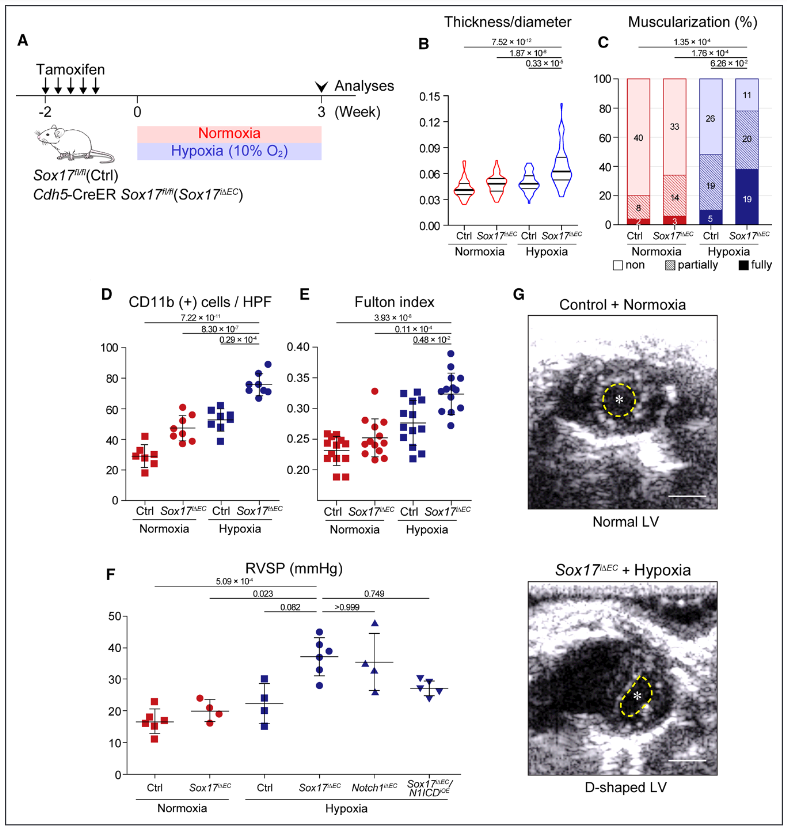 图1. 内皮细胞Sox17缺陷诱导小鼠严重的肺动脉高压(PAH),具有高外显率。A,Sox17缺失诱导的PAH的实验时间表。对照组和Sox17i∆EC小鼠暴露在常氧或低氧环境中3周。B-E,暴露于缺氧的Sox17i∆EC小鼠显示出典型的PAH病理特征,表现为肺壁厚度增加(B)和远端肺动脉血管的过度肌肉化(C),CD11b+细胞的肺部浸润增加(D),以及用Fulton指数测量的RV肥大(E)。F,Sox17i∆EC/缺氧小鼠显示PAH的血流动力学证据,包括RVSP升高,以及D型左心室(LV),与对照组小鼠的正常LV形状形成对比。星号和黄线分别表示左心室腔和心内膜边界。
图1. 内皮细胞Sox17缺陷诱导小鼠严重的肺动脉高压(PAH),具有高外显率。A,Sox17缺失诱导的PAH的实验时间表。对照组和Sox17i∆EC小鼠暴露在常氧或低氧环境中3周。B-E,暴露于缺氧的Sox17i∆EC小鼠显示出典型的PAH病理特征,表现为肺壁厚度增加(B)和远端肺动脉血管的过度肌肉化(C),CD11b+细胞的肺部浸润增加(D),以及用Fulton指数测量的RV肥大(E)。F,Sox17i∆EC/缺氧小鼠显示PAH的血流动力学证据,包括RVSP升高,以及D型左心室(LV),与对照组小鼠的正常LV形状形成对比。星号和黄线分别表示左心室腔和心内膜边界。
2. 低氧诱导的PAH因Sox17缺陷而加剧,是ECs过度增殖的基础
 图2.肺内皮细胞(ECs)的转录组分析的验证。A,分离肺部内皮细胞富集的转录物的实验策略。Cdh5-CreER2; RPL221,1Psam小鼠作为对照组维持在常态下,Cdh5-CreER2; Sox17fl/fl RPL221,1Psam小鼠作为Sox17i∆EC/缺氧组在他莫西芬给药后暴露在缺氧环境中,这使得血凝素(HA)标记的核糖体在ECs中特异性合成。然后收获了肺部组织。B,对照组和Sox17i∆EC/缺氧小鼠的肺部ECs中差异表达基因的火山图。Sox17以蓝色突出显示,证实其水平下降。C,免疫荧光图像验证了肺部EC特异性HA免疫染色的情况。D,捕获HA标记的核糖体所引起的EC和其他细胞类型的标记基因的转录本的倍数变化。用于RNA测序的肺部组织样本的转录水平通过定量PCR验证。E, 三维主成分(PC)分析和(F)无监督聚类清楚地将对照组和Sox17i∆EC/缺氧组的RNA测序数据分开。
图2.肺内皮细胞(ECs)的转录组分析的验证。A,分离肺部内皮细胞富集的转录物的实验策略。Cdh5-CreER2; RPL221,1Psam小鼠作为对照组维持在常态下,Cdh5-CreER2; Sox17fl/fl RPL221,1Psam小鼠作为Sox17i∆EC/缺氧组在他莫西芬给药后暴露在缺氧环境中,这使得血凝素(HA)标记的核糖体在ECs中特异性合成。然后收获了肺部组织。B,对照组和Sox17i∆EC/缺氧小鼠的肺部ECs中差异表达基因的火山图。Sox17以蓝色突出显示,证实其水平下降。C,免疫荧光图像验证了肺部EC特异性HA免疫染色的情况。D,捕获HA标记的核糖体所引起的EC和其他细胞类型的标记基因的转录本的倍数变化。用于RNA测序的肺部组织样本的转录水平通过定量PCR验证。E, 三维主成分(PC)分析和(F)无监督聚类清楚地将对照组和Sox17i∆EC/缺氧组的RNA测序数据分开。
3. Sox17缺失促进了缺氧环境下ECs的异常增殖和炎症激活。
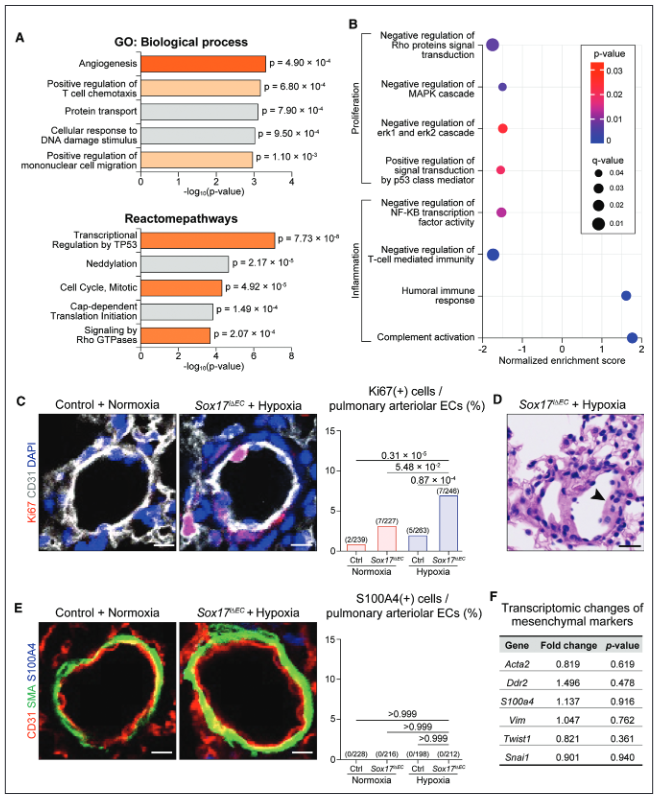 图3.Sox17的缺失促进了缺氧压力下肺内皮细胞(ECs)的异常增殖和炎症激活。A,通过基因(GO)分析,前5个富集的基因,与细胞增殖相关的基因组显示为深橙色,与炎症相关的基因组显示为浅橙色。B,与细胞增殖和炎症有关的GSEA结果的点图。C,远端肺动脉血管中Ki67的免疫染色,这是一种增殖的标记,并对ECs进行量化。D,组织学图像显示Sox17i∆EC/缺氧小鼠的肺动脉血管因ECs的异常堆积而湮灭。E,远端肺动脉血管中S100A4的免疫染色及其在ECs中的定量。F,根据RNA测序数据,间质标志物没有明显的转录变化。
图3.Sox17的缺失促进了缺氧压力下肺内皮细胞(ECs)的异常增殖和炎症激活。A,通过基因(GO)分析,前5个富集的基因,与细胞增殖相关的基因组显示为深橙色,与炎症相关的基因组显示为浅橙色。B,与细胞增殖和炎症有关的GSEA结果的点图。C,远端肺动脉血管中Ki67的免疫染色,这是一种增殖的标记,并对ECs进行量化。D,组织学图像显示Sox17i∆EC/缺氧小鼠的肺动脉血管因ECs的异常堆积而湮灭。E,远端肺动脉血管中S100A4的免疫染色及其在ECs中的定量。F,根据RNA测序数据,间质标志物没有明显的转录变化。
4. 通过调节HGF/c-Met途径挽救PAH的发病机制。
图4.抑制HGF(肝细胞生长因子)/c-Met信号传导可以防止Sox17的缺失所引起的PAH的疾病进展。A,通过基因集富集分析(GSEA;左)和GSEA图显示Sox17i∆EC/缺氧小鼠中c-Met信号的负调控(即激活)的负富集(右),排名靠前的反应组途径。B,Sox17i∆EC/缺氧小鼠远端肺动脉血管中HGF上调的代表图像。C,各实验组小鼠远端肺动脉血管中HGF+内皮细胞(ECs)的百分比。D,预防性抑制c-Met的实验时间计划。E-H,c-Met抑制联合马西坦对PAH表型的削弱与对照组小鼠相当,表现为肺动脉远端壁厚减少(E)和肌肉化(F),CD11b+细胞的肺部浸润减弱(G),并改善了RV肥大(H)在Sox17i∆EC/缺氧小鼠中。
5. c-Met抑制剂可逆转临床前PAH小鼠模型。
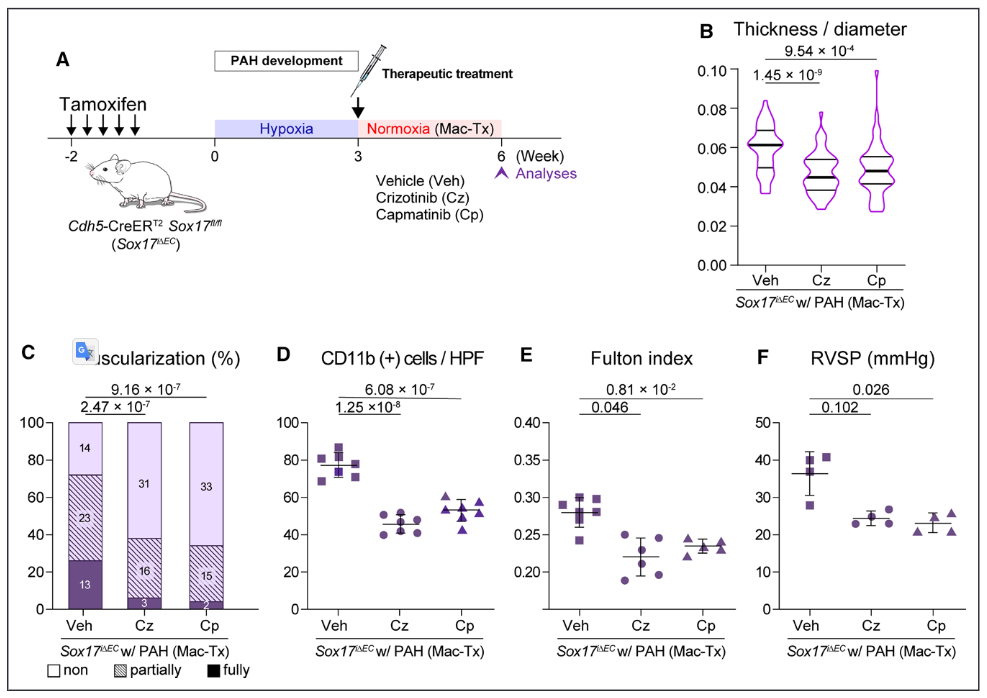 图5.c-Met抑制剂可逆转已建立的肺动脉高压(PAH)动物模型。A, c-Met抑制治疗的实验时间计划;B-F,通过抑制c-Met与马西坦结合,逆转了Sox17i∆EC小鼠的PAH表型,表现为壁厚减少(B)和远端肺动脉血管的肌肉化(C),CD11b+细胞的肺部浸润减少(D),改善房室肥大(E),以及降低房室收缩压(F)。E-H,在Sox17i∆EC/缺氧小鼠中,c-Met抑制联合马西坦对PAH表型的削弱与对照组小鼠相当,表现为肺动脉远端壁厚减少(E)和肌肉化(F),CD11b+细胞的肺部浸润减弱(G),并改善了RV肥大(H)。
图5.c-Met抑制剂可逆转已建立的肺动脉高压(PAH)动物模型。A, c-Met抑制治疗的实验时间计划;B-F,通过抑制c-Met与马西坦结合,逆转了Sox17i∆EC小鼠的PAH表型,表现为壁厚减少(B)和远端肺动脉血管的肌肉化(C),CD11b+细胞的肺部浸润减少(D),改善房室肥大(E),以及降低房室收缩压(F)。E-H,在Sox17i∆EC/缺氧小鼠中,c-Met抑制联合马西坦对PAH表型的削弱与对照组小鼠相当,表现为肺动脉远端壁厚减少(E)和肌肉化(F),CD11b+细胞的肺部浸润减弱(G),并改善了RV肥大(H)。
6. PAH患者中得到验证!
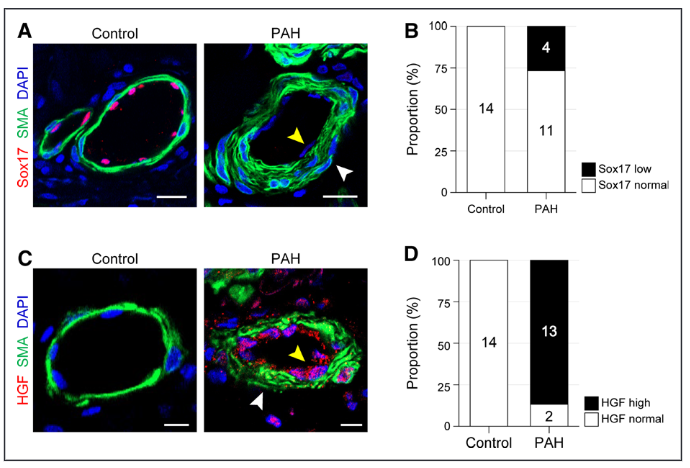 图6.与对照组相比,肺动脉高压(PAH)患者的肺动脉内皮细胞(ECs)中Sox17表达受抑制,HGF(肝细胞生长因子)表达增加。A, 对照组和PAH患者的肺组织切片中的Sox17进行免疫染色。B,Sox17在肺动脉血管中的表达水平比例。C,对照组和PAH患者的肺组织切片中HGF的免疫染色。D,肺动脉血管中HGF表达水平的比例。
图6.与对照组相比,肺动脉高压(PAH)患者的肺动脉内皮细胞(ECs)中Sox17表达受抑制,HGF(肝细胞生长因子)表达增加。A, 对照组和PAH患者的肺组织切片中的Sox17进行免疫染色。B,Sox17在肺动脉血管中的表达水平比例。C,对照组和PAH患者的肺组织切片中HGF的免疫染色。D,肺动脉血管中HGF表达水平的比例。
研究结论:
肺动脉血管中Sox17水平的下调增加了对PAH的易感性,尤其是在缺氧环境下。 该研究结果表明,HGF/c-Met信号的反应性上调是治疗PAH的一个新的可药用的目标。
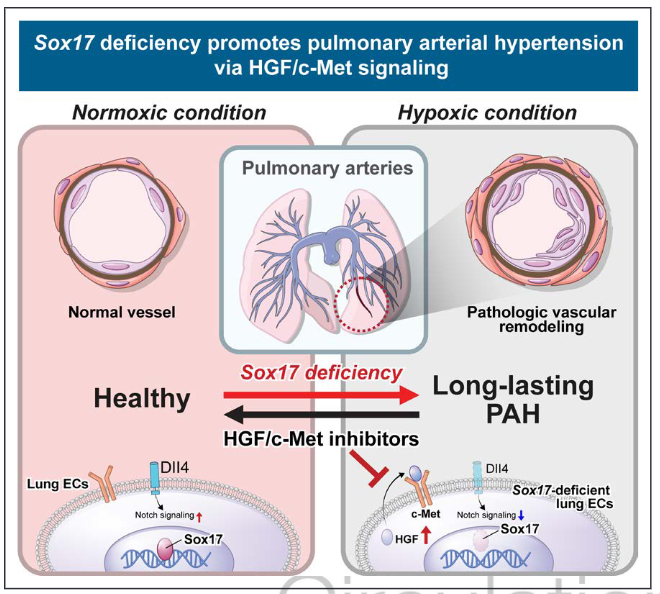 图7.总结性的图示。示意图描述了Sox17在肺动脉健康中的作用,以及它的丧失通过HGF(肝细胞生长因子)上调和Notch信号传导受损导致肺动脉高血压。
图7.总结性的图示。示意图描述了Sox17在肺动脉健康中的作用,以及它的丧失通过HGF(肝细胞生长因子)上调和Notch信号传导受损导致肺动脉高血压。
研究意义:
Sox17缺失和缺氧共同诱发了小鼠中具有高外显率的PAH。此外,肺内皮细胞中的Sox17水平在PAH患者中被抑制。缺氧可能是使易感个体进一步增加PAH风险的第二击,这表明减少暴露于缺氧条件,如吸烟、阻塞性睡眠呼吸暂停或空气污染,可以作为预防策略来实施,以减少PAH的负担。抑制HGF(肝细胞生长因子)s/c-Met信号传递在预防和治疗方面都成功地治疗了实验性PAH,这意味着这一途径可能作为PAH的一个新的可药用的目标。值得注意的是,大多数PAH患者的肺动脉血管中HGF水平上调。
通讯及Last 作者:Injune Kim,韩国科学和技术高级研究所。
 其实验室的主要目标是进一步了解调控血管发育、血管平衡和血管疾病的转录调节。我们专注于内皮特异性转录因子Sox7和Sox17,它们属于SoxF亚家族,以了解各种血管背景下的主要转录调节。其研究确定了Sox7和Sox17是血管发育中的促血管生成调节因子,并阐明了其表达和功能的分子机制。另外,脑动脉中的Sox17对维持成年后的血管完整性至关重要,它的缺失会导致颅内动脉瘤,这是高血压情况下出血性中风的主要原因。
其实验室的主要目标是进一步了解调控血管发育、血管平衡和血管疾病的转录调节。我们专注于内皮特异性转录因子Sox7和Sox17,它们属于SoxF亚家族,以了解各种血管背景下的主要转录调节。其研究确定了Sox7和Sox17是血管发育中的促血管生成调节因子,并阐明了其表达和功能的分子机制。另外,脑动脉中的Sox17对维持成年后的血管完整性至关重要,它的缺失会导致颅内动脉瘤,这是高血压情况下出血性中风的主要原因。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言