【Blood Adv】CAR-T治疗套细胞淋巴瘤的神经毒性的临床特征
2024-03-01 聊聊血液 聊聊血液 发表于上海
该研究或可改善MCL和其他血液系统恶性肿瘤患者中未来的CAR-T细胞疗法急性医疗。
CAR-T治疗MCL的神经毒性
CD19 CAR-T细胞疗法改善了复发/难治性套细胞淋巴瘤(r/r MCL)的预后。众所周知,细胞因子释放综合征(CRS)与免疫效应细胞相关神经毒性综合征(ICANS)是CAR-T治疗后的显著毒性,例如brexucabtagene autoleucel (brexu-cel)输注后所有级别和≥3级CANS的发生率可达60%和30%,尤其是MCL中高于其他B细胞淋巴瘤。ICANS通常表现为中毒性脑病,伴找词困难、意识错乱、失语、震颤和精细运动技能受损等。
当前关于ICANS的研究多来自大B细胞淋巴瘤或儿童B细胞急性淋巴细胞白血病,关于MCL中神经毒性的研究较少。因此学者分析了斯坦福大学接受brexu-cel治疗的真实世界MCL患者队列的临床和诊断特征,旨在通过分析临床特征、计算机断层扫描(CT)、磁共振成像(MRI)和脑电图(EEG)结果、急性处理策略以及与其他不良事件的关联,来确定MCL中严重ICANS的临床和神经相关性,该研究或可改善MCL和其他血液系统恶性肿瘤患者中未来的CAR-T细胞疗法急性医疗。研究结果近日发表于《Blood Advances》。

要点
1、在接受brexu-cel治疗的MCL患者中可发生重度ICANS,其中86%的患者出现急性颅脑MRI表现。
2、重度神经毒性未影响无进展生存期或总生存期。
研究结果
基线患者和疾病特征
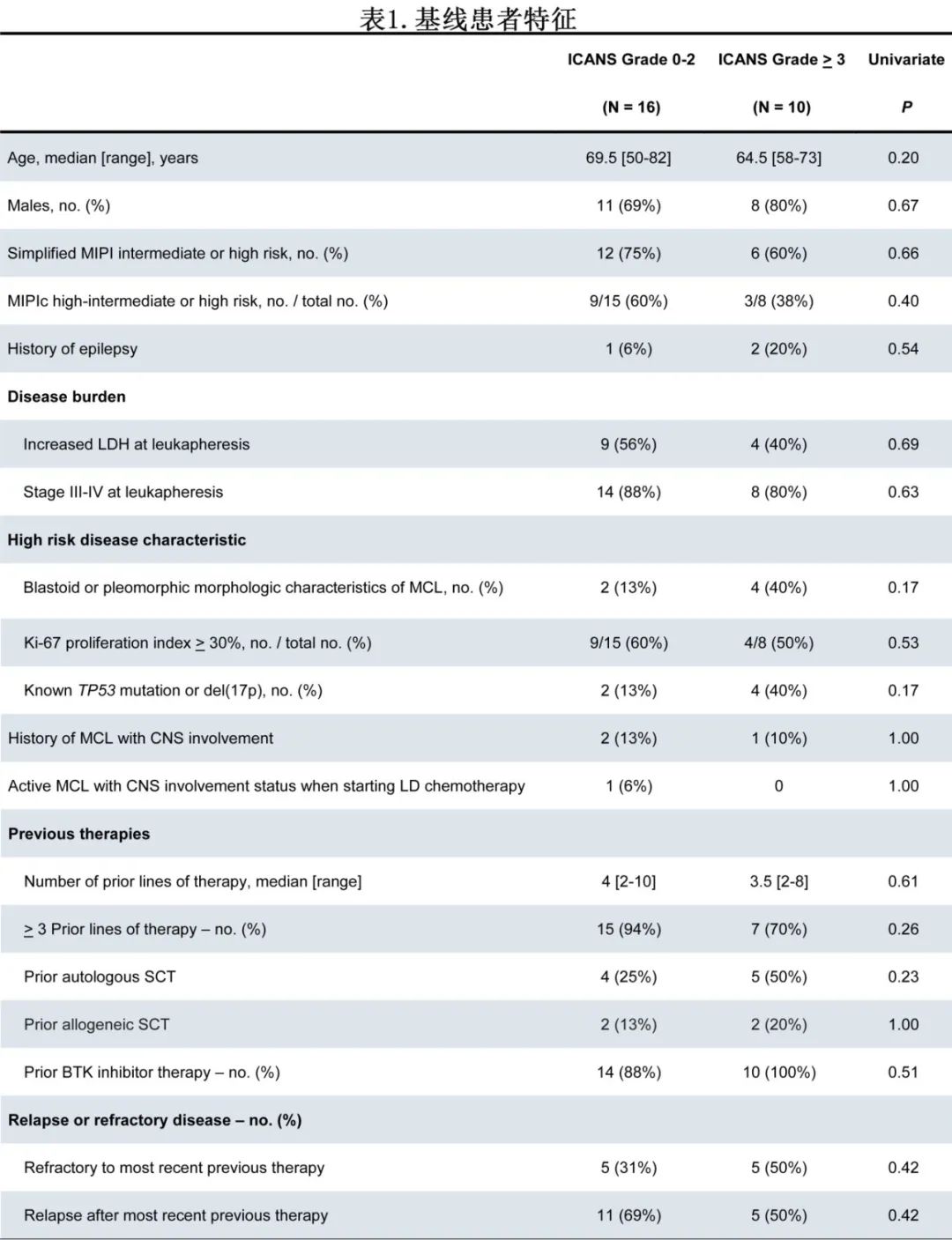
该单中心回顾性研究纳入斯坦福大学接受brexu-cel治疗的r/r MCL患者26例,排除继发性CNS受累患者。CRS和ICANS根据ASTCT标准分级。如表1所示,患者中位年龄67岁,男性居多(73%)。85%为III或IV期,85%既往接受≥3线治疗,1例(4%)患者有癫痫史。3例患者(12%)有继发性CNS受累史,1例患者(4%)在清淋化疗时有活动性CNS受累。除1例患者外(由于氟达拉滨短缺,在第-4~-3日接受苯达莫司汀90mg/m2),所有患者均在第-5~-3日接受清淋化疗,每日使用氟达拉滨30mg/m2和环磷酰胺500mg/m2。9例(35%)患者未发生ICANS;ICANS包括:1~2级7例(27%),ICANS 3级10例(38%)。无患者死于ICANS的直接并发症,但1例患者在输注后约3个月死于HHV-6脑炎。在所有亚组中,中位年龄、性别、MCL国际预后指数(MIPI)风险组、白细胞单采时的疾病负荷(血清乳酸脱氢酶水平)、高危疾病特征和既往治疗史均相似(表1)。未发现任何基线患者、疾病或既往治疗特征与重度ICANS显著相关。有中枢神经系统病史或中枢神经系统有活动性受累的患者中,仅1例发生重度ICANS。
先前CRS级别与ICANS严重程度无关联
26例患者中有25例(96%,图1)发生CRS,中位至CRS发生时间为输注后第3天。发生神经毒性的17例患者均发生CRS,但不同级别ICANS患者的CRS严重程度、发病时间及持续时间差异均无统计学意义。17例患者中包括CRS并发ICANS 5例(29%)和CRS后ICANS 12例(71%)。从输注至发生ICANS的中位时间为6天,重度ICANS患者的ICANS持续时间有延长趋势(10天vs 4天,P=0.06)。1例因患噬血细胞性淋巴组织细胞增生症相关MCL而存在认知损害的患者发生brexu-cel相关神经毒性,在经过超过12个月的随访后未显著恢复。队列中未观察到迟发性神经毒性。
颅脑CT和MRI分析
26例患者中的15例(58%)因≥2级ICANS接受CT头部成像,26例患者中的5例(19%)接受≥2次CT头部成像,以评估脑水肿或颅内异常。常规CT平扫未见包括脑水肿在内的急性颅内异常。
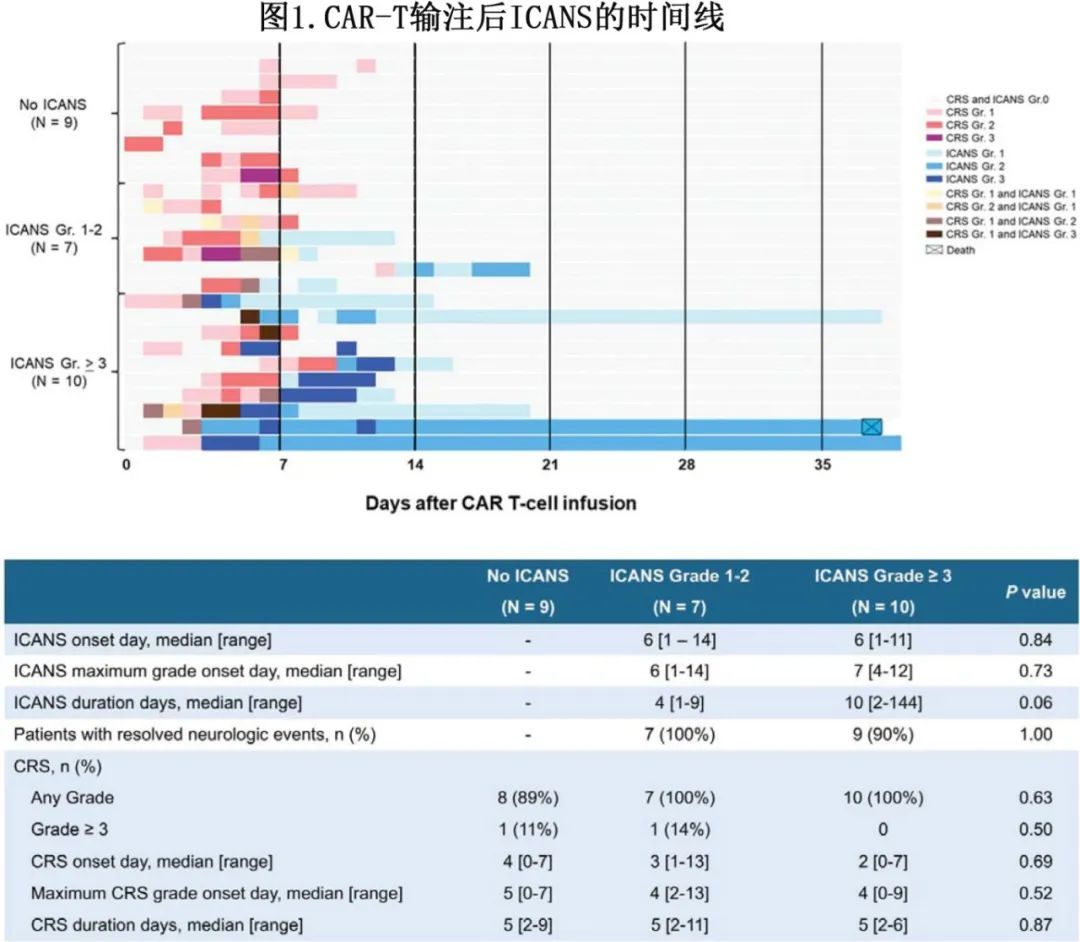
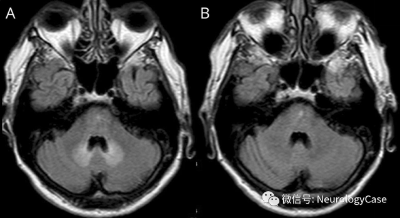
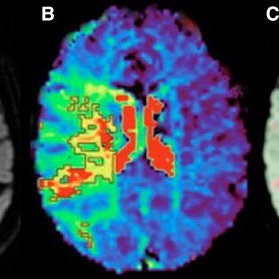
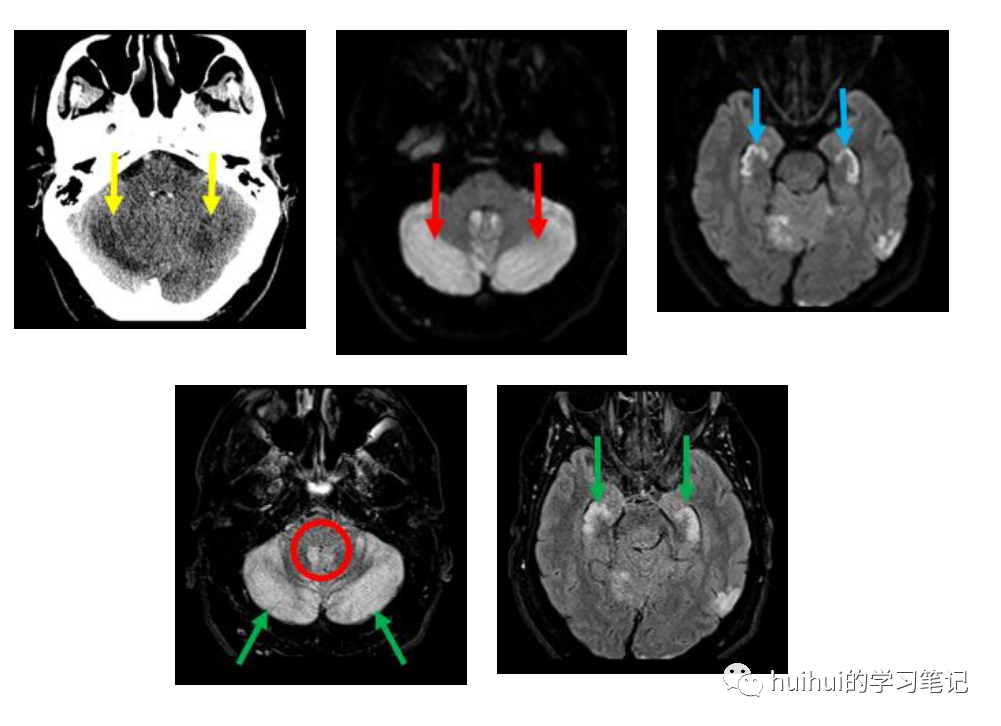
然而,7例持续性神经功能缺损患者的MRI神经成像显示,急性影像学改变的发生率较高。MRI在头部CT后的中位4天进行。这7例治疗前和治疗后均行 MRI 扫描患者中,6例 (86%) 在 MRI 神经影像学上发现变化,1例2级 ICANS 患者在 ICANS 消退后接受了一系列 CNS 受累的 MCL 随访脑部MRI。图 2E 所示的3级 ICANS 患者在治疗后6个月接受随访成像,显示持续性白质 T2 高信号。如果随访时神经系统稳定,ICANS消退后不常规进行额外的MRI。临床 ICANS 期间的脑部 MRI 变化包括一系列 MRI 序列的变化,包括弥散加权成像 (DWI)、T1、T2液体衰减反转恢复 (T2 FLAIR)、梯度回波 (GRE) 和动脉自旋标记 (ASL) 序列(图2)。1例患者出现持续动作和言语输出减少、左右意识模糊症状,左踝阵挛,在脑脊液 (CSF) 邻近的右枕叶皮质组织区域有明显的 T2 FLAIR 高信号,皮质饱满,沿右顶枕叶皮质表面有额外的异常 T2 高信号(图2A-B)。影像学表现不对称,影响右侧大于左侧大脑皮质。另一例患者患有表达性失语症、注意力下降、定向丧失而无其他局灶性结果,脑部 MRI 显示 DWI 异常呈点状和非血管分布(图2C)。在另外2例表现为精神状态波动和失语的患者中,MRI上的 ASL 序列显示左侧大脑半球不对称充血(图2D)。但这些患者在 T2 和 DWI 序列上没有急性改变。在1例既存弥漫性白质病变和病因不明的基础白质脑病的患者中,在急性重度 ICANS 期间,T2 FLAIR上现有的影像学异常显著恶化(图2E)。此外临床表现视力模糊,眼底镜检查显示双侧视神经肿胀的额外证据,神经影像学显示视神经出现支持性 DWI 高信号(图2F)。
脑电图(EEG)分析
11例患者在急性 ICANS 期进行EEG。13个EEG 中的12个为连续监测,平均记录时间为39 h。11个记录中的10个来自重度 ICANS 患者,在免疫效应细胞相关脑病评分临床恶化后获得(图3A)。在11例患者的8例 (73%) 中发现减慢的特征,与轻度 (18%) 或重度 (0%) 减慢相比,55%的患者最常报告中度减慢。3例 (27%)EEG 结果正常。常识别的 EEG 特征包括广泛性节律性δ活动 (GRDA)、广泛性周期性放电、刺激诱导的节律性、周期性或发作性放电和三相波(图3A-C)。
1例患者在 CAR-T 细胞输注后有 ICANS 1 级病史,在 CAR-T 细胞输注后超过28天因精神状态改变返回医院,经 MRI 脑部成像和感染性检查证实为 HHV-6 脑炎(CSF 和血浆中 HHV-6 聚合酶链反应均为阳性)。由于 HHV-6 感染,患者双侧颞叶癫痫发作(图 3D 和3E)。除 HHV-6 脑炎患者外,EEG无其他癫痫发作患者。最后,异常的 EEG 和 MRI 结果与住院时间延长的趋势相关。

EASIX和CAR-HEMATOTOX评分
既往研究表明,清淋前和 CAR-T 细胞输注后早期的 mEASIX 评分可作为重度 CRS 和 ICANS 在重度症状发作前的预测工具,因此作者计算了清淋化疗前、第0天、第+1天和第 +3天的EASIX、sEASIX和mEASIX(图4A)。3个评分与重度 ICANS 的发生均无关。

还计算了 CAR-HEMATOTOX 评分,发现高危(>2) 评分与 CAR-T 细胞输注后中性粒细胞减少时间延长、血小板减少和贫血发生率较高相关。与“低危”CAR-HEMATOTOX评分相比,“高危”CAR-HEMATOTOX评分与显著更高比例的重度 ICANS 相关(图4B)。
30天时的ICANS严重程度与实验室检查结果相关
对于不同 ICANS 严重程度患者,基线(即清淋化疗前)和治疗后的白细胞计数、中性粒细胞绝对计数、单核细胞绝对计数、淋巴细胞绝对计数、血红蛋白和血小板水平相当(图5A)。对于重度 ICANS 患者,输注 brexu-cel 后 30天内贫血和血小板减少更明显(P值分别为0.047和0.002),且浓缩红细胞和血小板输注负荷更高(P值分别为0.03和0.02)。CRP峰值与神经毒性发作同时出现,且与低级别 ICANS 患者相比,重度 ICANS 患者中CRP 峰值水平更高(中位数3.45 vs. 5.7 mg/dL,P=0.02,图5B)。重度 ICANS 患者铁蛋白峰值水平有增高趋势但未达到统计学意义。重度 ICANS 患者的纤维蛋白原最低水平较低(图5C),但所有亚组之间的冷沉淀输注负荷相似。不同 ICANS 严重程度患者的血清乳酸脱氢酶峰值水平相当。

10例重度 ICANS 患者中2例因长期神经症状行腰穿,CSF 中的白细胞计数分别为1和3/μL;1例患者的 CSF进行流式细胞术,证实主要由效应/效应记忆亚群组成的异质性 T 细胞。CD19 未检测到 B 细胞。2例患者的 CSF 葡萄糖水平均在正常范围内,但总蛋白浓度轻度升高,分别为49和53 mg/dL(正常范围:15-45 mg/dL)。综合 CSF 病毒分析包括水痘-带状疱疹病毒、单纯疱疹病毒、HHV-6、巨细胞病毒、EB病毒、肠道病毒和西尼罗河病毒,均为阴性。此外,细菌和真菌的 CSF 培养结果均为阴性,表明无微生物生长。
ICANS的管理
计算并比较重度 ICANS 与非重度 ICANS 患者托珠单抗、皮质类固醇(地塞米松当量)和anakinra的累积剂量(图5D)。两组托珠单抗总累积剂量相似,主要在 ICANS 发生前使用。重度 ICANS 患者接受的总皮质类固醇更多(中位剂量1002.2 mg vs. 170 mg,P<0.001),绝大多数通常在 ICANS 发作后给予(中位剂量947.2 mg vs. 0 mg,P<0.001)。重度 ICANS 患者也接受了较高的anakinra累积剂量(中位剂量1200 mg vs. 0 mg,P=0.02)。
4例重度 ICANS 患者转入ICU,其中1例患者发生需要盐酸右美托咪定治疗的重度激越,另外3例患者主要需要气道监测。2例0-2 级 ICANS患者因3级 CRS 伴低血压转入ICU,需要血管加压药支持和血流动力学监测。总体而言,重度 ICANS 患者的住院时间显著长于轻度或无 ICANS 患者,中位数分别为29天与15.5天 (P<0.001)。
ICANS与生存期
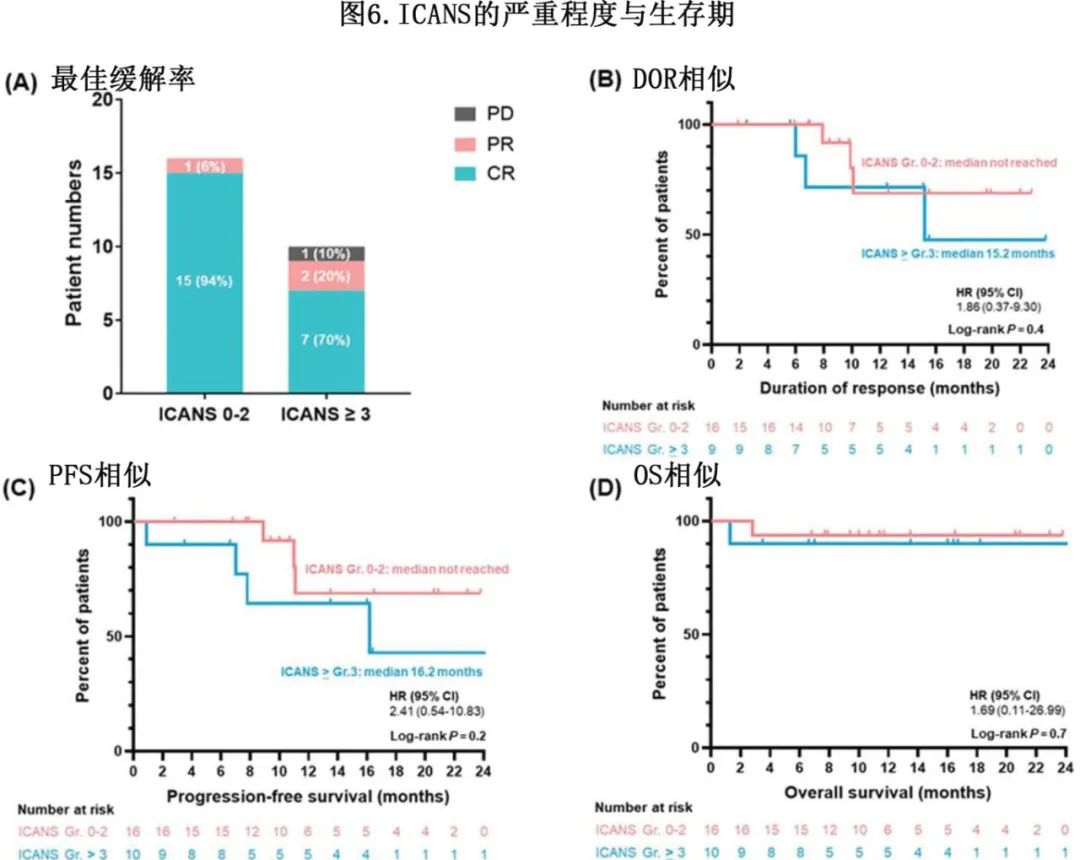
重度与非重度 ICANS 患者的缓解率相似(图6A)。中位随访11.7个月,两组的中位 DOR 相当(15.2个月vs.未达到,对数秩P=0.4;图6B)。两组之间的12个月PFS(77.1% vs. 68.7%,对数秩P=0.3,图6C)和OS(90% vs. 93.8%,对数秩P=0.7,图6D)也没有显著差异。ICANS 的严重程度与DOR、PFS或 OS 均无显著相关性。
总结
该回顾性研究纳入26例接受brexu-cel治疗的r/r MCL患者,评价实验室和影像学相关性,包括脑MRI和EEG,以确定 ICANS 的临床影响。17例 (65%) 患者治疗后出现ICANS,中位至发病时间为第6天。10例 (38%) 患者发生重度(≥3级)ICANS。所有 ICANS 患者均发生前期细胞因子释放综合征 (CRS),但未观察到 ICANS 严重程度与 CRS 分级的相关性。92%的 EEG 显示发作间期改变;无患者因 ICANS 出现明显癫痫发作。输注后脑部 MRI 显示急性神经影像学结果的重度 ICANS 患者中,86%在治疗前的MRI无此结果。重度 ICANS 还与血细胞减少、凝血障碍、累积类固醇暴露增加和住院时间延长的发生率较高相关。然而,重度 ICANS 不影响 MCL 患者的治疗结局。
总的来说,在严重 ICANS 的情况下可发生一系列急性脑 MRI 改变,包括 ICANS 神经放射学以前未报道的脑边缘组织的异常。在 EEG中,发作间期 EEG 模式较常见,而癫痫发作罕见。因此,当癫痫发作或发生临床 ICANS 之外的其他神经系统变化,应进行全面的诊断检查,以排除其他癫痫发作病因,如 CNS 感染。EEG 和 MRI 结果异常与重度 ICANS 的存在和较长的急性住院时间相关,而既存神经系统诊断或淋巴瘤伴 CNS 受累与较差的神经学结局无关。发生重度 ICANS 的 MCL 患者发生贫血、血小板减少和高纤维蛋白原血症的风险较高。然而,ICANS严重程度不影响 MCL 患者的总体治疗缓解和生存期。总体而言,这些对 ICANS 及其临床相关性的新见解,将有助于改善接受 CAR-T 细胞治疗患者的急性神经和肿瘤医疗。
参考文献
Nie EH, et al. Clinical Features of Neurotoxicity Following CD19 CAR T-cell Therapy in Mantle Cell Lymphoma.Blood Adv . 2024 Jan 31:bloodadvances.2023011896. doi: 10.1182/bloodadvances.2023011896.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#神经毒性# #套细胞淋巴瘤# #CAR-T#
24