STTT:厦门大学夏宁邵/张天英/袁权通过溶瘤病毒与T细胞或mRNA疫苗联合治疗可增强抗肿瘤效果
2024-05-06 iNature iNature 发表于上海
该研究设计了一种不易诱导病毒中和抗体的溶瘤病毒(rVSV-LCMVG),并将其与过继转移的T细胞结合。
近年来,基于过继性转移T细胞或溶瘤病毒的抗肿瘤治疗取得了重大进展,但由于其浸润实体瘤的效率有限,单独使用时难以达到预期的抗肿瘤效果。
2024年5月3日,厦门大学夏宁邵、张天英及袁权共同通讯在Signal Transduction and Targeted Therapy在线发表题为“Combination therapy with oncolytic virus and T cells or mRNA vaccine amplifies antitumor effects”的研究论文,该研究设计了一种不易诱导病毒中和抗体的溶瘤病毒(rVSV-LCMVG),并将其与过继转移的T细胞结合。通过将免疫抑制性肿瘤微环境转化为免疫敏感性肿瘤微环境,在B16荷瘤小鼠中,联合治疗显示出优于单一治疗的抗肿瘤效果。无论OV是瘤内注射还是静脉注射,都会发生这种情况。
联合治疗显著增加肿瘤内的细胞因子和趋化因子水平,并将CD8+ T细胞募集到TME触发抗肿瘤免疫反应。过继性转移T细胞预处理和随后的溶瘤病毒治疗通过促进T细胞募集、下调PD-1表达和恢复效应T细胞功能使难治性肿瘤增敏。为了提供具有更大临床转化价值的联合治疗,引入mRNA疫苗来诱导肿瘤特异性T细胞,而不是过继转移T细胞。OVs与mRNA疫苗联合使用也能显著降低肿瘤负荷,延长生存期。本研究从协同作用和机制方面提出了OVs与过继T细胞转移或编码肿瘤相关抗原的mRNA疫苗的合理联合治疗。

随着人们对肿瘤部位免疫活性的了解不断加深,免疫疗法作为一种有效的癌症治疗策略受到了广泛关注,导致癌症研究和临床试验发生了重大转变。肿瘤免疫治疗的主要目的是刺激宿主的抗肿瘤免疫,建立免疫敏感的微环境,最终在提高患者总体生存率的同时实现肿瘤缩小。
嵌合抗原受体(CAR)-T细胞疗法是过继性转移T细胞疗法的一种形式,在治疗B细胞恶性肿瘤中的应用已经超出了预期。然而,与血液系统恶性肿瘤不同,实体肿瘤带来了重大挑战。过继转移的T细胞必须穿越很长的距离才能穿透致密和弹性的基质,并与趋化因子受体建立相互作用。一旦到达肿瘤微环境(TME),大多数T细胞会遇到障碍和免疫抑制因子,阻碍它们的扩张、浸润和诱导肿瘤特异性细胞毒性的能力。基于T细胞的单一疗法在治疗实体肿瘤中的有效性有限,这表明需要额外的辅助治疗来克服这些耐药机制,并将过继性转移T细胞疗法的应用范围扩大到实体肿瘤。
2023年10月2日,两位mRNA疫苗的研发者获得了诺贝尔生理学或医学奖。COVID-19疫苗的加速供应提供了宝贵的健康保护,但它只是触及了mRNA疫苗巨大潜力的表面。此外,mRNA疫苗除了预防传染病外还有一个引人注目的应用:癌症疫苗。随着个性化设计和制备工艺的进步,mRNA疫苗的潜力正在通过其结构、稳定性和递送方法的优化得到进一步实现。目前,数十项临床试验正在测试mRNA疫苗对抗多种癌症的安全性和有效性,包括胰腺癌、结肠直肠癌和黑色素瘤。此外,某些试验正在研究mRNA疫苗与免疫调节药物联合使用的协同潜力,以增强机体对肿瘤的免疫反应。
一种特定的细胞因子编码mRNA疫苗已被证明能够显著缩小肿瘤体积并延长小鼠的生存期,因此,目前正在对这种特定的细胞因子编码mRNA制剂进行临床评估。在胰腺癌患者中,使用编码大量新抗原的mRNA疫苗可以增强免疫系统的应答,在18个月的随访期间,大约一半接受免疫治疗、化疗和mRNA癌症疫苗联合治疗的患者对疫苗表现出成功的免疫应答,并且没有癌症复发。临床和临床前试验已经证明了基于mRNA的个性化癌症疫苗的有希望的结果,表明癌症治疗的潜在范式转变。同样重要的是要认识到,单独的肿瘤mRNA疫苗无法完全解决免疫治疗中遇到的所有障碍。这些挑战包括肿瘤细胞采用的多种免疫逃逸机制、TME引起的干扰和抑制以及肿瘤侵袭。
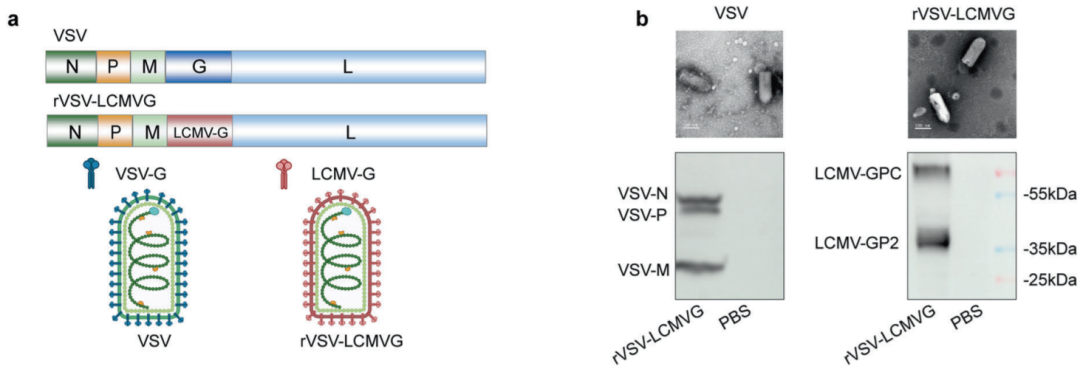
rVSV-LCMVG在体外可将GP33有效递送至肿瘤细胞,指导P14-TCR-T细胞的活化和细胞毒性(图源自Signal Transduction and Targeted Therapy )
溶瘤病毒疗法是另一种很有前途的治疗实体肿瘤的方法,因为它具有选择性,最佳的免疫原性,以及能够以靶向的方式将转基因直接传递到肿瘤部位。溶瘤病毒(OVs)的抗癌作用主要是通过直接裂解肿瘤细胞和对抗肿瘤内的免疫抑制微环境实现的。此外,可以对OVs进行基因修饰,使其在肿瘤环境中表达特定基因,从而增强其溶瘤特性,促进抗肿瘤免疫反应。尽管OVs在癌症治疗中具有巨大的潜力,并且作为肿瘤治疗的一个新分支出现,但正如以往的研究所强调的那样,OVs的临床应用仍然面临着一些挑战。
在目前的临床试验中,瘤内注射被认为是OVs最有效和安全的给药途径,特别是对于表面或局部肿瘤。然而,全身给药,如静脉注射,具有更大的临床应用前景和商业价值,特别是对转移性肿瘤的治疗。尽管OVs作为单独疗法的成功有限,但它们有可能与其他免疫疗法协同作用,如过继细胞疗法。OVs可以通过几种机制增强免疫治疗的疗效。首先,OVs可以通过释放危险信号,促进T细胞在TME内的运输、增殖和持久性来逆转肿瘤免疫抑制。其次,OVs具有裂解肿瘤细胞,释放相关抗原的能力。这有助于抵消由抗原丢失引起的肿瘤逃逸机制。此外,OVs还可以作为趋化因子或细胞因子的载体,进一步增强T细胞的抗肿瘤功能。鉴于这些观察结果,研究人员假设OVs可以增强过继转移T细胞或肿瘤mRNA疫苗的抗肿瘤作用,并试图确定这种协同作用的机制。
参考消息:
https://www.nature.com/articles/s41392-024-01824-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#溶瘤病毒# #抗肿瘤# #mRNA疫苗#
12