2022年Q1:失败临床研究TOP25
2022-07-02 树叶 医药魔方Pro
基于医药魔方网站行业快讯板块、NextPharma数据库以及公开信息和2022年1-3月的《临床研究月报》,筛选出25项值得关注的未达主要终点的临床研究,供大家参考。
基于医药魔方网站行业快讯板块、NextPharma数据库以及公开信息和2022年1-3月的《临床研究月报》,筛选出25项值得关注的未达主要终点的临床研究,供大家参考。
1月TOP5
2022年1月,ASCO GI22会议上,信迪利单抗、帕博利珠单抗、纳武利尤单抗、尼拉帕利等都有研究失利的数据披露。
1. ALG-010133终止开发
1月6日,Aligos Therapeutics宣布停止进一步开发慢性乙型肝炎 (CHB) STOPS ™候选药物 ALG-010133。该决定基于Ⅰ期研究 ALG-010133-101 的新数据,表明在预计的有效剂量(400 mg)下,没有有意义的 HBsAg 降低。同时,计划在后续队列中评估的更高剂量水平(最大可行剂量为 600 mg)也不太可能达到 Aligos 先前定义的降低90%(1 log)的HBsAg水平。受此消息影响,Aligos股价当日下跌57%。
ALG-010133是一种新型化学优化的聚-AC寡核苷酸类似物,与核酸聚合物(NAP)具有结构相似性,能够抑制病毒S抗原转运的寡核苷酸聚合物(STOP)。此前,Poly AC 寡核苷酸已通过临床验证,在Replicor 401 研究中,REP 2139-Mg 或 REP 2165-Mg联合使用替诺福韦和聚乙二醇干扰素报告了约 39% 的功能性治愈率。
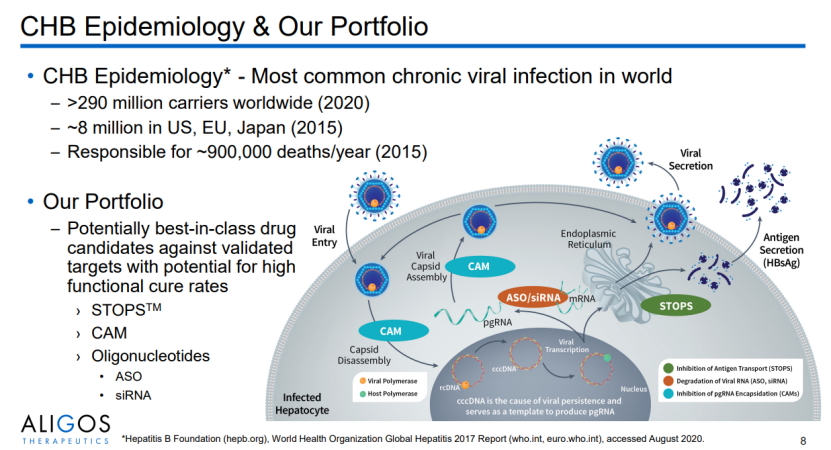
根据美中药源报道,ALG-010133是REP2165的类似物,仅是对碱基进行了化学修饰、序列几乎完全一样。然而,临床结果却完全不同,再次说明机制不清楚导致优化方向不准确在新药开发风险因素控制中的重要影响。也再次彰显,创新药研发对疾病机理和药物作用机制深入研究的重要性。
尽管Aligos 重申在CHB 产品组合中还包括反义寡核苷酸 (ASO)、小干扰 RNA (siRNA)等候选药物,但ALG-010133的终止直接导致Aligos股价本月(截止1月26日)跌幅达到了76%。再次证明,创新药开发的高风险性,产品的成败也决定着公司的未来。
2. AVTX-007和BB21217终止多发性骨髓瘤研究
1月6日,Avalo Therapeutics发布了有关公司增长机会和中期发展组合的更新信息。新闻稿显示,AVTX-007在多发性骨髓瘤的数据表明该疗法的安全和耐受性良好,但在高剂量下未观察到疗效信号,Avalo决定停止多发性骨髓瘤研究,优先开发成人Still病(adult onset still disease,AOSD)适应症,并将在2022 年年中披露Ⅰb 期试验的关键数据。

IL-18在肿瘤微环境中的作用(来源:Avalo)
AVTX-007是一种全人源抗白细胞介素(IL)-18单克隆抗体,具有治疗多种免疫介导疾病的潜力,包括Still病和某些癌症,如复发性或难治性多发性骨髓瘤。IL-18 是一种促炎细胞因子,具有多效性和免疫调节作用。IL-18 的特点是能够与 IL-12 协同诱导自然杀伤 (NK) 和 T 辅助细胞 1 (Th1) 细胞产生干扰素-γ (IFN-g) 和其他炎性细胞因子。已被证明在各种自身炎症性疾病(如斯蒂尔病)以及与多发性骨髓瘤相关的炎症和免疫抑制中发挥关键作用。
同期,2seventy也更新了关键里程碑和商业计划。信息显示,尽管下一代抗 BCMA CAR T bb21217在进行的 CRB-402 临床研究中证实了 bb21217 具有更多幼稚 T 细胞表型的假设,并为实现完全反应的患者提供了令人鼓舞的反应持久性。但是,基于 ABECMA 临床数据的优势和商业价值,2seventy bio 和 BMS 不打算进一步开发 bb21217。
ABECMA是2021年3月26日获得FDA批准的BSMA CAR T细胞疗法,已经在美国实现总收入约1.5 亿美元。为了应对市场需求,2seventy bio 和 BMS 正在投资以提高整个供应链的能力。预计 2022 年,ABECMA在美国收入将达到 2.50-3 亿美元。
3. 信迪利单抗治疗胰腺癌的III期研究
1月召开的美国临床肿瘤学会胃肠道癌症研讨会(ASCO GI22)上,浙江大学医学院附属第一医院梁廷波教授团队报告了一项信迪利单抗联合改良FOLFIRINOX方案(mFFX)治疗中国转移性和复发性胰腺癌患者的随机、III期CISPD3研究(Abstract # 560)。
数据显示,信迪利单抗联合mFFX组的中位OS与mFFX组相似(10.9个月 vs 10.8个月,HR 1.09,95%CI 0.70-1.69),信迪利单抗联合mFFX组的中位PFS为5.9个月,mFFX组为5.7个月(HR 0.93,95%CI 0.62-1.41),中位PFS、中位OS均未达到显著性。
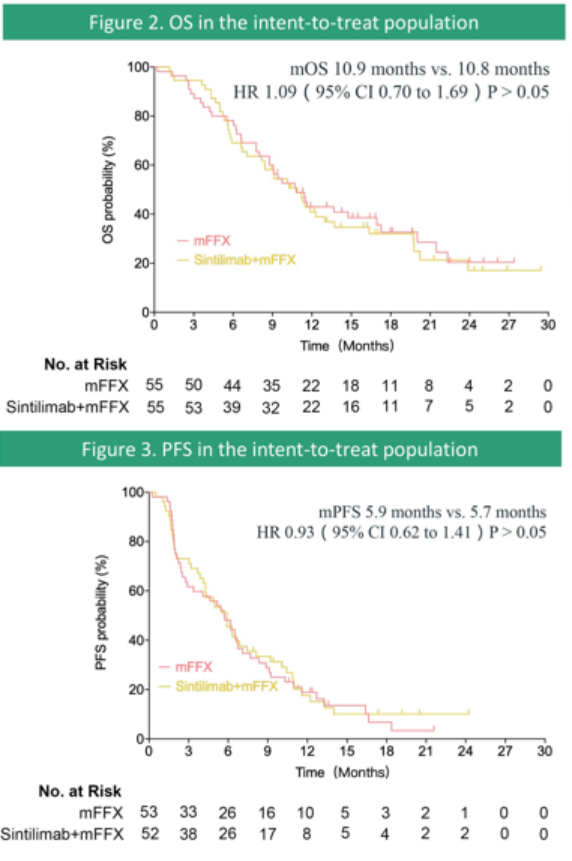
信迪利单抗联合mFFX治疗数据(来源:ASCO GI22)
有意思的是,纳武利尤单抗也在会上披露了联合改良FOLFIRINOX方案治疗胰腺癌的临床Ⅱ期研究数据。数据显示,纳武利尤单抗在胰腺癌的治疗中,临床获益与PD-L1表达水平之间没有关联。主要表现在次要终点的中位总生存期,纳武利尤单抗联合改良FOLFIRINOX方案在未表达PD-L1(CPS:联合阳性分数,CPS<1)的患者中相较于PD-L1阳性患者显示更好的获益(13.54 m vs 8.18 m)。
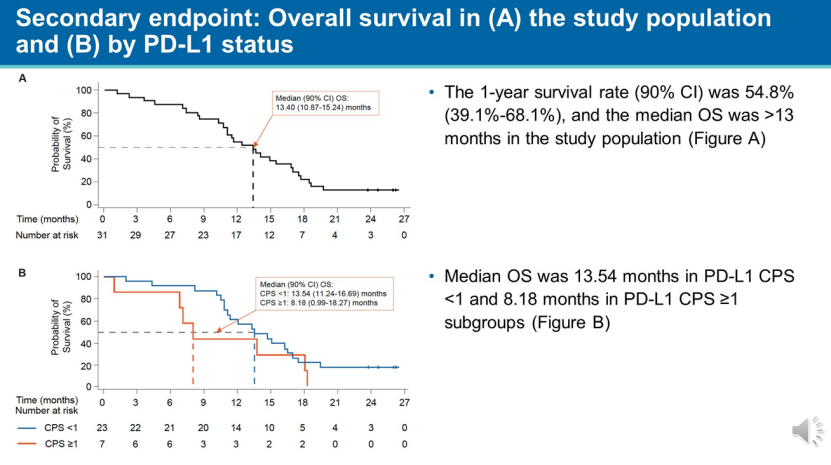
似乎免疫疗法临床获益与PD-L1表达水平之间没有关联的结论,与此前免疫疗法在其他瘤种中表现的临床数据和认知不符。不过,该研究仅纳入30例患者,样本量较少,正确性仍有待确认。

此外, ASCO GI会议上,尼拉帕利联合PD-1单抗dostarlimab与放疗披露的临床Ⅱ期研究(Abstract #564,NCT04409002)数据,也未达到预先设定的优效标准。
同时,TYME Technologies本月也公布了SM-88在转移性胰腺癌中相较标准护理化疗未能提高生存率。受此消息,TYME公司的股价也下跌了35%。
4. 纳武利尤单抗联合标准疗法一线治疗结肠癌的Ⅱ期研究
在ASCO GI22会议上,纳武利尤单抗公布了联合5-氟尿嘧啶/亚叶酸/奥沙利铂 (mFOLFOX6)以及贝伐单抗 (Avastin; BEV)标准护理(SOC)一线治疗转移性结直肠癌(mCRC)的临床研究(CheckMate 9X8,NCT03414983)结果。
CheckMate 9X8 是一项随机、开放标签的Ⅱ/Ⅲ 期研究,共招募了 195 名患者,并按 2:1 随机分组。数据显示,接受纳武利尤单抗联合SOC的患者PFS为11.9个月(95% CI,8.9-15.7),而SOC为11.9个月(95% CI,10.1-12.2),未能达到其根据盲态独立中心评估(BICR) 的 PFS 主要终点(HR = 0.81;95% CI,0.53-1.23;P = 0.3 )。
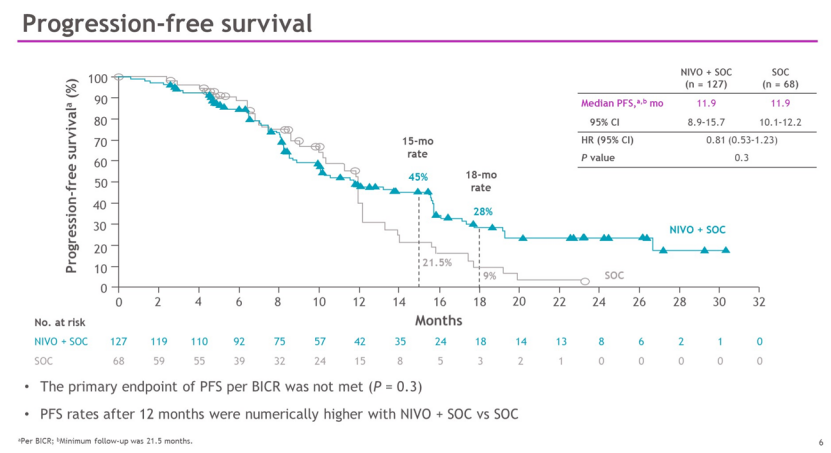
来源:ASCO GI22
不过,在15个月时,纳武利尤单抗联合SOC的PFS率数值上优于SOC(45% vs 21.5%)。微卫星稳定 (MSS) 患者群体PFS与所有随机患者相当,接受纳武利尤单抗加SOC的MSS患者PFS为 11.8 个月(95% CI,8.9-15.7),而接受 SOC 的患者为11.9个月(95% CI,10.1-12.2)。
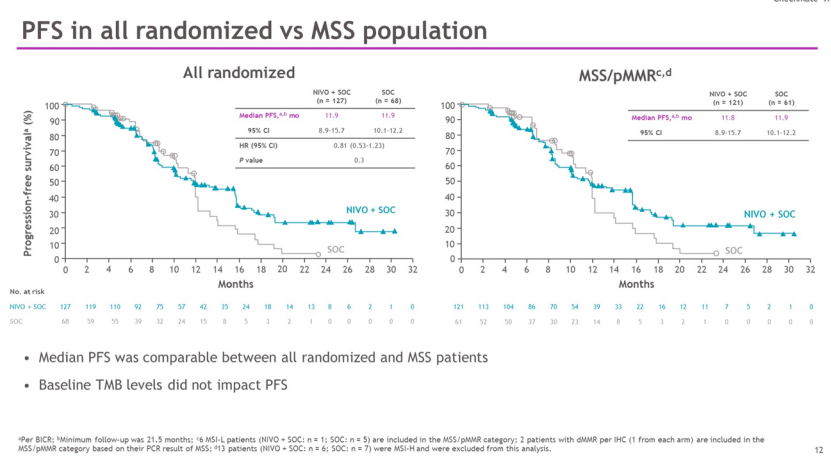
来源:ASCO GI22
纳武利尤单抗联合SOC组的ORR为60%,SOC组为46%。纳武利尤单抗联合SOC在DCR (91% vs 84% )和中位 DOR(12.9 个月 vs 9.3 个月)上也明显高于SCO。但是,在次要终点总生存期上,加入纳武利尤单抗同样未显著延长生存期。
来源:ASCO GI22
5. 帕博利珠单抗治疗胆管癌的Ⅱ期研究
ASCO GI22会议上,帕博利珠单抗(PEM) 联合粒细胞巨噬细胞集落刺激因子 (GM-CSF) 治疗晚期胆管癌 (ABC)的临床Ⅱ期最终结果披露。虽然PEM加GM-CSF的组合安全且耐受性良好,其ORR 也高于PEM单药治疗的预期,但未达到疗效的目标ORR阈值。

来源:ASCO GI22(Abstract #444)
该研究纳入42例患者,详细数据显示,最终的ORR为12% (95% CI: 14, 43),中位PFS为63天 (95% CI: 55, 125),中位OS为393天(95% CI: 245, 573)。PD-L1 表达对 ORR、PFS或OS没有显著差异;HBV/HCV+显示出更高的ORR和更长的中位 PFS(276 vs 63 天,p = 0.06)、OS(1033 vs 323 天,p=0.052)趋势。
2月TOP10
2022年2月,帕博利珠单抗和仑伐替尼的“可乐”组合继去年12月LAEP-007研究失利之后,在一线晚期尿路上皮癌的治疗中再次败北,其他还包括度普利尤单抗治疗慢性自发性荨麻疹III期研究失败、阿维鲁单抗2项临床研究错失终点、RNA疗法受挫等。
1. 帕博利珠单抗联合仑伐替尼一线治疗尿路上皮癌的III期研究
2月,在2022 年泌尿生殖系统癌症研讨会(ASCO GU22)上,公布了帕博利珠单抗联合仑伐替尼在不适合铂类化疗的晚期尿路上皮癌患者中作为一线治疗的临床III期研究(LEAP-011)最终数据。
结果显示,帕博利珠单抗联合仑伐替尼相较于帕博利珠单抗没有显著提高无进展生存期(PFS)和总生存期(OS),研究未达到主要终点。
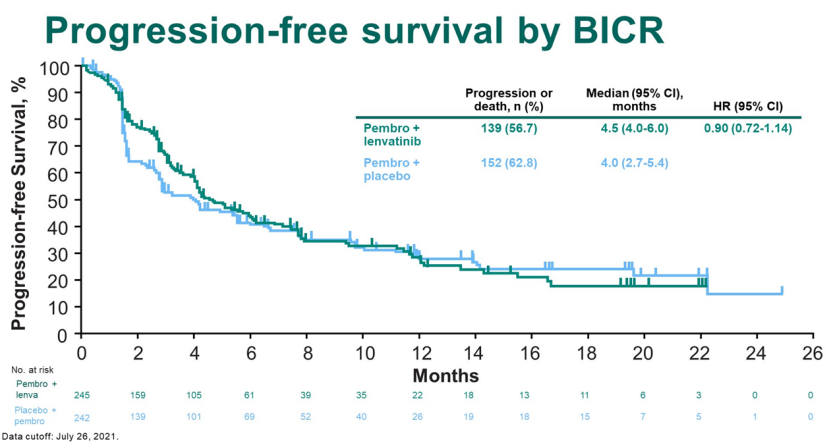
来源:ASCO GU22
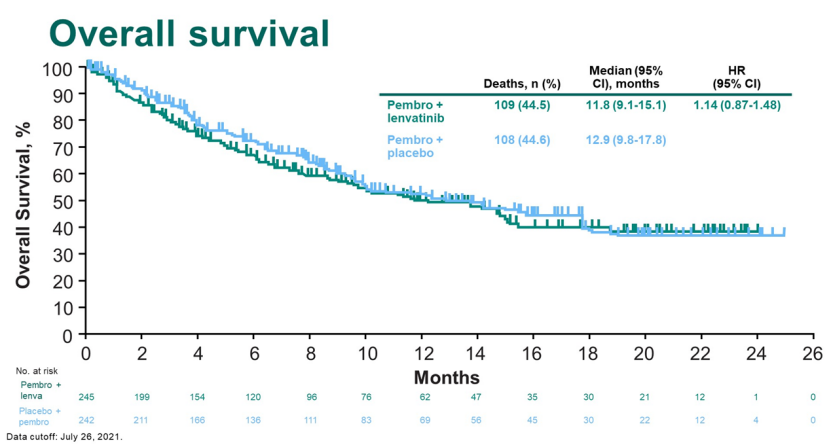
来源:ASCO GU22
LEAP-011研究是一项双盲、随机对照研究,计划招募694名患者,并设计在530例PFS事件后进行OS和PFS的中期分析,或在第一位患者被随机分组后大约24个月时。然而,一个独立的数据监测委员会(每3个月审查一次安全性数据)依据 OS、PFS 和总体缓解率 (ORR) 数据确定的帕博利珠单抗联合仑伐替尼获益风险比,决定提前停止试验患者的招募。最终,487名患者入组,其中245人入组仑伐替尼组,242人入组安慰剂组。
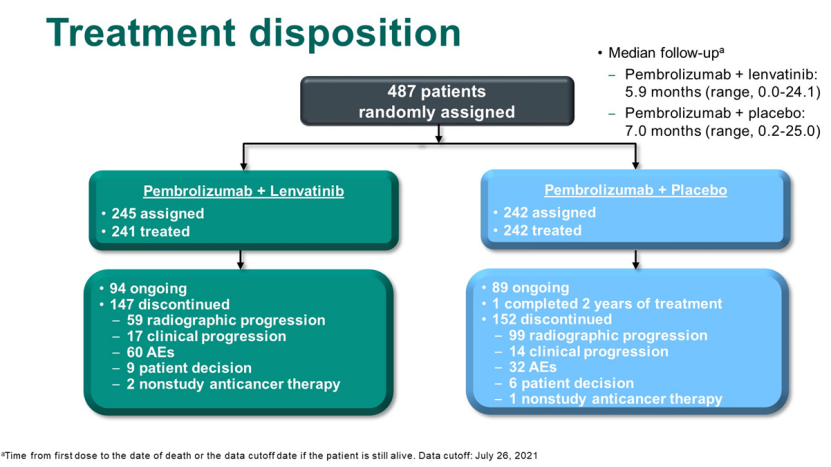
来源:ASCO GU22
安全性方面,帕博利珠单抗联合仑伐替尼显示更高比例的不良事件发生率和严重不良事件。值得注意的是,仑伐替尼组19.9% 的患者因TRAE而停药,而安慰剂组为9.1%。此外,仑伐替尼也导致了更显著的相关不良事件发生率。

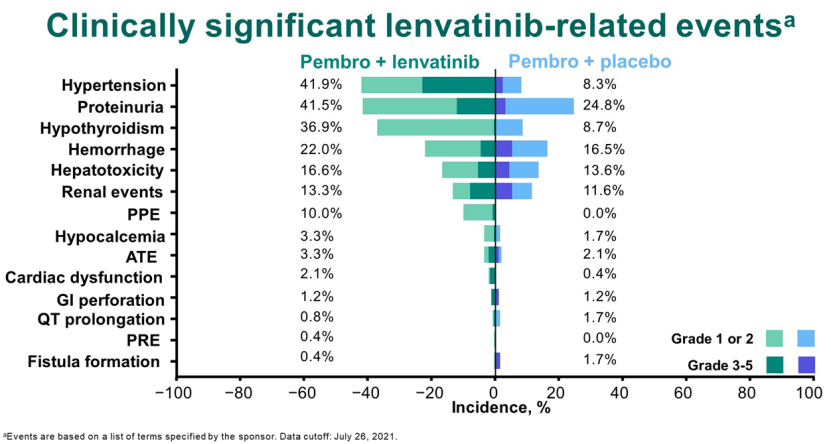
来源:ASCO GU22
帕博利珠单抗联合仑伐替尼已经先后在美国、欧盟和日本等地获批肾细胞癌和子宫内膜癌等适应症,2021年默沙东收获来自仑伐替尼的超7亿美元销售分成,在一定程度上也证明了帕博利珠单抗联合仑伐替尼在癌症治疗中的潜力。不过,去年12月帕博利珠单抗联合仑伐替尼与帕博利珠单抗头对头的III期临床研究(LAEP-007)结果正式披露,联合治疗并没有在肺癌中显示明显获益。
除了仑伐替尼,帕博利珠单抗联合奥拉帕利的合作也为默沙东在2021带来近10亿美元的分成收入;然而,对于阿斯利康自身而言,奥拉帕利却没有为自己的PD-L1药物英飞凡(度伐利尤单抗)增加获益。ASCO GU22会议上,度伐利尤单抗联合奥拉帕利的临床Ⅱ期研究 (BAYOU,NCT03459846)显示,联合治疗相较于单独使用度伐利尤单抗没有显著延长先前未治疗且不适合铂类治疗的转移性尿路上皮癌患者的PFS,错失主要终点。
此外,阿维鲁单抗在顺铂不耐受且PD-L1 阳性晚期尿路上皮癌患者的临床Ⅱ期研究中(ARIES),没有达到改善患者的1 年总生存期的研究目的。阿替利珠单抗在ASCO GU22会议上也有不利消息公布,治疗晚期阴茎鳞状细胞癌患者的Ⅱ期PERICLES试验,同样也未达到其1年无进展生存期的主要终点。
2.度普利尤单抗治疗慢性自发性荨麻疹的III期研究
2月18日,赛诺菲/再生元宣布Dupixent (度普利尤单抗) 用于治疗omalizumab(奥马珠单抗)难治的慢性自发性荨麻疹(CSU)患者III期CUPID STUDY B研究未达到基于预先指定的疗效而终止研究。虽然在减少瘙痒和荨麻疹方面观察到积极的数值趋势,但中期分析的结果显示,该研究在主要终点方面没有统计学意义。
LIBERTY-CUPID关键项目于2020年启动,采用了加速直接进入3期的战略。LIBERTY-CUPID临床计划的Study B 评估了度普利尤单抗在83名年龄在12至80岁CSU患者中的疗效和安全性。这些患者尽管接受了标准治疗,但仍存在症状且对奥马珠单抗不耐受或未充分应答。在为期24周的治疗期间,患者每两周接受度普利尤单抗+抗组胺药或安慰剂+抗组胺药治疗。
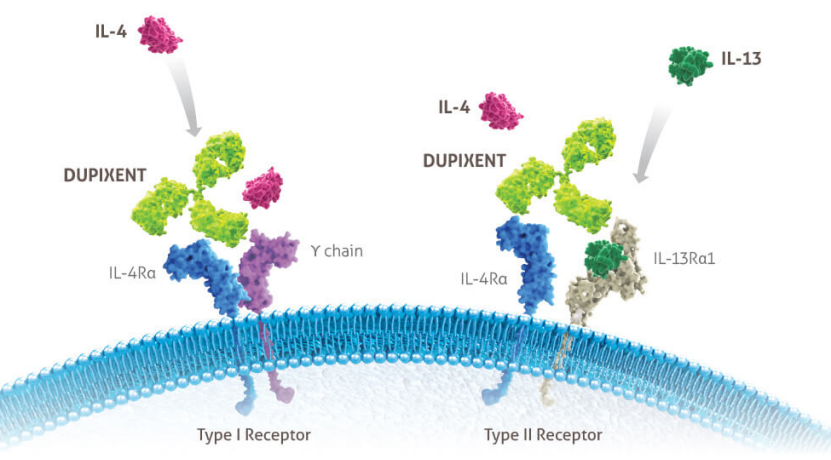
度普利尤单抗作用机制(来源:dupixenthcp.com)
度普利尤单抗通过结合IL-4Rα同时阻断白细胞介素 4 (IL-4) 和白细胞介素 13 (IL-13) 通路的信号传导。IL-4 和 IL-13 是2型炎症的关键和核心驱动因素,在特应性皮炎、哮喘和慢性鼻窦炎伴鼻息肉 (CRSwNP) 中起主要作用。度普利尤单抗目前在美国、欧洲、中国、日本和世界其他国家获批用于治疗特定中度至重度特应性皮炎的特定患者,以及不同年龄人群中的某些哮喘或慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)患者。
自发性荨麻疹(CSU)是一种慢性炎症性皮肤病,其特征是皮肤上突然出现荨麻疹和/或皮下深处肿胀。尽管进行了标准护理治疗,但患有 CSU 的人经常会出现持续性瘙痒或灼烧感等症状,显著影响生活质量。肿胀通常发生在面部、手和脚上,但也会影响喉咙和上呼吸道。这项临床计划的Study A评估了度普利尤单抗作为标准疗法抗组胺药的附加疗法与单独使用抗组胺药相比在138名6岁及以上CSU患者的疗效和安全性。
赛诺菲和再生元正在迅速推进一项广泛的临床开发计划,以评估Dupixent在具有显著未满足需求的疾病以及2型炎症相关疾病中的作用。两家公司最近还宣布了Dupixent在嗜酸细胞性食管炎 (EoE) 和结节性痒疹 (PN) 方面的III期积极结果,预计今年晚些时候还将在儿童EoE、慢性诱导性荨麻疹(CindU) 和手足特应性皮炎方面取得更多结果。
3. 他拉唑帕尼联合阿维鲁单抗治疗透明细胞肾细胞癌中的 II 期研究
ASCO GU22会议上,也公布了一项由研究者发起的评估晚期透明细胞肾细胞癌 (RCC) 队列中联合他拉唑帕尼和阿维鲁单抗的单中心II期试验数据。结果显示,在VHL缺陷型TKI/ICB难治性RCC队列中,研究未达到预定继续入组的疗效阈值,结果不支持在该人群中进一步研究。
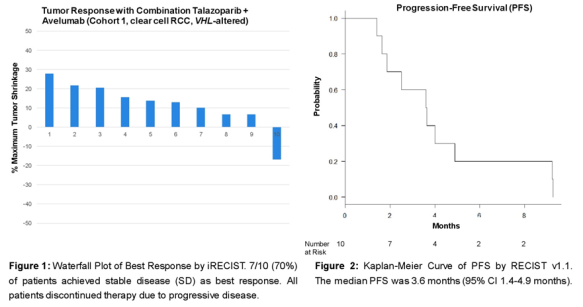
来源:ASCO GU22
VHL失活可能导致DNA损伤反应通路受损和复制压力增加,从而增加透明细胞肾细胞癌的基因组不稳定性。该研究主要分为两个队列,对于队列1(VHL RCC),患者之前须接受过 VEGFR TKI 和ICB治疗,并且之前最多接受过3线治疗。主要终点是依据iRECIST评估的客观缓解率,次要终点包括无进展生存期、安全性和耐受性。
这是PARPi和ICB联合治疗晚期透明细胞RCC的首个临床研究。通过MSK-IMPACT组织NGS 测序检测到所有患者表现VHL缺失,3/10 (30%) 的患者在DDR特异性基因中同时发生体细胞或种系改变。研究未见客观肿瘤反应,疾病控制率为60%(6/10),疾病稳定为患者最佳反应。所有患者均出现疾病进展,中位PFS为3.6个月(95% CI 1.4-4.9)。
4. KSI-301治疗年龄相关性黄斑变性的IIb/III期研究
2月23日,Kodiak公司宣布,KSI-301用于治疗先前未接受治疗的新生血管性(湿性)年龄相关性黄斑变性(wAMD)患者的IIb/III期试验未能达到主要疗效终点。受此消息影响,该公司股价大跌80%。
KSI-301是一种基于Kodiak抗体-生物聚合物偶联物(Antibody Biopolymer Conjugate ,ABC)平台开发的抗VEGF疗法,用于提高药物的稳定性和在眼内的滞留时间。该试验入组了559名受试者,并随机分为两组:KSI-301 5mg灵活的长间隔方案(Q12W/Q16W/Q20W)和阿柏西普(aflibercept)2mg的固定短间隔方案(Q8W)。所有受试者在0周、4周和8周时给予三个月负荷剂量。之后,阿柏西普组受试者每2个月接受一次治疗;在负荷剂量治疗结束后的第20周开始评估KSI-301受试者,并根据预定义的疾病活动标准,每3个月、4个月或5个月接受一次KSI-301治疗。
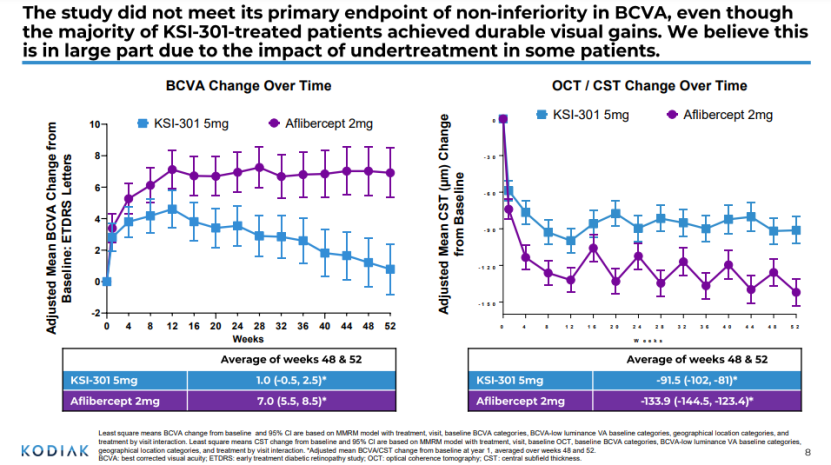
结果显示,与每8周给药一次阿柏西普相比,KSI-301组患者的视力改善不如阿柏西普。目前,阿柏西普(VEGFR-Fc融合蛋白)的给药频率可以做到每2个月1次(前3个月每月1次),是wAMD的标准疗法。诺华开发的Beovu(brolucizumab)是一个单链抗体片段(scFv),可以实现更高摩尔剂量给药,是首个治疗wAMD只需要每3个月注射1次的anti-VEGF疗法;罗氏的Faricimab于今年1月28日刚获FDA批准,是首个获批在治疗DME和wAMD的每4个月间隔给药的药物。
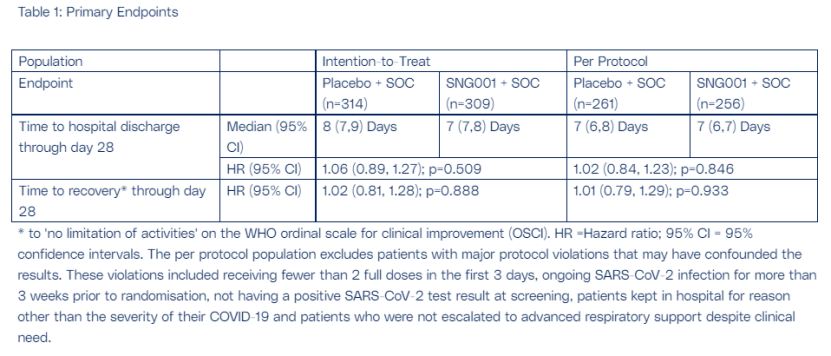
5. SNG001治疗新冠肺炎的III期研究
2月21日,Synairgen公司宣布,SNG001治疗新冠肺炎住院患者的临床III期SPRINTER研究未达到其主要或关键次要疗效终点。受此消息影响,Synairgen公司股价下跌84%。
SNG001是一种天然的广谱抗病毒蛋白干扰素β,可以直接吸入肺部,来刺激机体产生免疫反应,防止感染新冠肺炎患者因需要吸氧而缺乏呼吸机时导致的病情恶化。SPRINTER是一项随机、双盲、安慰剂对照的临床III期研究,旨在评估SNG001治疗中度新冠肺炎住院患者的有效性和安全性。研究共纳入623名受试者,随机分配并接受SNG001 (n=309)和安慰剂(n=314)治疗。
结果显示,接受SNG001的患者也不太可能恢复到“活动不受限制”的状态,在出院率上也并没有高于安慰剂组。研究者称,标准护理的演变(如该试验中87%的患者在基线时曾接受系统性皮质类固醇治疗新冠)可能是未达到主要终点的部分原因。在次要终点方面,使用SNG001治疗的患者与使用安慰剂的患者相比,35天内进展为严重疾病或死亡的相对风险分别降低27%和36%。
不过,Synairgen公司并未放弃SNG001,仍在开发用于居家治疗的临床研究,已经计划开展临床Ⅲ期试验。辉瑞在Paxlovid片剂成功上市之后,已经停止作用于SARS-CoV-2病毒3CLpro蛋白酶静脉注射药物PF-07304814的临床研究。PF-07304814也曾被纳入NIH 赞助的 ACTIV-3 研究中,该研究评估了用于住院 COVID-19 患者的各种药物,包括辉瑞、礼来、葛兰素史克、诺华等公司的新冠候选药物。
6. Sepofarsen治疗Leber先天性黑蒙症10型的Ⅱ/Ⅲ期研究
2月11日,RNA疗法公司ProQR Therapeutics宣布Sepofarsen用于治疗CEP290介导的Leber先天性黑蒙症10 (LCA10) 的关键Ⅱ/Ⅲ期 Illuminate试验在第12个月未达到其最佳矫正视力 (BCVA) 的主要终点。受此消息影响,ProQR股价大跌74%,当前市值不足1亿美元。
Sepofarsen(QR-110)是一种研究性RNA疗法,旨在恢复由于CEP290基因突变 (p.Cys998X) 导致的Leber先天性黑蒙症10的眼睛视力。该突变导致mRNA和非功能性CEP290蛋白的异常剪接,Sepofarsen旨在恢复正常(野生型)CEP290 mRNA 并随后产生功能性CEP290蛋白。Sepofarsen通过眼部玻璃体内注射给药,并已在美国和欧盟获得孤儿药指定,并获得 FDA 的快速通道指定和罕见儿科疾病指定。

LCA是儿童遗传病导致失明的最常见原因,由一组疾病组成,其中LCA10 是最常见和最严重的形式之一。LCA10由EP290基因突变引起,其中c.2991+1655A>G(p.Cys998X)突变患病率最高,LCA10导致早期视力丧失,致使大多数人婴幼儿时期便失去视力。迄今为止,还没有批准的治疗方法可以治疗该疾病。
Illuminate是一项随机、假对照试验,在9个国家的14个研究基地招募了36名年龄在8岁或以上的受试者,随机分为三组 (1:1:1) 分别接受sepofarsen高剂量 (160 μg/80 μg 负荷剂量/维持剂量)和低剂量sepofarsen (80 μg/40 μg 负荷剂量/维持剂量)或假手术,通过玻璃体内注射给予sepofarsen,假手术模拟不注射药物。最终结果显示,接受sepofarsen治疗的任一治疗组与假治疗组中均未观察到任何益处。
7. Omecamtiv Mecarbil治疗心力衰竭的Ⅲ期研究
2月15日,Cytokinetics公布了omecamtiv mecarbil 在射血分数降低的心力衰竭患者(HFrEF)中的Ⅲ期研究METEORIC-HF关键数据。METEORIC-HF 评估了与安慰剂相比,omecamtiv mecarbil 治疗对运动能力的影响,结果显示对运动耐量主要终点没有产生影响。METEORIC-HF的结果将在美国心脏病学会 (ACC) 第71届年度科学会议暨博览会上进行公布。
Omecamtiv mecarbil 是一种研究性、选择性、小分子心肌肌球蛋白激活剂,用于治疗射血分数降低的心力衰竭。该试验于2021年6月完成了276名患者的入组,omecamtiv mecarbil 在 METEORIC-HF中的安全性特征与包括GALACTIC-HF在内的先前临床试验一致。
Omecamtiv mecarbil 目前处于NDA阶段,主要基于另外一项研究(GALACTIC-HF)的临床数据。在GALACTIC-HF研究中,接受omecamtiv mecarbil 治疗的患者中,与安慰剂相比,在降低心血管 (CV) 死亡或心力衰竭事件(心力衰竭住院和其他心力衰竭紧急治疗)的主要复合终点风险方面具有统计学意义改善。
详细见:实验性心脏肌球蛋白激活剂omecamtiv mecarbil在心衰患者中对运动能力没有任何益处
8. 曲地匹坦治疗胃轻瘫综合症的Ⅲ期研究
2月4日,Vanda公布了曲地匹坦(Tradipitant)治疗胃轻瘫综合症(gastroparesis)的临床Ⅲ期研究数据(VP-VLY-686-3303),未达到其预先指定的12周时恶心严重程度在基线变化上的差异性主要终点,致使当日股价收盘下跌18%。

Tradipitant 是一种神经激肽-1受体拮抗剂,是Vanda从礼来公司获得全球开发权利的候选分子。Tradipitant 目前正在进行胃轻瘫和晕动病等疾病的临床开发。
不过,Vanda声称在初步探索性分析中已经确定了潜在的混杂因素,这些混杂因素可能掩盖了之前在tradipitant的 II 期研究中观察到的有益效果,其中包括两个治疗组之间急救药物使用的基线不平衡等。当限制在基线时未使用救援药物的患者组中进行分析并调整依从性差时,Vanda确定了药物在许多症状和整个研究期间的有力证据,包括在第12周恶心变化的预定主要终点。
9. 阿维鲁单抗治疗NSCLC的Ⅲ期研究
2月8日,辉瑞公布了第4季度和全年业绩报告,其中也更新了阿维鲁单抗用于非小细胞肺癌(NSCLC)的临床Ⅲ期研究(JAVELIN Lung 100)信息。该研究评估了阿维鲁单抗单药治疗的两种给药方案与铂类双药化疗相比,在一线治疗PD-L1表达阳性mNSCLC患者中的安全性和有效性。虽然阿维鲁单抗在该人群中显示出临床活性,但该研究在评估的任一一种阿维鲁单抗给药方案均未达到高表达PD-L1人群中总生存期和无进展生存期的主要终点。
该试验中阿维鲁单抗的安全性与在整个JAVELIN临床开发计划中观察到的一致。目前,阿维鲁单抗未被批准用于治疗任何NSCLC患者。JAVELIN Lung 100 试验的全部结果将在未来公布。
此外,1月31日辉瑞也宣布终止vupanorsen(PF-07285557)的临床开发计划,Vupanorsen 是Ionis发现的一种研究性反义疗法,正在评估用于降低心血管 (CV) 风险和严重高甘油三酯血症 (SHTG) 的潜在适应症。辉瑞声称,尽管研究达到主要终点,在统计学上显著降低了非高密度脂蛋白胆固醇 (non-HDL-C)、甘油三酯 (TG) 和血管生成素样 3 (ANGPTL3)。然而,观察到的非HDL-C和TG降低幅度不支持继续进行CV风险降低或SHTG的临床开发计划。并且, Vupanorsen 还与肝脏脂肪的剂量依赖性增加有关,较高剂量与肝酶丙氨酸氨基转移酶 (ALT) 和天冬氨酸氨基转移酶 (AST) 升高相关。
10. T101治疗慢性乙型肝炎的II期研究
近期,天士力发布公告,决定暂停全资子公司天士力创世杰(天津)生物制药有限公司研发的乙型肝炎腺病毒注射液T101的临床II期研究,并终止T101后期开发。

T101 是拟用于慢性乙型肝炎的治疗性疫苗,是天士力与法国 TRANSGENE 公司合作研发的项目。TRANSGENE在全球同步开发的对应产品TG1050在德国、法国及加拿大完成的 I 期临床研究结果表明该药安全性和耐受性良好。
T101目前处于 II 期临床研究,采用多中心、随机开放组间对照试验,以评价T101联合核苷类似物治疗慢性乙型肝炎患者的安全性、有效性和免疫原性,并探索最佳的给药方案,为 III 期临床方案的设计提供依据。主要疗效指标为评价不同时期HBsAg较基线下降值。
中期分析结果显示,15周和30周时T101用药组和核苷类似物基础用药组HBsAg较基线下降值差异没有统计学意义,疗效未达预期。同时,在科学分析了T101的作用机制特点,并评估了与其作用机制类似的其它治疗性疫苗的临床试验结果及开发策略后,判断T101单药联合核苷类似物难以实现慢性乙型肝炎的功能性治愈,决定暂停T101项目。
截至公告日,T101 研发投入共计31,090.71万元,其中研发费用5,115.71万元,资本化金额 25,975 万元。
3月TOP10
2022年3月,罗氏TIGIT免疫药物Tiragolumab未能接棒LAG3“好运气”,闯关失败;偏向型IL-2临床失利,导致Nektar股价下跌超60%;选择性雌激素受体降解剂amcenestrant乳腺癌II期临床错失主要终点;PD-1/L1免疫疗法共同面对不利消息,两家反义疗法研究受挫等。在此,为大家筛选临床研究失利TOP10,以供参考。
1. Tiragolumab联合阿替利珠单抗治疗广泛期小细胞肺癌的III期研究
3月30日,罗氏宣布TIGIT抗体tiragolumab联合阿替利珠单抗和化疗(卡铂和依托泊苷)作为广泛期小细胞肺癌( ES-SCLC )患者初始(一线)治疗的III期临床试验(SKYSCRAPER-02)未达到无进展生存期的共同主要终点,并且在计划的最终分析中也不太可能达到统计学意义。
SKYSCRAPER-02研究是一项全球 III 期、随机、安慰剂对照的双盲研究,在490名广泛期患者中评估tiragolumab联合阿替利珠单抗和化疗对比阿替利珠单抗和化疗在小细胞肺癌中的疗效。阿替利珠单抗是第一个在 ES-SCLC(III 期IMpower133研究)中显示出生存获益的肿瘤免疫疗法,并且也是第一个在该适应症中获得批准的免疫疗法。PD-1/L1免疫疗法之后,业界一直探索新的免疫疗法,TIGIT便是其中热门追逐的靶标之一,先后吸引了罗氏、吉利德、默沙东、诺华等国际巨头入局,同时国内外企业也在基于TIGIT开发特异性双抗疗法。
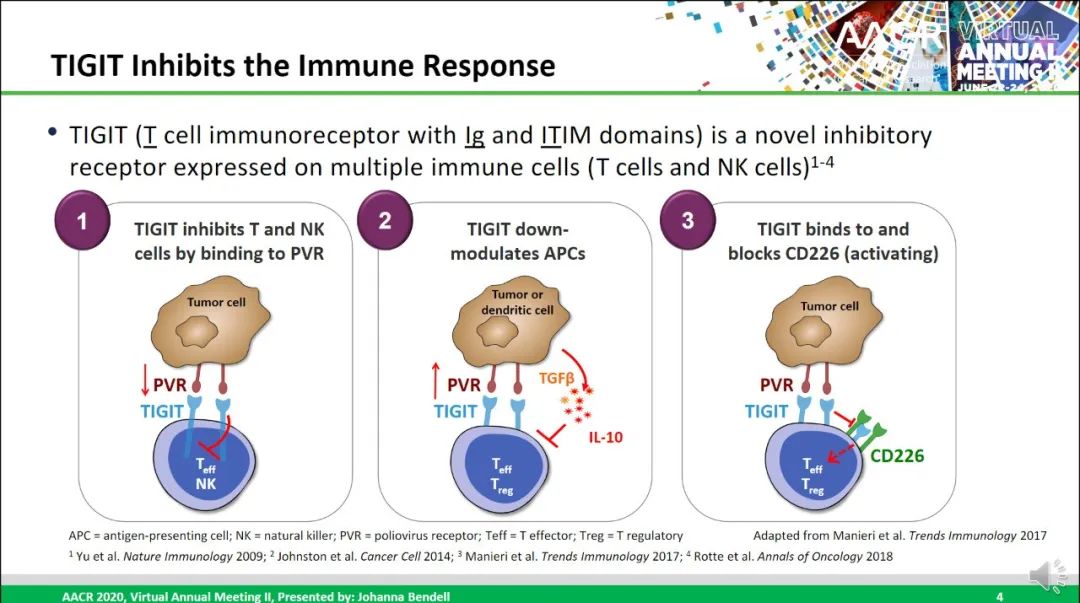
TIGIT全称T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains),也是一种抑制性受体,在多种类型的T细胞和NK细胞表面表达。Tiragolumab是一种全人源 IgG1/kappa 抗TIGIT单克隆抗体,具有完整的Fc区,可阻断TIGIT与其配体 PVR 和共激活受体CD226的结合,理论上可恢复抗肿瘤反应并增强抗PD-L1抗体疗效。
Tiragolumab是罗氏重点开发的下一代免疫检查点抑制剂之一,SKYSCRAPER-02也是罗氏针对tiragolumab开展的五项 III 期试验之一。同时,SCLC又是恶性程度较高的一类肺癌,多种不同机制药物也都折戟成沙。因此,在SCLC中的研究失利并不能决断TIGIT策略失败。毕竟LAG3固定剂量药物Opdualag同期刚刚获批上市,而TIGIT和LAG3相似,都是没有单方活性的新型免疫靶标。另一方面,与非小细胞肺癌试验(SKYSCRAPER-01和-03)不同,SCLC早期数据并没有公开披露。而Tiragolumab作为罗氏重点开发的产品在2021年被FDA授予治疗PD-L1高表达转移性非小细胞肺癌的突破性疗法,早期数据显示客观缓解率的改善和疾病恶化或死亡风险的降低。
SKYSCRAPER-02研究数据将在后期举行的医学会议上公布,但总的来说,TIGIT靶标并没有起到“雪中送炭”的作用。PD-1/L1免疫疗法之后,我们需要解决的如何扩大免疫疗法的获益人群,尤其PD-1/L1治疗无响应或不耐受人群中的新疗法,似乎TIGIT和LAG3目前并未表现出这样的潜质。
详细见:Tiragolumab联合阿替利珠单抗治疗广泛期小细胞肺癌的III期研究,结果失败(SKYSCRAPER-02研究)
2. NKTR-214联合Opdivo治疗黑色素瘤的两项III期研究
3月14日,百美施贵宝和 Nektar Therapeutics 联合宣布了bempegaldesleukin (NKTR-214)联合纳武利尤单抗相较于纳武利尤单抗单药在先前未经治疗的不可切除或转移性黑色素瘤的临床III期研究(PIVOT IO-001)首次数据分析结果。结论指出,经盲态独立中央审查 (BICR) 评估,该研究未达到无进展生存期和客观缓解率的主要终点,总生存期作为第一次中期分析中的第三个主要终点也不符合统计学意义。受此消息影响,Nektar股价当天下跌超过60%,收于4.16美元。
Bempegaldesleukin (BEMPEG/NKTR-214) 是一种免疫刺激性 IL-2 细胞因子前药,经过工程化改造,由平均与六个聚乙二醇 (PEG) 链偶联的 IL-2 组成,旨在通过结合 IL-2Rβγ 受体而不结合抑制免疫的调节性T细胞IL-2Rαβγ受体,提供快速和持续的信号传导,选择性刺激和扩增特定的抗癌T细胞和自然杀伤 (NK) 细胞。同时,NKTR-214也被设计为通过其PEG 链的缓慢释放来增加 IL-2 的半衰期(~20 小时),从而实现持续(超过3周)激活IL-2途径,以减少给药频率。
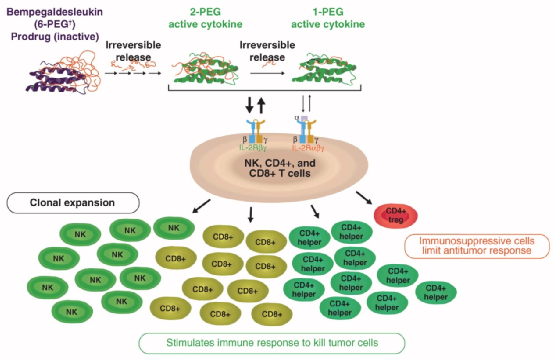
此外,基于独立数据监测委员会 (DMC)对PIVOT IO-001研究的审查结果,两家公司还决定停止招募并揭盲正在进行的辅助性黑色素瘤临床III期PIVOT-12研究,该研究旨在评估在高复发风险患者中完全切除黑色素瘤后,NKTR-214联合纳武利尤单抗相较于单独使用纳武利尤单抗的辅助免疫治疗功效。
NKTR-214最初由Nektar Therapeutics开发,百时美施贵在2018年以18.5亿美元首付款(含股权投资)签署合作开发协议,Nektar股价随后也一度飙升至108美元。尽管NKTR-214和纳武利尤单抗联用曾在早期研究中显示对皮肤癌、肾癌和膀胱癌的治疗响应,但这些研究并没有设置对照组,也使得NKTR-214在纳武利尤单抗基础上能够增加多少临床益处变得扑朔迷离,在这个基础上贸然推进至III期临床自然也就增添了不确定性。不过,两家公司决定继续推进在肾细胞癌和膀胱癌中的相关临床探索,包括III期临床。
3. 度伐利尤单抗治疗局部晚期宫颈癌III期研究
3月24日,阿斯利康宣布,PD-L1单抗Imfinzi (度伐利尤单抗) 联合放化疗(CRT)治疗局部晚期宫颈癌的III期CALLA研究未达到改善无进展生存期(PFS)的主要终点。与单纯放化疗相比,PFS未实现统计学意义改善。
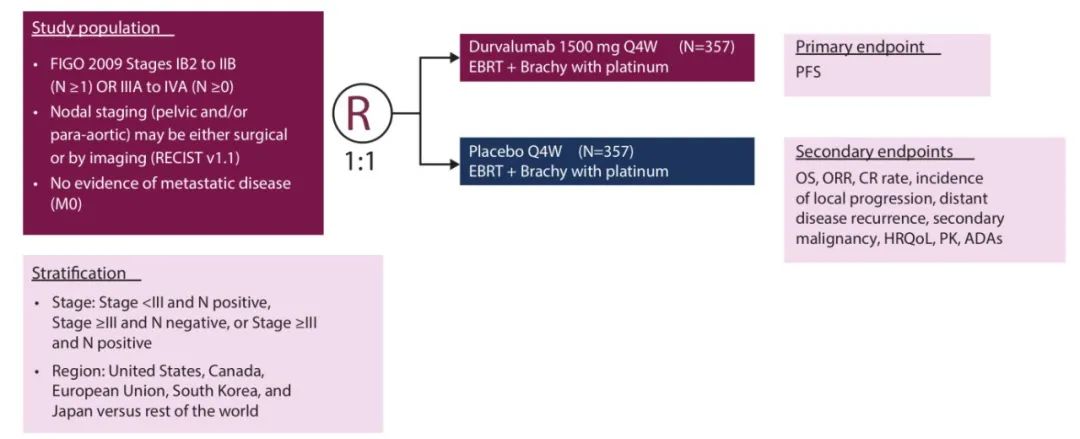
CALLA研究是一项随机、多中心、双盲、全球性III期临床试验,最终770名局部晚期宫颈癌患者接受了标准治疗CRT联合1500 mg固定剂量Imfinzi或安慰剂治疗,受试者每四周治疗一次,持续24个周期或直到疾病进展。该试验在包括美国、欧洲、拉丁美洲、非洲和亚洲在内的15个国家的120个中心进行。主要终点为无进展生存期(PFS),主要次要终点包括总生存期、安全性和耐受性。
宫颈癌是全球第八大最常见、第九大最致命的癌症,每年约有60万确诊病例。约40-50%宫颈癌患者确诊时已处于局部晚期。按照目前的治疗标准铂类化疗联合放疗,局部晚期宫颈癌患者的复发率约为40%,5年生存率约为65-70%。临床前数据显示,同步放化疗联合阻断PD-1/L1途径可通过启动DNA断裂、细胞死亡、吞噬作用和抗原呈递来诱导免疫原性环境增加,从而导致免疫介导的肿瘤重新激活和增强的抗肿瘤活性。
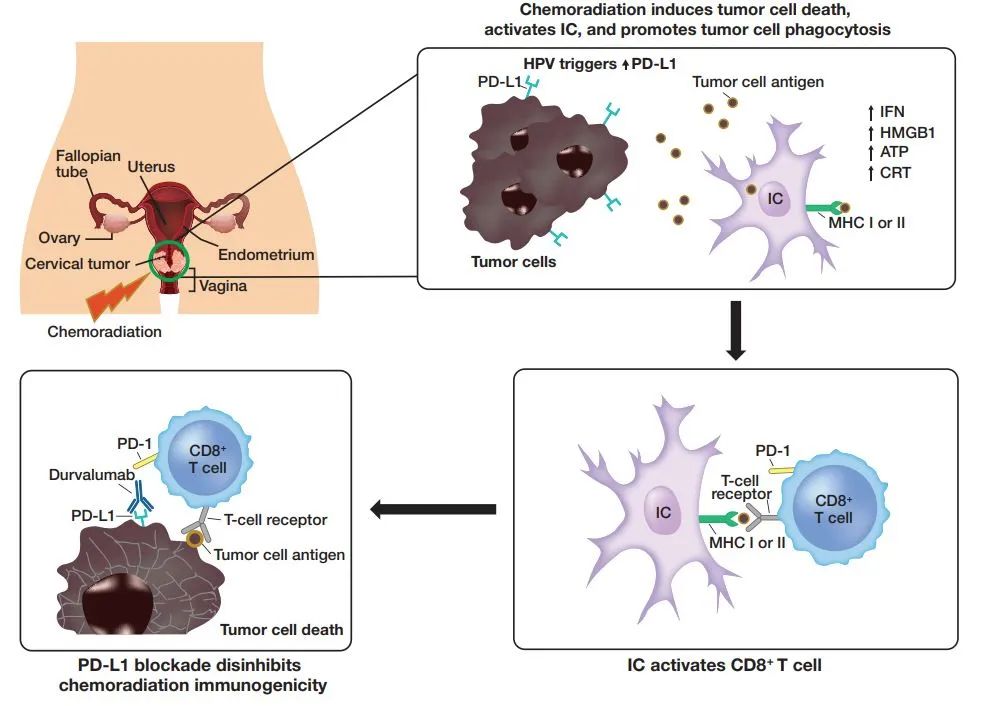
在这一领域,阿斯利康对Imfinizi寄予厚望,希望可以与默沙东的 PD-1帕博利珠单抗展开竞争。帕博利珠单抗在2021年10月获得了与化疗联合治疗持续性、复发性或转移性宫颈癌的一线疗法资格。CALLA研究的失败使得阿斯利康希望破灭,但这并不是PD-1/L1疗法的首次失利。2022年1月,作为首个在III期临床中证明可改善铂类化疗后疾病进展总生存期的PD-L1抗体西米普利单抗也撤销了该适应症;再往前述,PD-1抗体巴替利单抗也在2021年撤销了宫颈癌的上市申请。
详细见:度伐利尤单抗治疗局部晚期宫颈癌III期研究,结果失败
4. Amcenestrant治疗乳腺癌的II期研究
3月14日,赛诺菲公布了amcenestrant治疗ER+/HER2-局部晚期或转移性乳腺癌的II期临床研究的最新结果。结果表明AMEERA-3试验未能达到改善无进展生存期(PFS)的主要终点,赛诺菲表示将继续评估AMEERA-3试验的数据,并与研究者合作发表完整结果。正在进行的amcenestrant其他临床试验项目按计划继续进行,包括AMEERA-5(联合帕博西利作为ER +/HER2-转移性乳腺癌患者的一线治疗试验)和AMEERA-6(联合他莫西芬作为因治疗相关毒性而停止芳香化酶抑制剂治疗HR +早期乳腺癌患者的辅助治疗试验)。
Amcenestrant是一种口服选择性雌激素受体降解剂(SERD),通过与乳腺癌细胞表面的雌激素受体(ER)结合,基于泛素化机制诱导降解,从而降低雌激素受体水平,抑制癌细胞的生长。AMEERA-3是一项随机、开放标签、II期临床试验,旨在评估amcenestrant单药治疗vs医生选择的单药内分泌治疗(包括氟维司群、阿那曲唑、来曲唑、依西美坦以及他莫昔芬)在既往接受过激素治疗的ER+/HER2-局部晚期或转移性乳腺癌患者中疗效和安全性。研究的主要终点是由独立中心审查评估的PFS,研究的次要终点包括总生存期(OS)、客观缓解率(ORR)、疾病控制率(DCR)、临床获益率(CBR)、缓解持续时间(DoR)以及安全性和生活质量评估。
Amcenestrant是首个在关键临床中披露阴性数据的口服SERD,全球目前批准上市的SERD药物只有氟维司群注射液一种,进入III期临床口服SERD药物有6款。艾拉司群是第一个在关键试验中战胜氟维司群的口服SERD,但全人群中mPFS延长不足1个月,OS数据尚未成熟,目前而言在OS数据上并没有显著优势。可以说,口服SERD在与氟维司群的竞争中尚未表现绝对优势,罗氏和阿斯利康也将在2022年披露关键临床数据,每日口服的SERD与每月注射一次的氟维司群最终结局如何,也是看点十足。
详细见:选择性雌激素受体降解剂 (SERD) amcenestrant 治疗乳腺癌,未能达到主要终点
5. PF-06425090预防艰难梭菌感染的III期研究
3月1日,辉瑞公布了艰难梭菌 (C. difficile或 CDI) 候选疫苗PF-06425090的关键III期研究 CLOVER 试验结果,数据显示该研究未达到其预先指定的预防原发性 CDI 的主要终点。不过,次要终点的初步分析表明,在降低 CDI 严重程度方面疫苗表现出有利的益处。尽管如此,辉瑞当日股价仍然出现微幅下滑。
CDI 是一种有害细菌,会导致严重的结肠炎症和腹泻,有时可能是致命的。除bezlotoxumab外,近10年尚未有创新性疗法上市。据美国疾病控制与预防中心 (CDC) 报道,美国每年约有 50 万患者感染这种细菌。CLOVER 是一项全球、随机、安慰剂对照的III期研究,旨在评估艰难梭菌疫苗在 50 岁及以上成人中的有效性、安全性和耐受性,试验的参与者在 0、1 和 6 个月时随机接受三剂艰难梭菌疫苗(n=8,766)或安慰剂(n=8,769)。CLOVER 的两个主要疗效终点是完成第三剂后≥14 天的 CDI 首次主要发作和完成第二剂后≥14 天的 CDI 首次主要发作。主要安全终点包括局部反应、全身事件、不良事件和系列不良事件。
由于疫苗未能达到其主要终点,辉瑞表示目前正在重新评估其针对CDI的疫苗计划。同期,Finch Therapeutics公司正在进行的CP101治疗CDI的III期PRISM4研究被FDA按下暂停键,致使其股价下跌超过20%。去年12月,Summit Therapeutics也曾宣布Ridinilazole治疗艰难梭菌感染的临床III期研究(Ri-CoDIFy)失败,因未达到研究的主要优势终点导致当日股价下跌48%。
6. 治疗和预防新冠感染的多项研究
3月31日,InflaRx NV宣布其FIC的单克隆抗人补体因子C5a抗体药物Vilobelimab在针对机械通气 COVID-19 患者的 II/III 期 PANAMO 研究的 III 期数据,显示相对28天全因死亡率降低了 23.9%(Vilobelimab vs 安慰剂=31.7% vs 41.6%,p=0.094)。然而,使用最终统计分析计划中预先指定的回归分析后,数据没有显示统计学意义。
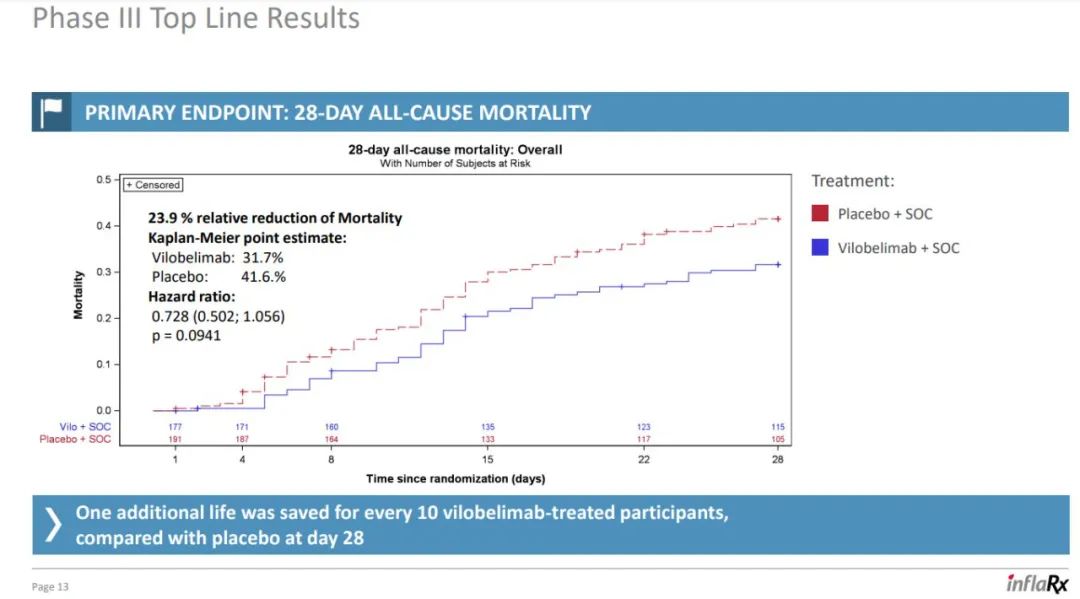
PANAMO研究是一项随机、双盲、安慰剂对照的 III 期部分,随机纳入了欧盟、南美和其他地区的369名机械通气 COVID-19 患者,患者按 1:1 随机分配接受 vilobelimab 或安慰剂,两组都接受包括类固醇在内的标准护理。Vilobelimab是一种补体因子C5a抗体药物,但却不是首个失利药物。去年7月,Innate Pharma的C5aR1抗体Avdoralimab在治疗 COVID-19重症肺炎的Ⅱ期临床试验(FORCE)设置的三个队列中,均未达到研究主要终点。
本月,Vilobelimab也不是COVID-19领域唯一的失利药物。ARCA biopharma同日也公布了 rNAPc2治疗COVID-19 的ASPEN-COVID-19临床IIb期试验结果。临床试验中,两种剂量下均未达到主要疗效终点的统计学意义。在盘后交易中,ARCA股价下跌近28%。
rNAPc2是一种小型重组蛋白,正在开发作为COVID-19和其他病毒性疾病的潜在治疗方法。rNAPc2作为高效、选择性的组织因子 (TF) 抑制剂,已被确定在病毒感染的炎症反应和病毒传播过程中发挥核心作用。其独特的作用机制使 rNAPc2 具有抗凝血、抗炎和潜在的抗病毒特性,因此被认为能够有效地解决来自多种途径的病毒感染。
Avdoralimab和rNAPc2是本月明确宣布未达主要终点的COVID-19疗法药物,除此之外,Icosavax也发布了其 COVID-19 疫苗 IVX-411的I/II期试验数据。尽管表述委婉,仅称免疫反应低于预期,但不难看出研究失败;同时,临床实验数据还表现出与Icosavax VLP技术上的已知数据不一致,公司已经展开相关调查,此消息导致Icosavax股价下跌约70%。
另外,Capricor Therapeutics公布的CAP-1002 治疗 COVID-19 的II期INSPIRE 试验数据显示,CAP-1002未达到安全性的主要终点,股价同样下跌超过30%。
7. 两款反义疗法药物折戟沉沙
3月22日,专注于开发新的疗法来解决病毒和肝脏疾病未满足医疗需求的Aligos Therapeutics宣布,停止开发其候选药物ALG-020572。终止开发的原因主要是因为在 ALG-020572-401研究中,一名慢性乙型肝炎(CHB)受试者在多次给药 210 mg ALG-020572后出现严重不良事件 (SAE),导致丙氨酸氨基转移酶 (ALT) 显著增加并短暂住院。这名患者是该队列中四名CHB受试者之一,可能经历了与药物相关的ALT突然发作,提示药物引起了肝毒性。

ALG-020572是一种 GalNAc缀合的反义寡核苷酸(ASO),同时也是Aligos在2022年终止的第2款药物。1月,Aligos Therapeutics宣布停止进一步开发慢性乙型肝炎 (CHB)的候选药物 ALG-010133,该药物是一种新型化学优化的聚-AC寡核苷酸类似物,与核酸聚合物(NAP)具有结构相似性,能够抑制病毒S抗原转运的寡核苷酸聚合物(STOP)。Aligos表示,停止两个临床开发项目(ALG-010133和ALG-020572)所节省的资金,以及Aligos的合作活动和其他成本节约措施产生的收益能够继续保障至 2024 年上半年的计划运营
3月28日,渤健和Ionis Pharmaceuticals宣布BIIB078 (IONIS-C9Rx),一种用于 C9orf72 相关肌萎缩侧索硬化症 (ALS) 的研究性反义寡核苷酸,没有显示出临床益处,相关临床研究将被终止。
C9orf72相关 ALS 是一种复杂的ALS遗传形式,科学界认为C9orf72基因导致疾病的机制有多种。BIIB078的设计基于C9orf72相关ALS的疾病机制是由与含有RNA和相应二肽的重复序列相关的毒性假设。不幸的是,这项I期研究并没有支持这一假设,表明疾病机制要复杂得多。
渤健专注于神经系统疾病,曾在这一领域不俗的商业成绩,却也面临流年不利。2021年,渤健有多款药物宣布研究失利,阿尔茨海默病药物阿杜卡尼单抗(Aduhelm) 获得FDA加速批准,但受到广泛质疑。FDA重启了审批调查,也调整了Aduhelm相关适应症,仍遭受医生和保险机构抵制,2021年上市半年,销量额仅160万美元。近期,渤健宣布已经向FDA提交其确认性 IV 期ENVISION试验的最终研究方案后并等待批准,该研究预计将在4年的加速时间内完成。
8. 改良型新药突击之路困难重重
3月初,NuCana plc宣布收到独立数据监测委员会审查结论,NUC-1031(NuTide121)治疗晚期胆道癌与标准护理(吉西他滨加顺铂)相比,不太可能实现将总生存期提高 2.2 个月或更长时间的主要目标,治疗并未带来总体生存获益。盘后NuCana股价开始下跌,并持续多日。
NUC-1031是采用NuCana 公司ProTide 技术针对吉西他滨开展的改良型新药。ProTide技术的关键在于采用保护活化核苷酸类似物的芳基、酯和氨基酸基团(氨基磷酸酯基序)的特定组合。针对不同的药物,测试不同的化合物组合,以确定每个潜在核苷类似物的最佳氨基磷酸酯基序。ProTide 技术由McGuigan 教授发明,并在吉利德的索磷布韦和富马酸替诺福韦艾拉酚胺药物上完成验证。
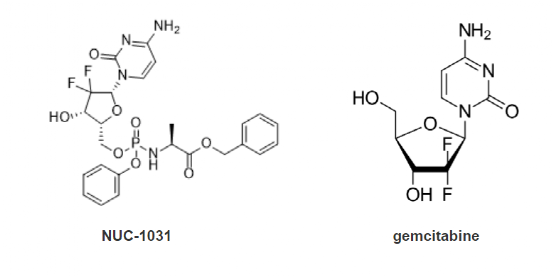
NUC-1031之外,NuCana公司基于ProTide技术仍在开发NUC-3373和NUC-7738。其中,NUC-3373,将在今年晚些时候开始一项针对结直肠癌的III期研究;NUC-7738 将在今年晚些时候进入实体瘤和淋巴瘤患者的II期开发阶段。
NUC-1031之外,另一款改良型新药也在3月公布不利消息。21日,Tonix Pharmaceuticals宣布,正如此前已经公布的中期分析结果预期,与安慰剂相比,TNX-102 SL(盐酸环苯扎林舌下含片)在III期RALLY研究中与安慰剂相比,在第 14 周减少纤维肌痛 (FM) 每日疼痛的主要终点没有达到统计学意义 (p=0.115) 。
Tonix于2021年7月报告了RALLY的中期分析结果,当时独立数据监测委员会基于太可能在计划的完整样本主要终点上取得成功建议停止该研究。Tonix公司停止了新参与者的招募,但同时选择继续让当时的参与者完成研究。
Vallon Pharmaceuticals在3月份也公布改良型右旋安非他明(右苯丙胺)防滥用配方ADAIR用于治疗注意力缺陷多动障碍(ADHD)的疗效结果。数据显示,该研究未达到主要终点。受此消息影响,Vallon公司股价也大跌近70%。
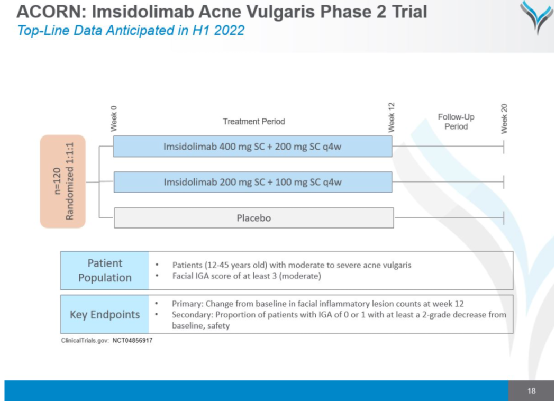
9. Imsidolimab治疗中度至重度痤疮的II期研究
3月14日,AnaptysBio宣布其Imsidolimab用于治疗中度至重度痤疮的II期临床ACORN试验的并未证明在一线主要或次要终点方面未显示出优于安慰剂的改善。Imsidolimab(ANB019)是一种抑制白细胞介素36受体或IL-36R功能的抗体,仍在计划开发用于治疗泛发性脓疱型银屑病(GPP)患者和中度至重度化脓性汗腺炎。
123名中度至重度痤疮患者在位于美国的15个地点参加了ACORN试验,imsidolimab高剂量组患者在第1天接受 400mg 皮下诱导剂量治疗,然后在第4周和第8周每月接受200mg皮下剂量治疗,而 imsidolimab低剂量组患者接受200mg皮下诱导剂量和每月100mg皮下剂量治疗。该试验的主要终点是第12周时面部炎症病变计数相对于基线的平均变化。
去年3月,Imsidolimab在治疗中度至重度掌跖脓疱病的II期临床试验(POPLAR)中,同样未能达到其主要终点。当时受消息影响,AnaptysBio的股价就曾跌幅超过30%,今年3月失利消息接踵而来再次拉低AnaptysBio走势(-10%)。
10. Keytruda联合PARP抑制剂的III期研究
3月15日,默沙东宣布将终止PD-1抑制剂Keytruda联合PARP抑制剂Lynparza(奥拉帕利) 治疗曾接受化疗和醋酸阿比特龙或恩杂鲁胺治疗后疾病进展转移性去势抵抗性前列腺癌(mCRPC)患者的III期KEYLYNK-010研究。
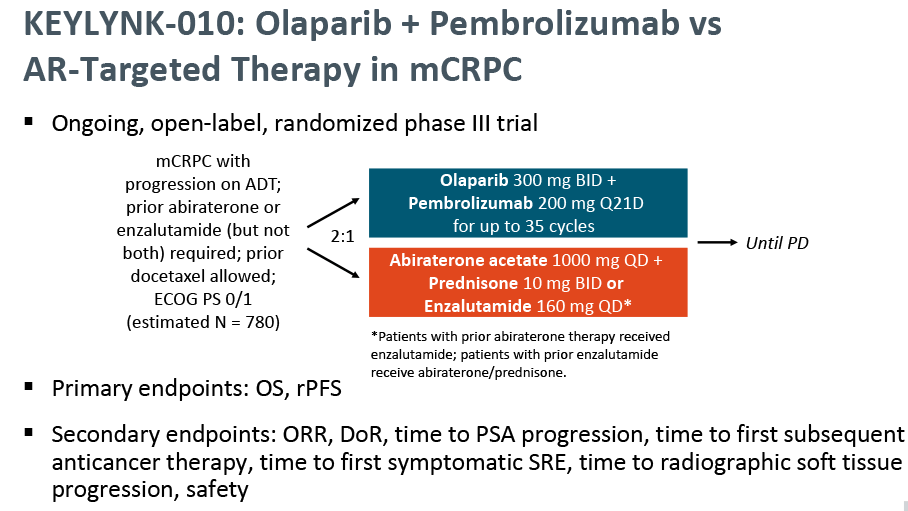
独立数据监测委员会 (DMC) 审查的中期分析数据显示,与对照组醋酸阿比特龙或恩杂鲁胺相比,Keytruda联合Lynparza并没有在总生存期(OS)方面显示出益处,OS是该研究的双重主要终点之一。该试验的另一个双重主要终点,影像学无进展生存期 (rPFS),在早期的中期分析中进行了评估,与对照组相比也没有表现出改善。相反,与对照组相比,联合用药组3-5级不良事件和药物相关严重不良事件发生率更高。
前列腺癌是男性第二大常见癌症,并且与显著的死亡率相关。3月,Harpoon Therapeutics也宣布计划停止治疗前列腺癌的HPN424的临床开发。消息指出,Harpoon 对HPN424数据进行了仔细和彻底的分析,包括迄今为止的临床结果,基于这些数据决定停止HPN424剂量递增研究。
详细见:Keytruda联合PARP抑制剂III期临床试验失败!默沙东终止研究
肿瘤领域,本月ORIC也在完成两项Ib期研究数据的中期分析后,决定停止ORIC-101的开发,原因是治疗并没有表现出足够的临床活性。此外,Silverback Therapeutics基于SBT6050在血清和肿瘤内暴露以及药效学标志物中观察到剂量反应,包括在治疗后从患者收集的组织活检中证明的免疫激活数据,以及SBT6050表现的单药有限抗肿瘤活性和细胞因子相关的不良事件限制与帕博利珠单抗的联合使用等,决定终止免疫刺激偶联药物SBT6050(HER2-TLR8)和SBT6290(Nectin4-TLR8)的临床研究。
非肿瘤领域,Avalo Therapeutics基于AVTX-007缺乏临床疗效信号,也决定终止进一步开发;Revelation Biosciences公布了鼻内给予REVTx-99a用于H3N2 流感预防性治疗的IIb期 RVL-VRL01研究中期统计分析结果,数据显示也未达到其主要疗效终点。
参考资料:
[1]https://investor.aligos.com/news-releases/news-release-details/aligos-halting-further-development-stopstm-drug-candidate-alg
[2]https://mp.weixin.qq.com/s/zCWfTTOxni2whASWqMUZDA
[3]https://ir.avalotx.com/press-releases/detail/144/avalo-reports-positive-phase-1b-results-for-avtx-002-in
[4]https://ir.2seventybio.com/news-releases/news-release-details/2seventy-bio-shares-key-milestones-and-business-updates-2022
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












