Clin Cancer Res:结直肠癌有前途的疗效预测和预后标志物:SMAD4缺失与复发、缺少免疫浸润和化疗耐药相关
2019-01-18 月下荷花 肿瘤资讯
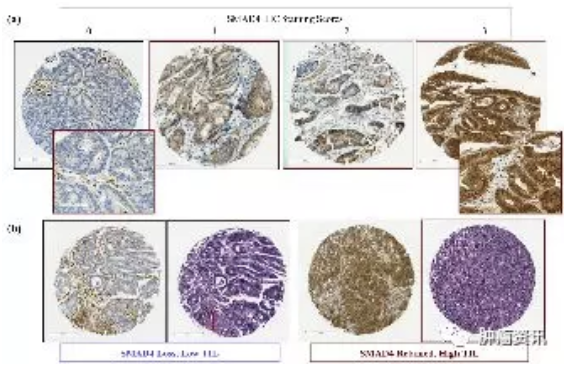
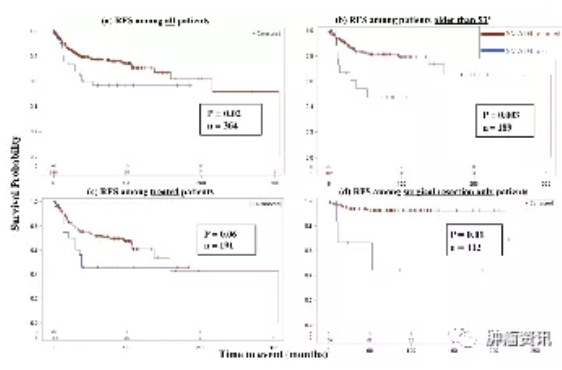
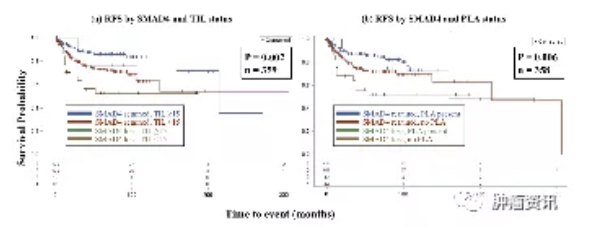
SMAD4是肿瘤抑制因子,是转化生长因子-β(TGF-β)信号的中心环节,是结直肠癌(CRC)很有前途的预后和预测标志物。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Smad#
36
#标志物#
34
#预后标志#
32
#化疗耐药#
32
#SMA#
35
#结直肠#
30
#预后标志物#
36
#免疫浸润#
37
谢谢梅斯提供这么好的信息,学到很多
33