NEJM evid:IL-15超激动剂NAI治疗 BCG 无反应的非肌肉浸润性膀胱癌
2022-12-21 MedSci原创 MedSci原创 发表于上海
据估计,2018 年美国新诊断出 81,000 例膀胱癌病例。这些患者中的大多数 (75–85%) 表现为局限于黏膜的疾病(Ta、T1 和 CIS 期),统称为非肌层浸润性膀胱癌 (NMI
据估计,2018 年美国新诊断出 81,000 例膀胱癌病例。这些患者中的大多数 (75–85%) 表现为局限于黏膜的疾病(Ta、T1 和 CIS 期),统称为非肌层浸润性膀胱癌 (NMIBC) 。尽管 NMIBC 的预后通常良好,但它具有很高的复发风险 (30-80%) 和进展为肌肉浸润性疾病 (1-45%) 。因此,NMIBC 需要终身监测,以在可干预的阶段捕捉复发。NMIBC 的肿瘤学监测算法差异很大,即使在国家和国际泌尿外科学会(即 EAU、NCCN 和 AUA)之间也是如此。此外,膀胱镜技术、泌尿标志物和成像技术的最新进展使 NMIBC 的监测方案更加复杂。
IL-15通过影响NK细胞和T细胞的发育、维持和功能在免疫系统中起到重要作用。N-803是一种新型IL-15超激动剂复合物,由IL-15突变体(IL-15N72D)与IL-15受体α/IgG1 Fc融合蛋白结合而成。其作用机制是通过β-γ-T细胞受体结合直接特异性刺激CD8+T细胞和NK细胞,同时避免T-reg刺激。与体内的天然、非复合IL-15相比,N-803具有更好的药代动力学特性、更长的淋巴组织存活时间和更强的抗肿瘤活性。在肿瘤局部,IL-15具有对淋巴细胞增殖的作用,对目前常用免疫抑制剂如抗PD-1抗体无反应的“冷肿瘤”变成有反应的“热肿瘤”的潜力。
N-803 (ALT-803、Anktiva)是一种新型IL-15超级激动剂,由IL-15突变体(IL-15N72D)与IL-15受体α/Fc融合蛋白结合而成。体内外实验证明,N-803在免疫系统中发挥非常重要的作用,包括以下几点:能够促进自然杀伤细胞(NK cell)和 CD8+ T 淋巴细胞增殖,并激活其免疫活性;增加记忆性CD8+ T 淋巴细胞数量;对调节性T淋巴细胞(Treg cell)无激活作用;与天然IL-15蛋白相比,N-803在体内具有更长的半衰期以及更强的免疫活性。

2022年7月底,美FDA已受理白细胞介素-15(IL-15)激动剂N-803(Anktiva)的生物制品许可申请(BLA),用于治疗卡介苗(BCG)无反应的非肌层浸润性膀胱癌(NMIBC)原位癌(CIS)患者。此前,N-803已获FDA授予突破性疗法认定和快速通道指定。
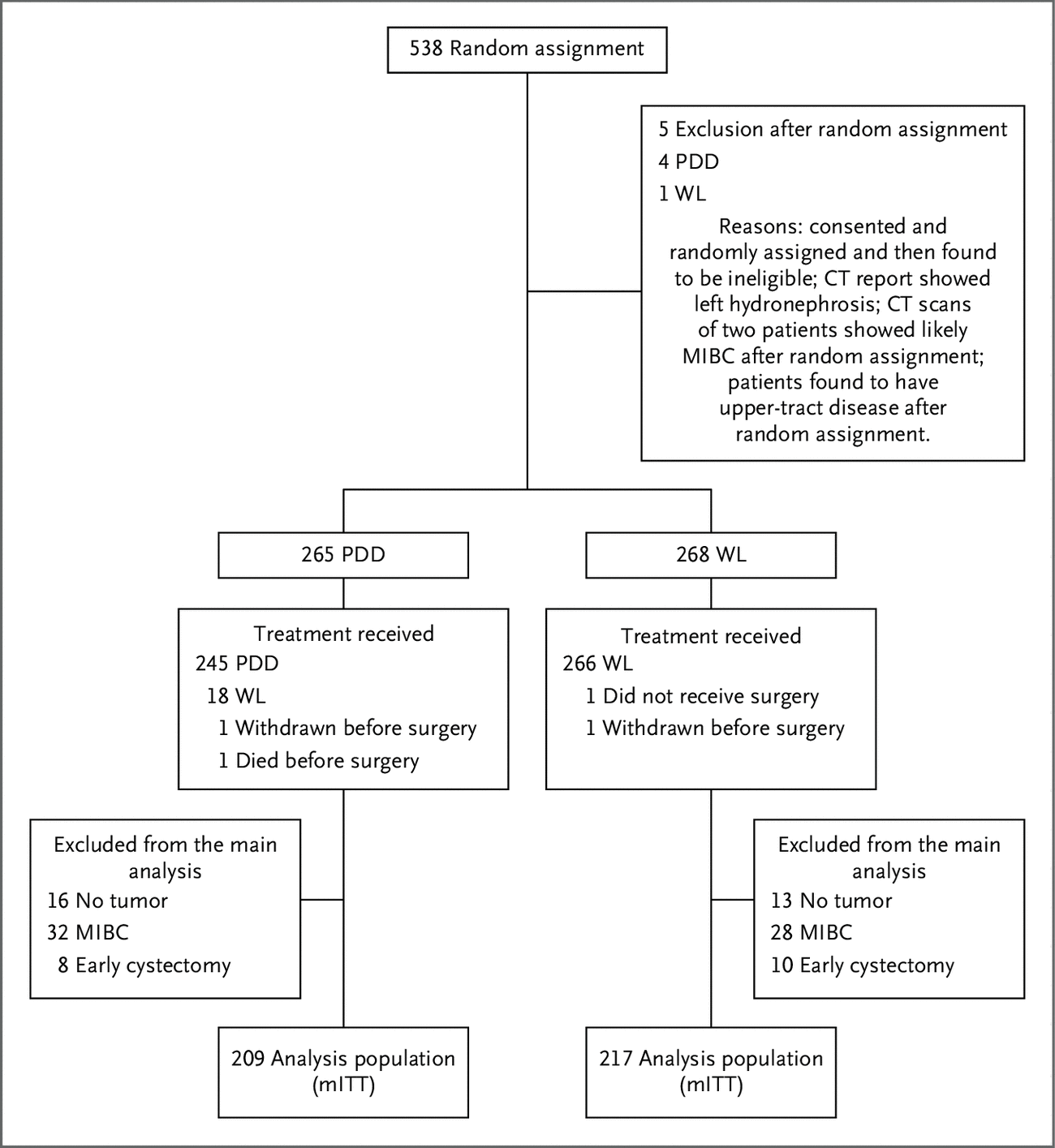
QUILT-3.032(NCT03022825)是一项正在进行的注册性、关键性、开放标签、单臂、三队列、多中心试验(32 个临床试验中心) ) 膀胱内 NAI(Anktiva;ImmunityBio)加 BCG 或 NAI 单独用于 BCG 无反应的高级 NMIBC 患者。 鉴于该患者群体缺乏有效的治疗替代方案,并且根据美国食品和药物管理局的指导和协议,QUILT-3.032 被设计为单臂研究。
患者被纳入三个研究队列之一。 队列 A 和 C 招募了经组织学证实为 BCG 无反应的原位癌 (CIS) 伴或不伴 Ta/T1 乳头状病变的患者。 队列 B 招募了经组织学证实为 BCG 无反应的高级别 Ta/T1 乳头状 NMIBC 患者。 患者必须在 TURBT 手术后没有可切除的疾病,而那些患有高级别 Ta 和/或 T1 疾病的患者在研究治疗前已完全切除。 纳入本研究的男性和女性患者必须年满 18 岁。 主要排除标准包括预期寿命少于 2 年、器官功能不足、严重心脏功能障碍的临床体征以及肌肉浸润性、局部晚期、转移性和/或膀胱外膀胱癌或任何其他癌症的病史或证据,除在过去 5 年内非黑色素瘤皮肤癌。
队列 A 和 B 中的患者接受膀胱内 NAI(400 μg/滴注)加膀胱内 BCG(50 mg/滴注)治疗。 队列 C 中的患者仅接受膀胱内 NAI(400 μg/滴注)。 在诱导治疗期间,所有患者每周通过膀胱导尿管接受研究治疗,连续 6 周。 所有队列的反应评估从第 24 个月到第 24 个月每 3 个月完成一次,从第 24 个月到第 60 个月每 6 个月完成一次。 在每次反应评估时进行膀胱镜检查,并收集尿液——通过排泄标本或在膀胱镜检查期间——进行尿液细胞学检查。 研究中的持续治疗取决于评估中记录的反应,如下所述。 需要在第 12 周(大约 3 个月)进行活检。 所有队列中未达到反应且没有 T1 或更严重疾病的患者都可以选择再诱导。 所有在第 12 周重新入组的患者都需要在第 6 个月进行活检。
队列 A 和 C 的主要终点定义为根据研究者对尿液细胞学、膀胱镜检查和局部病理学结果的评估,在 3 个月或 6 个月的反应评估访视时的 CR 发生率(任何时间的 CR 率) . CR 定义为阴性膀胱镜检查和阴性,包括非典型尿细胞学; 膀胱镜检查阳性,活检证实为良性或低级别 Ta NMIBC,细胞学阴性; 如果在上尿路或前列腺尿道发现癌症,并且随机膀胱活检为阴性,则膀胱镜检查和恶性尿液细胞学检查结果为阴性。
队列 B 的主要终点是自首次滴注 BCG 加 NAI 后 12 个月的无病生存率 (DFS),无病定义为不存在高级别 Ta(不包括低级别 Ta)、任何 T1 级、6 个月或更长时间的持续性 CIS、新发 CIS、疾病进展、膀胱切除术、指示更晚期疾病的治疗变化和死亡(任何原因)。
2017 年 7 月至 2022 年 1 月期间,共有 171 名患者在 32 个临床试验中心中的 22 个中心入组,这些中心均位于美国。 队列 A 共有 84 名患者入组,队列 B 有 77 名,队列 C 有 10 名。
对于队列 A、B 和 C,疗效人群中患者的中位年龄分别为 73(范围,50 至 91)、72(范围,46 至 93)和 74.5(范围,67 至 82)岁( 表 S1,第 7 页)。 在队列 A、B 和 C 中,大多数患者分别为男性(87%、74% 和 60%)和白人(90%、88% 和 90%); 对于队列 A,白人男性的比例高于通过 NMIBC 和膀胱癌的监测、流行病学和最终结果数据库提供的数据中报告的比例(表 S2,第 8 页)。 大多数患者(队列 A、B 和 C 中分别为 81%、77% 和 60%)的基线 Eastern Cooperative Oncology Group 体能状态评分为 0(范围从 0,表明患者完全活跃并且能够 不受限制地进行所有疾病前表现,至5,表示死亡)。 从最后一次 TURBT 到研究队列 A、B 和 C 的中位时间分别为 1.43 个月、1.31 个月和 1.40 个月。
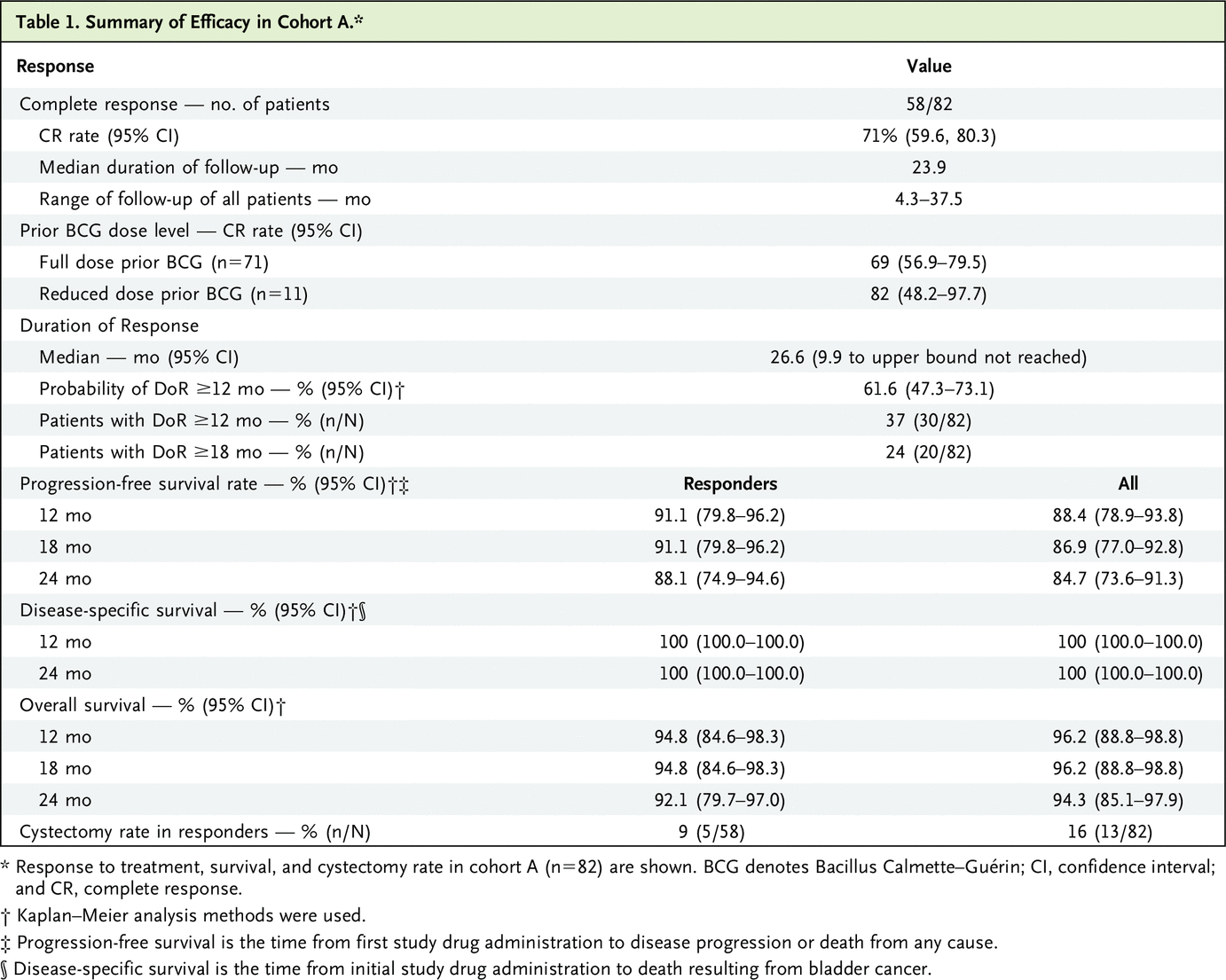
队列 A 中的疗效人群包括 82 名可评估患者(研究中的两名患者在数据截止时未达到 3 个月的反应评估),中位随访持续时间为 23.9 个月(范围为 3.2 至 37.5 个月) ).
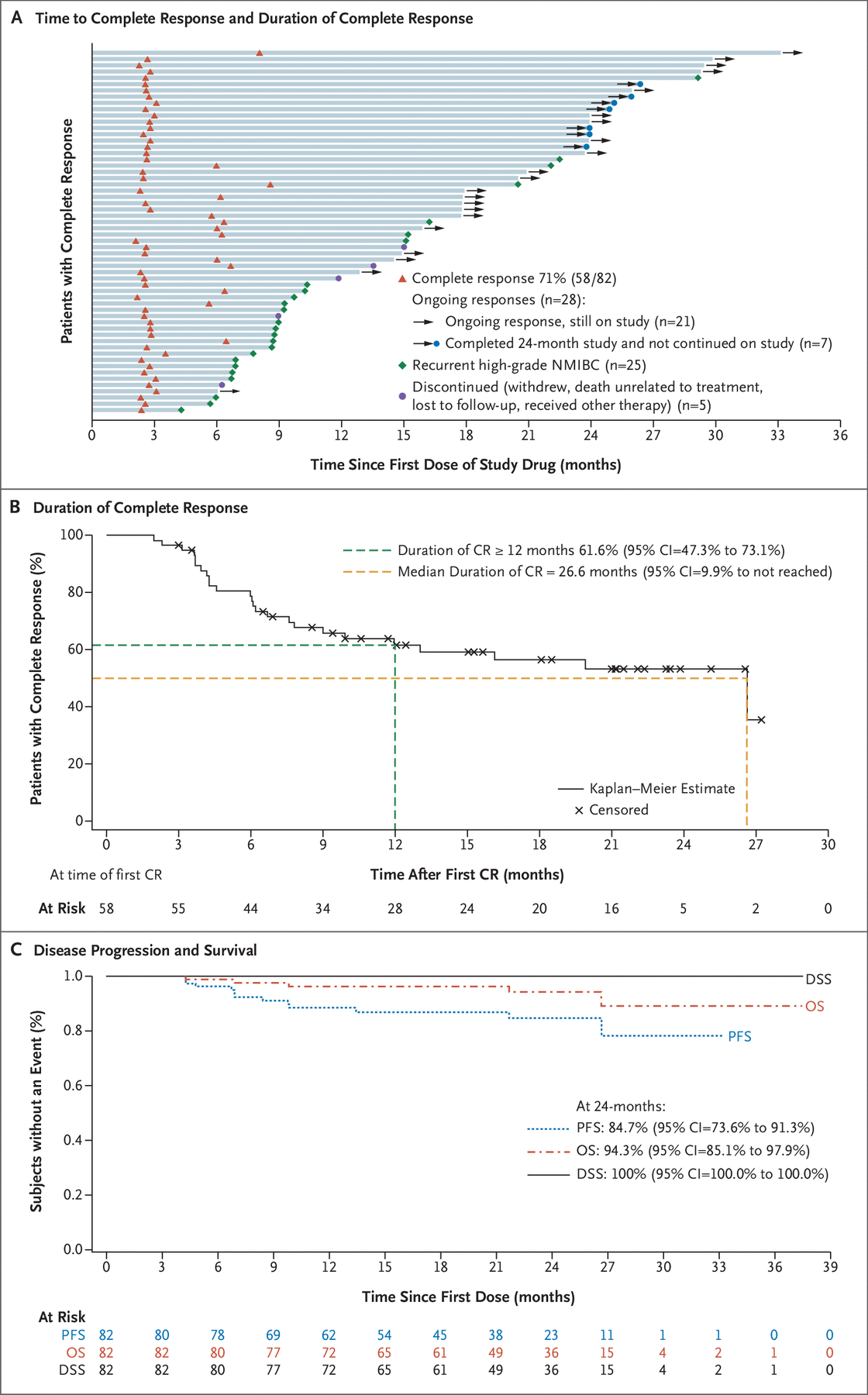
总体而言,71% 的患者在任何时候都达到了 CR(82 名患者中的 58 名;95% CI = 59.6% 至 80.3%)。 这包括 45 名对初始治疗有反应的患者和 13 名接受再诱导治疗的患者。 在 3 个月、6 个月和 12 个月的反应评估中,CR 率为 55%(82 名患者中的 45 名;95% CI=43.5% 至 65.9%)、56%(82 名患者中的 46 名;95% CI=44.7 % 至 67.0%)和 45%(82 名患者中的 37 名;95% CI = 34.1% 至 56.5%)。 缓解者 CR 的中位持续时间为 26.6 个月(95% CI=9.9 个月 [未达到上限])。 在 58 名获得 CR 的患者中,有 28 名患者在数据截止或退出研究时正在进行 CR(图 1A)。
在数据截止时,77 名患者的治疗反应已通过集中病理学盲法评估; 54 名 CR 患者中有 53 名 (98%) 的中央和局部病理学结果一致。 23 名患者中有 19 名 (83%) 没有达到完全缓解。 总体而言,由中央病理学确定的任何时间的 CR 发生率为 74%(77 名患者中的 57 名;95% CI=62.8% 至 83.4%),与由局部病理学评估的 71% 相当。
根据 Kaplan-Meier 方法,CR 持续时间为 12 个月或更长时间的概率为 61.6%(95% CI=47.3% 至 73.1%),CR 持续时间为 24 个月或更长时间的概率为 53.2%( 95% CI=38% 至 66.2%;图 1B)。 总体而言,队列 A 中 45% 的所有患者(82 名患者中的 37 名)在 12 个月的反应评估中获得 CR,33%(82 名患者中的 27 名)在 18 个月的反应评估中获得 CR。
24个月时,PFS概率为84.7%; 总生存期为94.3%; 和 DSS,100% 通过 Kaplan–Meier 分析。 表 1 总结了所有患者的疾病进展和生存期。
队列 B 中的疗效人群由 72 名可评估患者组成,中位随访持续时间为 20.7 个月(范围,2.9 至 37.1 个月)。 中位 DFS 为 19.3 个月(7.4 个月至 [未达到上限]),12、18 和 24 个月的 DFS 率为 55.4%(95% CI=42.0% 至 66.8%)、51.1%(95% CI= 根据 Kaplan-Meier 分析,分别为 37.6% 至 63.1%)和 48.3%(95% CI = 34.5% 至 60.7%)。 膀胱切除率为 7%(72 名患者中的 5 名)。 这些数据以及 DSS、PFS 和 OS 的数据如表 2 所示。

数据截止时队列 C 中 10 名患者的中位随访时间为 7.9 个月(范围,4.1 至 11.8 个月)。 10 名单独接受 NAI 治疗的患者中只有 2 名 (20%) 在 3 个月时达到 CR。 6 名患者接受了再诱导。 只有一名患者 (10%) 在 6 个月时保持 CR。 根据方案定义的停止规则,独立数据监测委员会建议因无效而停止队列 C; 该队列的注册在研究进行大约 6 个月后停止。
总之,我们的数据表明,NAI 加 BCG 对高危 CIS 疾病有益,如 71% 的 CR 率、26.6 个月的 CR 中位持续时间的持续效果、90% 的膀胱切除术的避免 CR 的患者在 24 个月时无膀胱切除术的可能性为 89%,所有 CIS 患者在 24 个月时的膀胱癌(疾病)特异性生存率为 100%。 该研究正在进行中,估计目标入组人数为 200 人。
原始出处:
IL-15 Superagonist NAI in BCG-Unresponsive Non–Muscle-Invasive Bladder Cancer. DOI:https://doi.org/10.1056/EVIDoa2200167
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言