Front Immunol:创新探索发现,MRD状态可改善华氏巨球蛋白血症的缓解评估
2023-07-09 聊聊血液 聊聊血液 发表于上海
基于此,易树华教授和邱录贵教授牵头一项前瞻性研究,以探索 MRD 是否可作为评价WM缓解和结局的敏感指标,研究结果发表于《Frontiers in Immunology》。
MRD之于WM
对于华氏巨球蛋白血症 (WM),加强治疗缓解评估非常有必要。目前的缓解评估依赖血清总 IgM 水平,但该分类缓解定义存在一些局限性。对于 IgM 水平较低的 WM 患者,尤其是接近完全缓解 (CR) 的患者,很难评估其缓解情况。当前的缓解评估系统通常不建议进行骨髓(BM)评估,除非需要确认CR,BM 缓解在整个治疗过程中的预后价值仍不清楚。此外,BM应答和 IgM 水平因使用的治疗而异:接受基于利妥昔单抗治疗的患者呈IgM波动和延迟及快速 BM 应答,而在接受基于蛋白酶体抑制剂的治疗方案的患者中,BM负荷发生适度变化,而IgM水平发生深度改善。因此,有必要开发能够检测 BM 浸润的敏感技术来评估治疗反应。
微小残留病 (MRD) 状态是多种血液系统恶性肿瘤的重要预后因素,如慢性淋巴细胞白血病、多发性骨髓瘤和急性早幼粒细胞白血病,但仅有少数研究系统探索了使用多参数流式细胞术 (MFC) 检测的 MRD 对 WM 患者缓解评估和结局的影响。
基于此,易树华教授和邱录贵教授牵头一项前瞻性研究,以探索 MRD 是否可作为评价WM缓解和结局的敏感指标,研究结果发表于《Frontiers in Immunology》。

研究方法
该研究纳入108例接受完整疗程并达到MRD状态的患者,所有患者均为新诊断且至少有一种症状性疾病符合第二届 WM 国际研讨会的治疗建议,其他条件包括ECOG-PS评分0-2分且预期寿命>3个月。免疫化疗患者在诱导治疗后2个和/或4个疗程后、治疗结束时和最佳缓解评估期间,通过八色流式细胞术测定骨髓样本的MRD;对于接受连续 BTK 抑制剂治疗的患者,在6个疗程结束时进行诱导治疗结束评估,与免疫化疗相同。为了排除治疗干扰,选择最佳缓解时的 MRD 进行最终生存分析。最佳缓解时检测到的 MRD 是指最佳 IgM 缓解时进行的骨髓MRD检测。MRD 阳性结果定义为在500000个有核细胞中鉴定出>50个克隆性恶性肿瘤细胞簇,阴性定义为克隆性恶性细胞计数< 10-4(0.01%)。
研究结果
患者特征
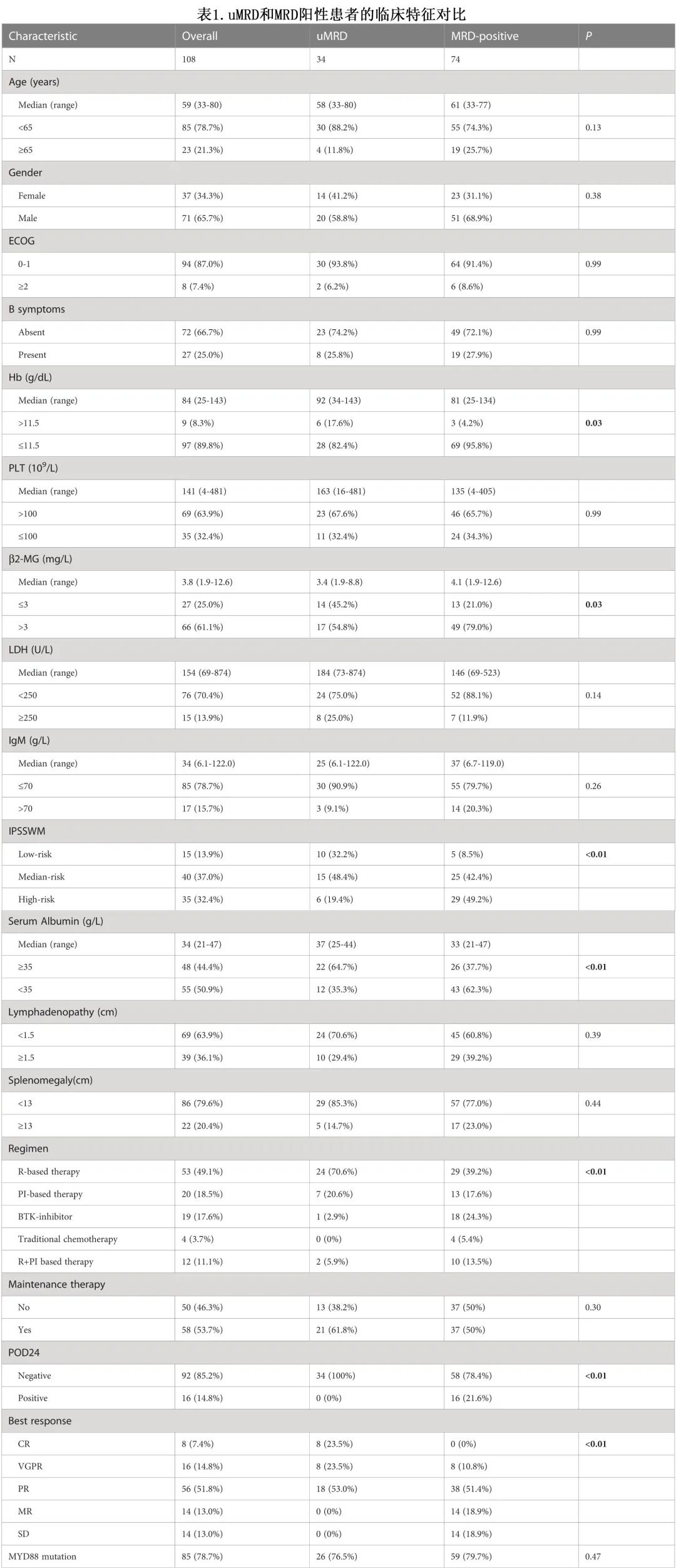
108例患者的基线特征见表1。中位年龄59岁,而年龄>65岁23例 (21.3%),年龄>75岁4例 (3.7%)。男女比例为1.9(71/37)。97例 (89.8%)患者贫血 (≤11.5 g/dL),35例 (32.4%)血小板减少 (≤100 ×109/L)。IgM 中位水平为34 g/L。采用 IPSSWM 分期系统,15例 (13.9%) 归为低危组,40例 (37.0%) 归为中危组,35例 (32.4%) 归为高危组。MYD88L265P 突变检出85例 (78.7%),MRD无法检测(uMRD)组和 MRD 阳性组之间未见明显差异。
治疗
108例患者中有53例 (49.1%) 接受了基于利妥昔单抗的诱导治疗,而20例 (18.5%) 接受了基于蛋白酶体抑制剂的治疗方案,19例(17.6%) 接受了 BTK 抑制剂,12例患者 (11.1%) 接受蛋白酶体抑制剂-利妥昔单抗联合治疗,而仅4例患者 (3.7%) 接受传统化疗。中位疗程数为6个。诱导治疗完成后,58例 (53.7%) 接受利妥昔单抗或沙利度胺维持治疗,仅50例 (46.3%)观察。
治疗反应
根据NCCN指南评估的最佳总缓解率 (ORR) 为87.0%,8例患者 (7.4%) 达到CR,16例患者 (14.8%) 达到非常好的部分缓解 (VGPR),56例患者 (51.8%) 为部分缓解 (PR),14例患者 (13.0%) 显示轻微缓解 (MR),14例 (13.0%) 疾病稳定 (SD)。中位至缓解时间1.8个月,至最佳缓解的中位时间为6个月。基线时39例报告了 CT 检测到的淋巴结肿大(≥1.5 cm),18例患者 (46.2%) 显示淋巴结肿大完全消退,而12例患者 (30.8%) 仅显示淋巴结肿大部分消退。22例脾肿大患者中15例 (68.2%) 显示完全消退,而7例 (31.8%) 化疗后仅显示部分消退。
MRD反应特征
治疗前99例 (91.7%)的MFC肿瘤负荷>1.0%,9例 (8.3%)的MFC肿瘤负荷为0.01%-1%。诱导治疗2个疗程后,89例 (82.4%) 可获得 MRD 结果:7例患者 (6.5%)获得uMRD,31例患者 (28.7%) 达到0.01%-1%的 MRD 率,51例患者 (47.2%) 达到>1.0%的 MRD 率。诱导治疗4个疗程后,99例 (91.7%) 可获得 MRD 结果:21例患者 (19.4%) 达到uMRD,29例患者 (26.9%) 达到0.01%-1%的 MRD 率,49例患者 (45.4%) 达到>1.0%的 MRD 率。诱导治疗后,100例患者 (92.6%) 的 MRD 结果可用:31例患者 (28.7%) 获得uMRD,30例患者 (27.8%) 达到0.01%-1%的 MRD 率,39例患者 (36.1%) 达到>1.0%的 MRD 率。在最佳缓解时,34例患者 (31.5%)获得uMRD,34例患者 (31.5%) 达到0.01%-0.1%的 MRD 率,40例患者 (37.0%) 达到>1%的 MRD 率。
uMRD状态的相关因素
作者评估了治疗前特征以确定达到最佳缓解时 uMRD 状态的相关因素。血红蛋白水平>11.5 g/dL(17.6% vs. 4.2%,P = 0.03)、血清白蛋白水平≥35 g/L(64.7% vs. 37.7%,P<0.01)、b2-MG水平≤3 mg/L(45.2% vs. 21.0%,P=0.03)、低危 IPSSWM 分期(32.2% vs. 8.5%,P<0.01)与较高的 uMRD 率显著相关。基于利妥昔单抗的化疗MRD清除率高于基于蛋白酶体抑制剂的方案 (70.6% vs. 20.6%,P<0.01)。此外,MRD阳性组16/74例 (21.6%) 发生POD24,而34例 uMRD 患者均未发生POD24 (P<0.01)。然而,uMRD和 MRD 阳性组之间在年龄、性别、ECOG PS评分、B症状、血小板计数、LDH水平或 IgM 水平分布均未发现差异(表1)。
MRD可反映肿瘤负荷的变化
随着诱导疗程数的增加, WM 患者的 BM 肿瘤负荷显著改善。基线时 MFC 的中位肿瘤负荷水平为16.5%,达到最佳缓解时则降至0.01%。在诱导治疗过程中,随着 BM 中肿瘤负荷的降低,临床特征也明显改善:患者的血清 IgM 水平快速持续下降,诱导治疗后中位 IgM 水平从34.1 g/L降至10.0 g/L;根据淋巴结肿大患者的 CT 扫描结果,平均直径乘积总和 (SPD) 从基线时的8.0cm2降至1.30cm2;达到最佳缓解后,中位血红蛋白水平从84.0 g/L升高至136.5 g/L;随着诱导疗程数的增加,血小板计数从141 × 109/L升高至180 × 109/L(图1)

不同MRD状态组的临床缓解改善情况
IgM 降低(P<0.01,图2A)和血清血红蛋白恢复(P=0.03,图2B)与 MRD 状态相关,与 MRD 阳性患者相比,uMRD患者的改善更明显,uMRD患者淋巴结肿大 SPD 的变化也大于 MRD 阳性患者(P=0.09,图2C)。上述结果显示了临床和 BM 反应之间的显著一致性。
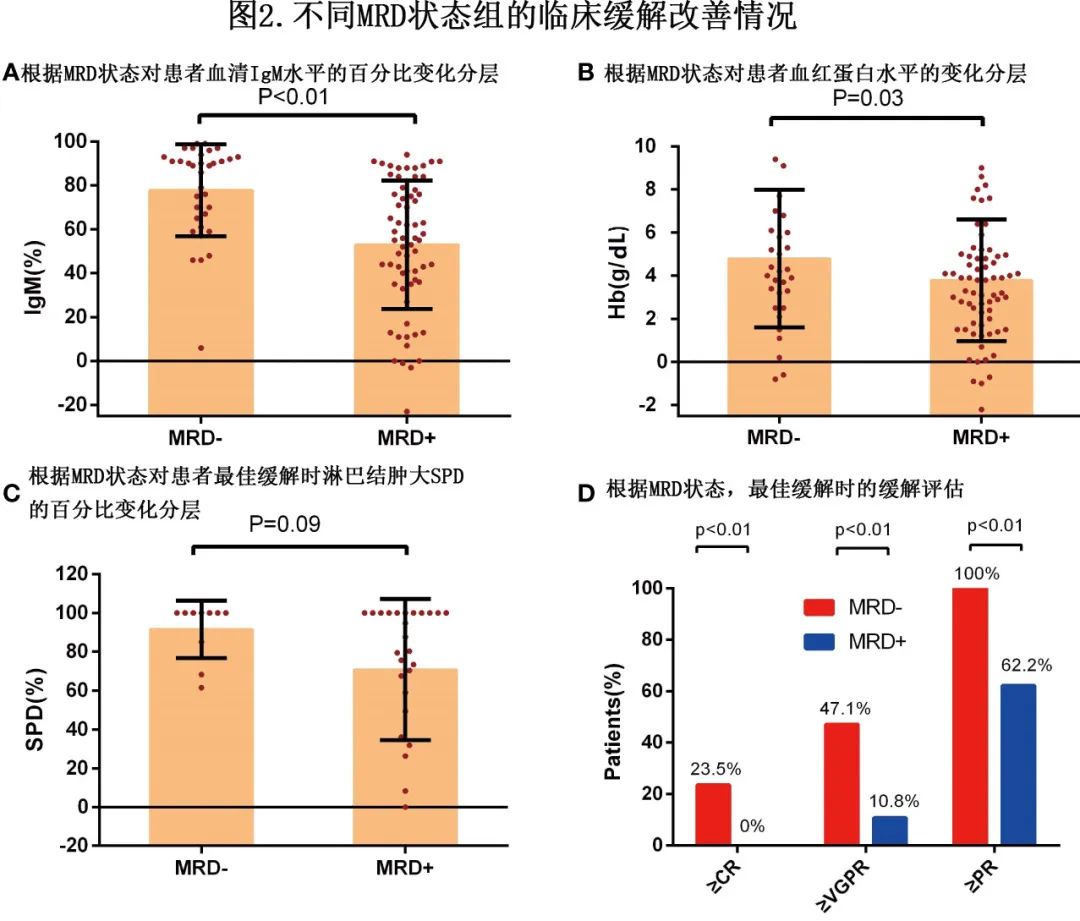
uMRD 组≥PR的比率为100%,明显高于 MRD 阳性组 (P<0.01)。uMRD组和 MRD 阳性组≥VGPR率分别为47.1%和10.8%(P<0.01)。uMRD 患者的 CR 率也高于 MRD 阳性患者(23.5% vs. 0%,P<0.01,图2D)。
MRD与BM活检之间的一致性
在达到最佳缓解后,108例患者中的90例同时评估 MRD 状态(MFC)和 BM 活检(免疫组织化学)。如 MFC 和 BM 活检所示,分别在32%和41%的 MRD 样本中检测到肿瘤细胞缺失。根据 MFC 和 BM 活检状态计算的 MRD 状态之间的一致率适度,为79%(Cohen k系数:0.55),但19例病例 (21%) 显示结果不一致(14例患者 MFC MRD 阳性但 BM 活检 MRD 阴性,5例患者 MFC MRD 阴性但 BM 活检 MRD 阳性)。
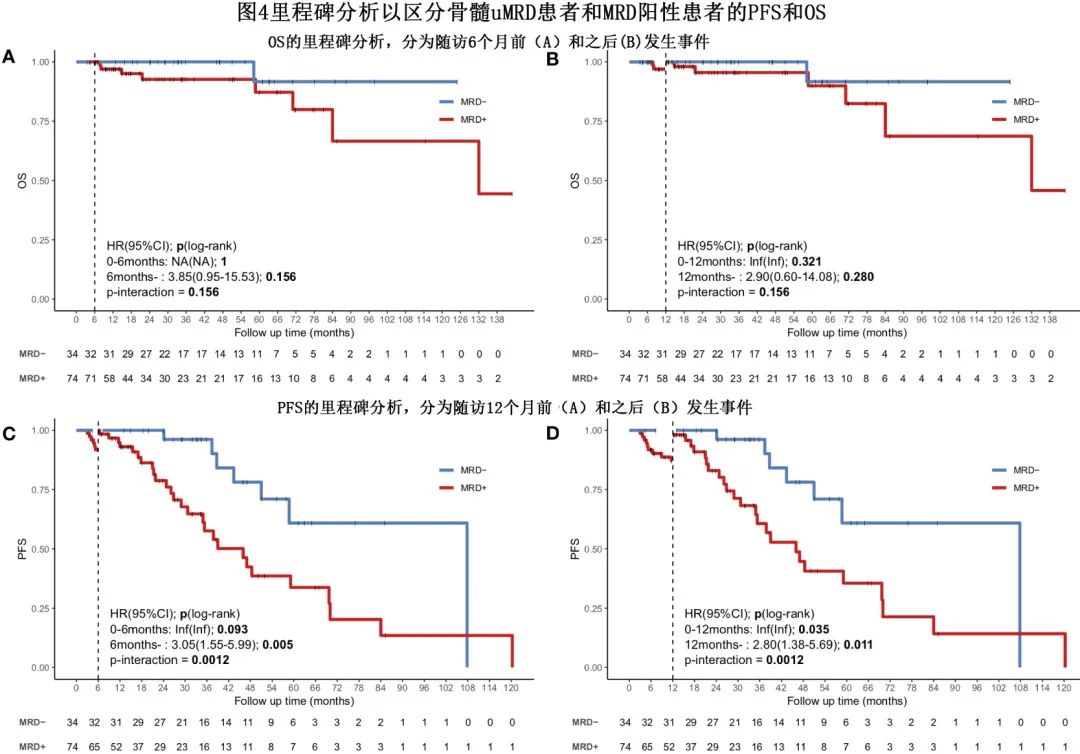
MRD状态预测生存期
中位随访时间30.8个月,估计的中位 PFS 为51个月,未达到中位OS。
uMRD 患者的 PFS 优于 MRD 阳性患者(3年PFS,96.2% vs. 52.8%;P=0.0012,图3A),但OS未观察到显著差异,3年 OS 率分别为100%和92.6%(P=0.16;图3B)。

为避免永生时间偏倚(immortal time bias),作者在诱导治疗开始后6个月和12个月使用里程碑分析评估了生存期。uMRD 组和 MRD 阳性组 OS 的里程碑分析仍显示6个月和12个月时无显著差异(图4A,B)。但不同 MRD 状态患者 PFS 的里程碑分析显示,uMRD患者在前6个月内和随后几个月的 PFS 略优于 MRD 阳性患者 (P=0.093)(风险比 (HR)=3.05,P=0.005),12个月 PFS 的里程碑分析也显示了相似的结果(12个月时P=0.035;12个月后HR=2.8,P=0.011)(图4C、D)。
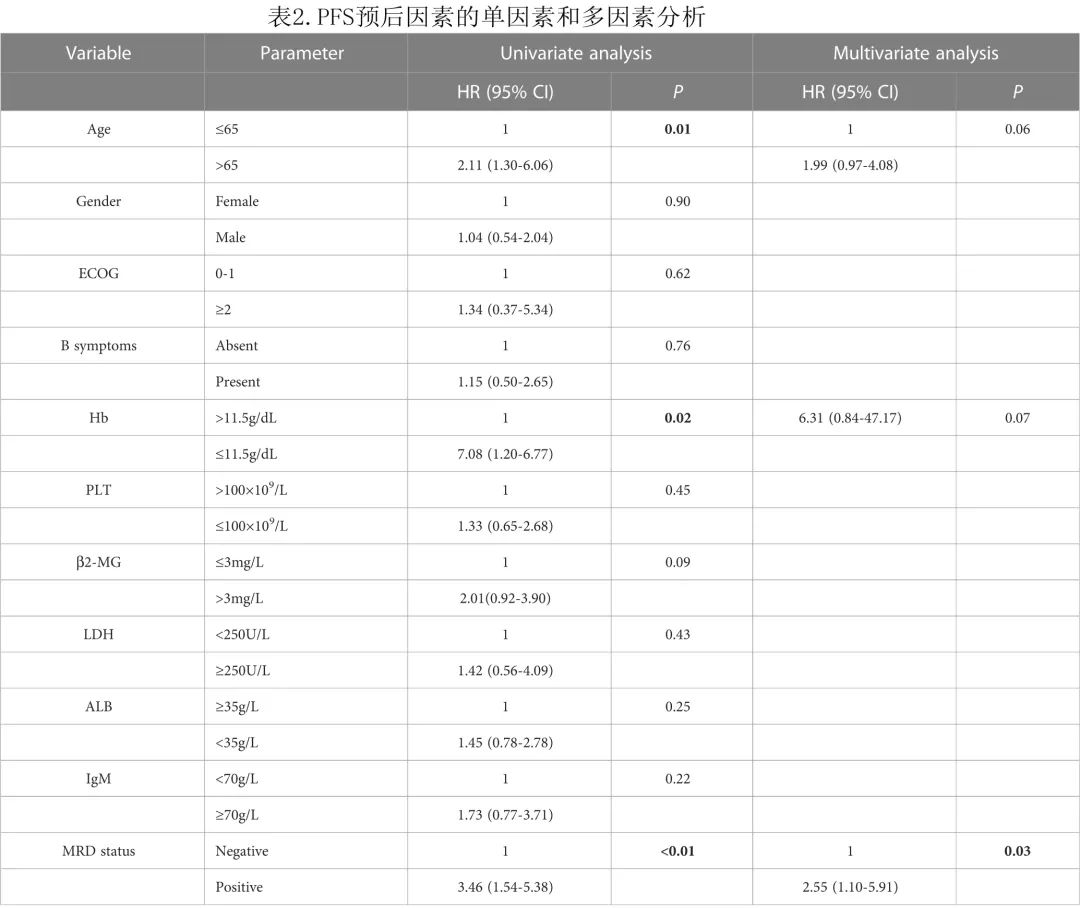
单因素和多因素分析
在单因素分析中,与 PFS 较差相关的因素包括年龄>65岁 (HR=2.11,P=0.01)、血红蛋白≤11.5 g/L (HR=7.08,P=0.02) 和 MRD 阳性状态 (HR=3.46,P<0.01)。在多因素分析中,仅 MRD 阳性状态 (HR=2.55,P=0.03) 是 PFS 的独立不良因素(表2)。在多因素分析中纳入其他预后因素(如IPSSWM)后发现 MRD 仍是独立的不良预后因素。此外PFS的亚组分析显示,MRD阳性对结局的影响与总体研究结果基本一致。
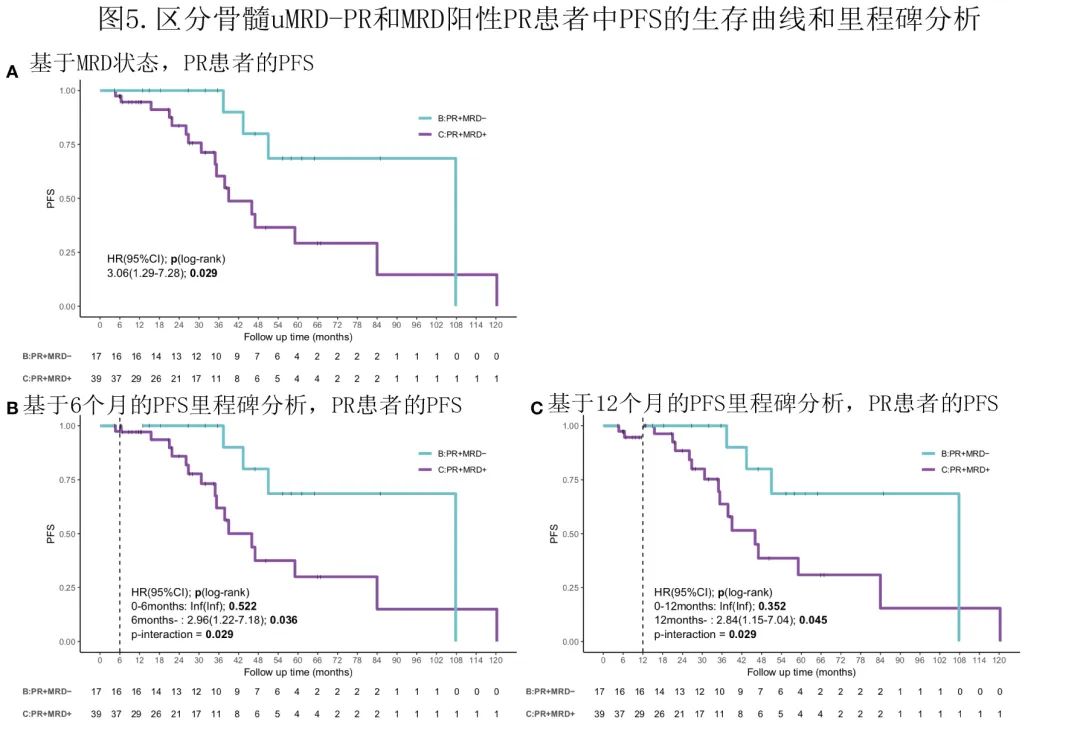
合并MRD和缓解评估
达到≥VGPR的患者中位 PFS 为70.0个月,长于达到 PR 的患者(51.0个月),但未见明显差异 (P=0.85)。与达到 PR 的患者相比,达到 MR 或 SD 的患者结局相当且较差(中位 PFS 24.8个月)(P<0.01)。
大多数患者达到PR(51.8%),因此尚不清楚达到 PR 的患者是否存在预后差异,因此作者使用 MRD 状态和 PR 的组合来确定患者的预后,因为大多数≥VGPR的患者达到uMRD。缓解结合 MRD 可导致结局的显著差异:uMRD PR 患者的结局显著更优,与达到≥VGPR的患者相当(中位PFS:107.8个月 vs. 70.0个月;P=0.22);MRD 阳性 PR 患者的中位 PFS 为46.0个月,短于 uMRD PR 患者 (P=0.029,HR=3.06)(图5A)。6个月和12个月的里程碑分析也显示,6个月 (HR=2.96,P=0.036) 或12个月 (HR=2.84,P=0.045) 后,uMRD PR组的 PFS 也优于 MRD 阳性 PR 组(图5B,C)。
作者还分析了 MRD 阳性 PR 与MR/SD 的结局,发现 MRD 阳性 PR 患者的中位 PFS 长于 MR/SD 患者,但无显著差异(P=0.11)。而且,根据受试者工作特征曲线,MRD联合改良 IWWM 第6版疗效标准的3年 AUC 略高于单独使用 IWWM 第6版疗效标准;这一发现说明 MRD 联合 IWWM 第6版疗效标准也可有效预测PFS,尤其是在达到 PR 的患者中(3年AUC:0.71 vs. 0.67)。
总结
本研究发现,在所有患者中34例 (31.5%) 达到uMRD。血红蛋白水平>115 g/L (P=0.03)、血清白蛋白水平>35 g/L(P=0.01)、b2-MG水平≤3mg/L (P=0.03)、低危IPSSWM分期 (P<0.01) 与较高的 uMRD 率相关。与 MRD 阳性患者相比,uMRD患者单克隆免疫球蛋白 (P<0.01) 和血红蛋白 (P=0.03) 水平的改善更明显。uMRD 患者的3年PFS优于 MRD 阳性患者 (96.2% vs.52.8%;P=0.0012)。里程碑分析还显示,6个月和12个月后,与 MRD 阳性患者相比,uMRD患者的 PFS 更好。获得PR且uMRD的患者3年 PFS 为100%,显著高于 MRD 阳性 PR 的患者 (62.6%,P=0.029)。多因素分析显示,MRD阳性是 PFS 的独立影响因素 (HR=2.55,P=0.03)。此外,IWWM-6标准联合MRD评估与单独使用 IWWM-6 标准相比,具有更高的3年AUC(0.71 vs. 0.67)。
之前尚缺乏研究评估 MRD 状态在 WM 中的预后意义,而本研究首次在大型队列中系统评估了 MRD 状态对 WM 预后的影响。血红蛋白和血清白蛋白水平低、b2-MG水平升高和高危 IPSSWM 分期的患者维持 MRD 阳性的风险增加,这些特征均为预后不良的预测因素,可直接或间接反映肿瘤负荷,因此高肿瘤负荷患者更难达到uMRD。随着疗程数的增加,血红蛋白水平和血小板计数显著改善,从而可改善 MRD 状态。此外,与 MRD 阳性患者相比,uMRD患者显示出显著更好的血清 IgM 应答及血红蛋白水平和淋巴结肿大的改善。上述研究结果表明,MRD反应可实时反映 BM 肿瘤负荷的动态变化和血清 IgM 或血红蛋白的水平。
总的来说,本研究表明,通过 MFC 评估的MRD状态是评估治疗疗效的敏感方法,也是 PFS 的独立预后因素,MRD可提高缓解评估的精确度,尤其是在达到 PR 的患者中。但也需要对前瞻性患者系列进行进一步评估,以评估 MRD 是否可用于缓解评估。
参考文献
Xiong WJ,Wang ZZ, TY,et al. Minimal residual disease status improved the response evaluation in patients with Waldenström’s macroglobulinemia.Front Immunol . 2023 May 10;14:1171539. doi: 10.3389/fimmu.2023.1171539. eCollection 2023.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言