这十款药物,今年有望获FDA批准!
2024-03-14 药渡 药渡 发表于威斯康星
2024年开年至今,FDA批准了用于治疗成人和一岁及以上小儿的传染性软疣药物Zelsuvmi以及全球首款实体瘤TIL疗法Lifileucel等,那么3月至年底FDA有望批准的药物有哪些呢?
2024年开年至今,FDA批准了用于治疗成人和一岁及以上小儿的传染性软疣药物Zelsuvmi以及全球首款实体瘤TIL疗法Lifileucel等,那么3月至年底FDA有望批准的药物有哪些呢?
1、Resmetirom THR-β选择性激动剂
Resmetirom是由Madrigal Pharmaceuticals研发的每日一次的口服甲状腺激素β受体(THR-β)选择性激动剂,用于治疗非酒精性脂肪性肝炎(NASH)。THR-β负责调节肝脏中的代谢途径,在NSAH患者中,THR-B功能损坏使甲状腺激素水平降低导致肝功能受损
Resmetirom于2023年4月18日获得FDA的突破性疗法认定,用于治疗伴有肝纤维化的NASH患者。
2023年6月,Stephen等人在Nature Medicine上报道了MAESTRO-NAFLD-1试验结果:Resmetirom治疗中出现的不良事件(TEAE)发生率为86.5%(开放标签100 mg resmetirom),86.1%(100mg resmetirom),88.4%(80mg resmetirom)和81.8%(安慰剂),表明Resmetirom安全且耐受性良好。
80mg和100mg resmetirom组治疗后LDL-C分别降低11.1%和12.6%,载脂蛋白b(apoB)分别降低15.6%和18.0%,甘油三酯分别降低15.4%和20.4%,16周肝脏脂肪分别降低34.9%和38.6%[1]。
通过磁共振成像-质子密度脂肪分数(MRI-PDFF)测量显示80mg和100mg resmetirom组16周时肝脏脂肪中位CFB %分别下降40.8%和47.7%,52周时分别下降42.5%和48.2%(图1)。
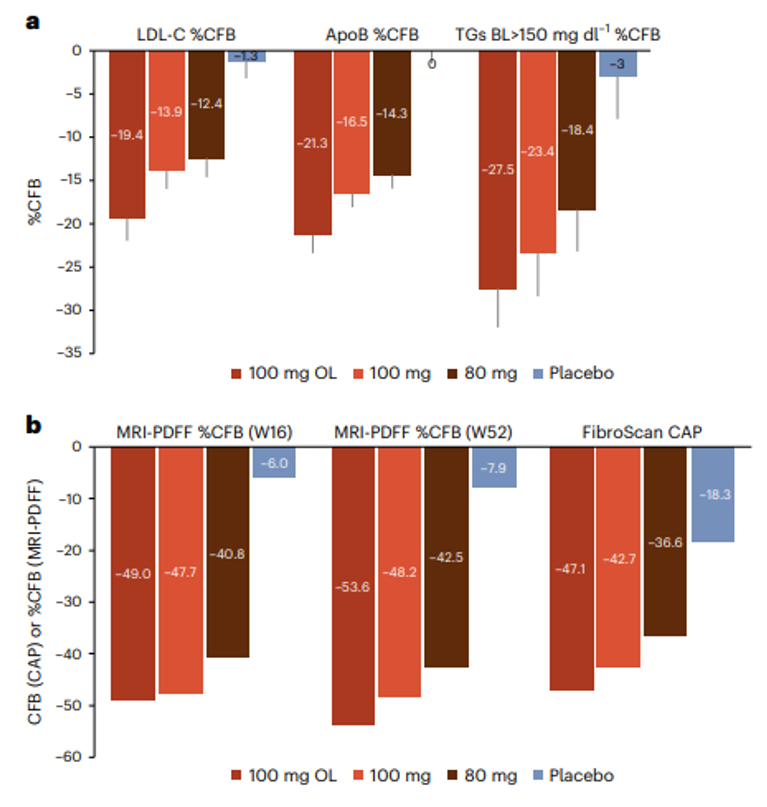
图1. MAESTRO-NAFLD-1试验结果
2023年7月,Madrigal完成向FDA滚动提交Resmetirom的新药申请(NDA),随后9月份,Madrigal宣布FDA已接受Resmetirom治疗伴有肝纤维化的NASH成人患者的NDA,并授予优先审评资格,处方药用户付费方案(PDUFA)日期为2024年3月14日。
2024年2月8日,Harrison等人在新英格兰杂志上报道了III期MAESTRO-NASH试验结果:80 mg resmetirom组25.9%的患者和100 mg resmetirom组29.9%的患者实现了NASH消退且纤维化无恶化,安慰剂组为9.7%。在80mg resmetirom组中,24.2%的患者实现了至少一个阶段的纤维化改善,NAFLD(非酒精性脂肪性肝病)活性评分没有恶化,100 mg resmetirom组为25.9%,而安慰剂组为14.2%(图2)[2]。
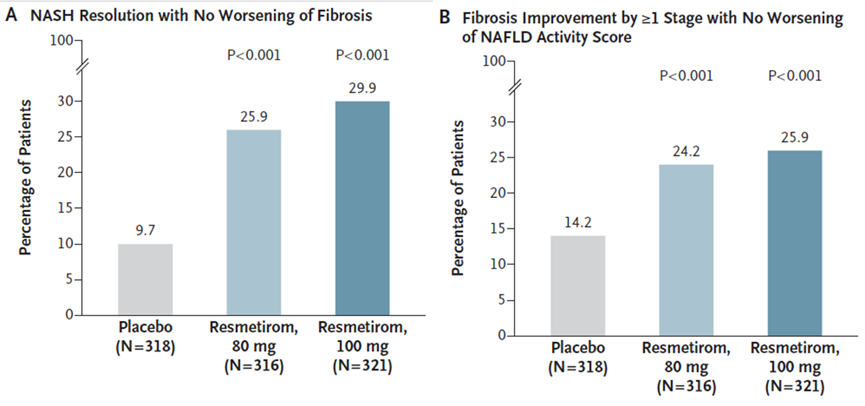
图2. MAESTRO-NASH试验结果
2、Sotatercept ACVR2A融合蛋白
Sotatercept是由Acceleron公司原研的一款潜在“First-in-class“的IIA型激活素受体(ACVR2A)融合蛋白,后在2021年9月默沙东以115亿美元收购Acceleron,将sotatercept收入囊中。
早在2020年4月份,Acceleron获得FDA突破性疗法认定,用于治疗肺动脉高压(PAH),成为首款获得突破性疗法认定的PAH在研疗法。
2023年9月12日,默沙东公布了sotatercept的III期STELLAR试验的一项探索性事后分析结果:sotatercept在治疗PAH患者24周后,可缩小心脏右侧大小,并且改善右心室功能和血液动力学指标。
2023年9月28日,默沙东公司宣布FDA已接受Sotatercept的生物制品许可申请(BLA)的优先审评,用于治疗PAH成人患者,FDA将PDUFA定为2024年3月26日[3,4]。
此次优先审评基于III期STELLAR试验数据结果,共有323名成年人参加了 STELLAR。各组的基线特征相似,79.3%的女性,平均年龄47.9±14.8岁,48.6%的世界卫生组织(WHO)功能等级(FC)II级和51.4%的WHO FC III级,61.3%接受三联治疗,39.9%接受肠胃外前列环素治疗。
研究结果显示:Sotatercept组6分钟步行距离(6MWD)增加34.4m,而安慰剂组 6MWD增加1m。
Sotatercept在9项次要结局指标中的8项显示出具有统计学意义和临床意义的改善,包括肺血管阻力(PVR)降低、N末端B型利钠肽水平降低和WHO FC改善等。
除此之外,Sotatercept在新诊断的中高危PAH参与者中的III期HYPERION研究以及在WHO功能等级FC III或IV高风险死亡参与者中的III期ZENITH研究正在进行中。
3、Tovorafenib pan-RAF激酶抑制剂
Tovorafenib是由Day One Biopharmaceuticals公司研发的一种口服、脑穿透性pan-RAF激酶抑制剂,能够抑制野生型和某些突变形式的BRAF、CRAF和ARAF蛋白激酶。
RAF激酶是RAS/RAF/MEK/ERK信号通路中的关键成员,包括ARAF、BRAF和CRAF三个亚型,其中BRAF突变频率最高,占所有RAF突变的90%以上。在大约7%的人类肿瘤中会发生BRAF突变,其在黑色素瘤中突变频率较高,大约为50%-80%。
获批上市的1-3代RAF抑制剂经过长时间用药可导致耐药性问题,为了克服耐药性,人们开始开发pan-RAF激酶抑制剂,如Day One的Tovorafenib。
2023年10月30日,Day One宣布FDA接受Tovorafenib的NDA并获得优先审评,用于治疗复发或进展性小儿低级别胶质瘤(pLGG),FDA将PDUFA目标行动日期定为2024年4月30日。
2023年11月,kilburn等人在Nature Medicine杂志上报道了Tovorafenib的临床II期FIREFLY-1试验结果:在神经肿瘤学高级别胶质瘤(RANO-HGG)患者中,Tovorafenib治疗组的总体缓解率(ORR)为67%,达到第1组预先设定的主要终点,12名患者达到完全缓解,34名患者达到部分缓解,中位缓解持续时间(DOR)为16.6 个月,中位时间缓解(TTR)为3.0个月(图3)[5]。
在小儿神经肿瘤学低级别胶质瘤(RAPNO)患者中,ORR为51%,28名患者达到部分缓解,中位DOR为13.8个月,中位TTR为5.3个月(图3)

图3. FIREFLY-1试验结果
4、Patritumab deruxtecan HER3 ADC
Patritumab deruxtecan(HER3-DXd)是由第一三共原研的一款靶向HER3的ADC药物,通过马来酰亚胺-GGFG接头将HER3单抗patritumab与拓扑异构酶I抑制剂deruxtecan连接而得。
在83%的原发性NSCLC肿瘤中观察到HER3表达,包括EGFR突变(EGFRm)的肿瘤。与野生型EGFR肿瘤相比,EGFRm NSCLC肿瘤的HER3 mRNA水平升高。在NSCLC中,HER3表达与晚期疾病、转移时间缩短和生存率降低有关。
Patritumab deruxtecan是目前研发进展最快的HER3 ADC药物,因其优秀的疗效受到默沙东的青睐,2023年10月20日,默沙东与第一三共就包括Patritumab deruxtecan在内的三款ADC药物达成了高达220亿美元的合作协议。
2023年12月22日,第一三共和默沙东共同宣布patritumab deruxtecan的BLA获FDA受理并予以优先审评,用于治疗既往至少接受过两种系统治疗的EGFRm局部晚期或转移性非小细胞肺癌(NSCLC),成为首款申报上市的HER3 ADC,FDA将PDUFA日期定为2024年6月26日。
此次BLA是基于2期HERTHENA-Lung01积极结果,此项试验的主要终点是ORR,在EGFR TKI和铂类化疗后疾病进展的225例EGFR突变局部晚期或转移性NSCLC患者中patritumab deruxtecan治疗的ORR为29.8%,包括1例完全缓解和66例部分缓解(图4)[6]。

图4. Patritumab deruxtecan在肺癌中临床试验
除此之外,第一三共/默沙东在临床上开展多项试验,探索Patritumab deruxtecan新适应症,包括黑色素瘤、头颈部鳞状细胞癌(SCCHN)、HER2阴性胃癌等(图5)。
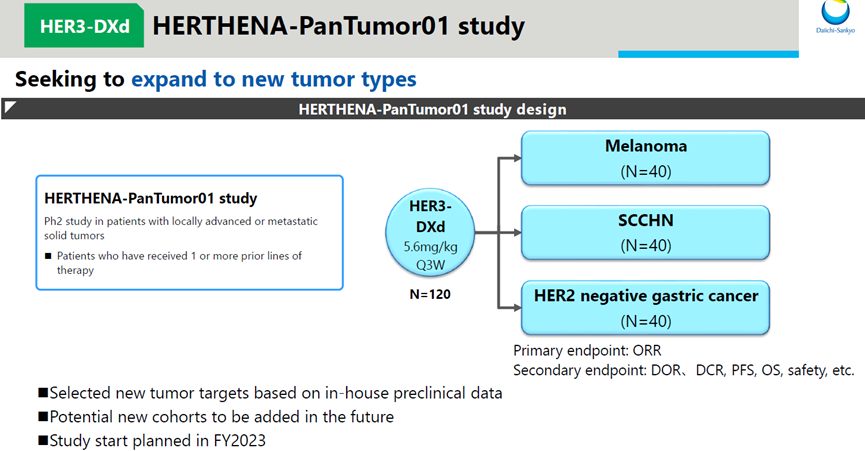
图5. Patritumab deruxtecan临床试验方案
5、Tarlatamab DLL3/CD3双抗
Tarlatamab是由安进研发的一种针对DLL3(δ样配体3)和CD3的双特异性T细胞衔接器(BiTE)类药物,可以将T细胞募集到小细胞肺癌细胞附近,激活T细胞杀伤肿瘤细胞,用于治疗晚期小细胞肺癌(SCLC)。
2023年5月,tarlatamab获NMPA批准临床,拟用于接受含铂一线化疗后的复发性小细胞肺癌受试者。
2023年12月13日,安进宣布Tarlatamab的BLA申请获FDA受理并获优先审评资格,针对晚期SCLC。FDA将PDUFA决定日期定在2024年6月12日[7]。
此次BLA基于DeLLphi-301临床试验的II期结果:在铂类化疗期间或之后疾病进展的晚期SCLC患者中,10mg和100mg组的ORR分别达到40%和32%,反应持续时间至少为6个月,无进展生存期(PFS)分别为4.9个月和3.9个月,9个月时总生存率(OS)预计为68%和66%(图6)[8]。
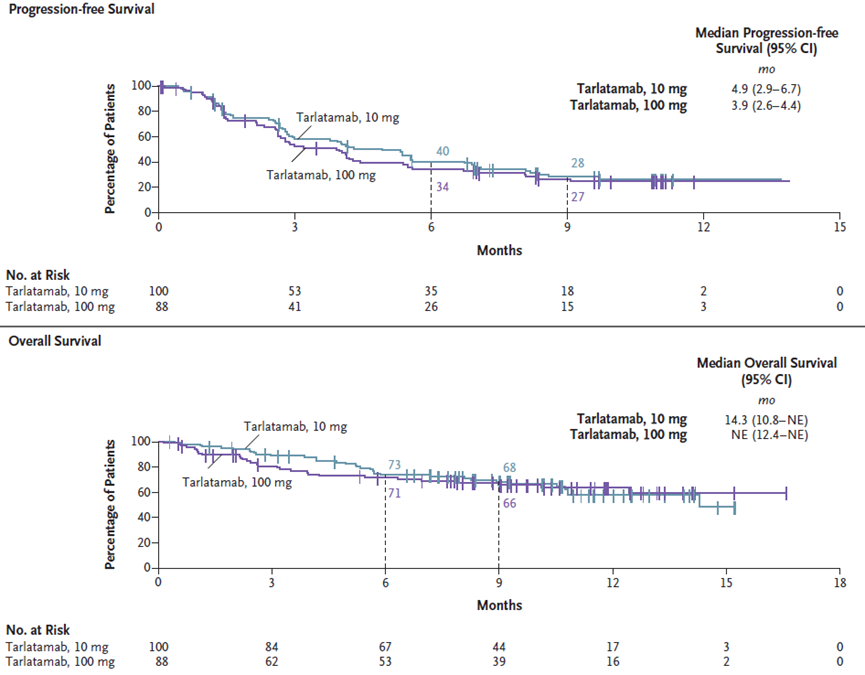
图6. DeLLphi-301临床试验结果
6、Fidanacogene elaparvovec B型血友病新型基因疗法
Fidanacogene elaparvovec是由Spark Therapeutics研发的一种新型基因疗法,含有生物工程腺相关病毒(AAV)衣壳和人类凝血因子IX(FIX)基因的高活性变体,用于治疗B型血友病。
B型血友病患者缺乏凝血FIX,也称为先天性FIX缺乏症或圣诞病。根据世界血友病联合会的数据,2021年全球有超过38,000人患有B型血友病。目前的护理标准要求反复静脉输注血浆来源或重组FIX,以控制和预防出血发作。
2014年12月,辉瑞从Spark Therapeutics获得与fidanacogene elaparvovec合作许可。根据该协议,Spark Therapeutics负责进行研究性基因治疗的所有1/2期研究;辉瑞则负责关键研究、任何监管活动和潜在的全球商业化。
Fidanacogene elaparvovec已获得FDA授予突破性、再生医学先进疗法(RMAT)和孤儿药资格。
2023年6月27日,辉瑞宣布FDA已接受Fidanacogene elaparvovec的BLA,用于治疗成人B型血友病患者,FDA将PDUFA的目标日期定为2024年第二季度[9]。
与此同时,Fidanacogene elaparvovec的欧洲上市许可申请(MAA)也已被接受,并正在接受欧洲药品管理局(EMA)的审查。
此次BLA是基于III期BENEGENE-2研究(NCT03861273)的疗效和安全性数据:Fidanacogene elaparvovec输注后总出血率(ABR)与FIX预防方案(作为常规护理的一部分)相比,呈现出非劣效性和优越性。Fidanacogene elaparvovec总体耐受性良好,安全性与1/2期结果一致
7、Danicopan 口服补体替代途径因子D抑制剂
Danicopan最初是由Alexion研发的口服小分子药物,后于2020年阿斯利康斥资约390亿美元收购该公司而获得该疗法,用于治疗阵发性睡眠性血红蛋白尿(PNH)。
PNH是一种罕见且严重的血液疾病,其特征是血管内红细胞的破坏,称为血管内溶血(IVH),以及白细胞和血小板活化,可导致血栓形成(血栓)并导致器官损伤和潜在的过早死亡。
大约10-20%接受C5抑制剂治疗的PNH患者会出现具有临床意义的血管外溶血(EVH),这可能导致持续的贫血症状并需要输血。Danicopan可选择性地抑制补体系统中的替代通路,阻断C3转化酶生产,控制PNH患者的血管外溶血来治疗PNH。
2023年6月9日,阿斯利康公布了Danicopan的关键性III期ALPHA试验的积极结果:在经历有临床意义的EVH的PNH患者中,与安慰剂加C5抑制剂治疗相比,Danicopan加C5抑制剂治疗显示出血红蛋白水平的统计学显著增加和临床意义的增加,并维持了疾病控制(图7)[10]。

图7. ALPHA试验结果
2024年1月18日,danicopan作为标准疗法补体因子C5抑制剂Ultomiris(ravulizumab)或Soliris(eculizumab)的附加疗法在日本批准上市,用于接受C5抑制剂治疗时发生显著EVH的PNH患者。
此次获批是基于III期ALPHA试验的积极结果:与安慰剂组相比,Danicopan组的患者在12周时血红蛋白水平较基线的变化具有显著的统计学意义和临床意义上的改善,研究达到主要终点。该项研究还满足了关键的次要终点,包括避免输血和FACIT疲劳评分变化。
除此之外,danicopan在美国和欧盟也处于审查阶段,今年有望获批上市。
8、Crovalimab C5单抗
Crovalimab是由罗氏开发的一种通过连续单克隆抗体回收技术工程化改造的新一代C5抑制剂,可以阻断补体C5裂解为C5s和C5b,有望抑制补体活化(图8)。

图8. Crovalimab作用机制
与现有的PNH疗法相比,Crovalimab可将给药间隔延长至每4周1次自行皮下注射,提高了现有PNH疗法的有效性和便利性。
2023年9月4日,罗氏宣布FDA已接受crovalimab的BLA,如果获得批准,crovalimab将成为首款治疗PNH的每月仅需用药一次的皮下制剂疗法,并且患者可自行给药。
此次BLA是基于关键的III期COMMODORE 2研究结果:在PNH患者中,Crovalimab在溶血控制的共同主要终点中不劣于eculizumab,实现了疾病控制并且耐受性良好(图9)[11]。
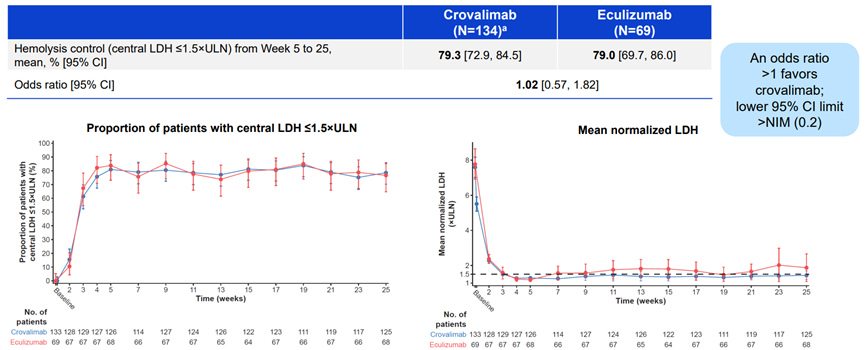
图9. COMMODORE 2试验结果
2024年2月8日,crovalimab在国内获批上市,用于治疗既往未接受过补体抑制剂治疗的PNH成人和青少年(12岁及以上)患者。
9、KarXT 复方制剂
Xanomeline-trospium(KarXT)是由Karuna Therapeutics研发的一款潜在的“first-in-class”用于治疗精神分裂症的药物,后于2023年12月22日,BMS以140亿美元收购Karuna将KarXT收入囊中。
KarXT是由M1/M4激动剂呫诺美林(xanomeline)和M受体拮抗剂trospium组成的复合物,旨在激活大脑中的毒蕈碱型乙酰胆碱受体的同时,减少对外周毒蕈碱型乙酰胆碱受体的作用,是同类药物中第一种具有真正新颖和独特双重机制的潜在药物。
2023年11月29日,Karuna宣布美国FDA已接受其KarXT用于治疗成人精神分裂症的NDA,FDA将PDUFA日期定在2024年9月26日,如果获得批准,KarXT将是几十年来第一种治疗精神分裂症的新药理学方法[12]。
此次NDA提交得到了EMERGENT项目的疗效和长期安全性数据的支持,包括三项已完成评估KarXT与安慰剂相比,疗效和安全性的EMERGENT-1、EMERGENT-2和EMERGENT-3试验,以及评估KarXT长期安全性的EMERGENT-4和EMERGENT-5 试验。
在所有三项安慰剂对照试验中,KarXT都达到了其主要终点,通过阳性和阴性综合征量表(PANSS)总分衡量,与安慰剂相比,KarXT在精神分裂症症状方面显示出统计学意义和临床意义的改善。研究发现KarXT通常耐受性良好,最常见的不良事件本质上是胆碱能不良事件,严重程度为轻度至中度。
2023年12月,Kaul等人在柳叶刀杂志上报道了KarXT治疗精神分裂症的疗效和安全性的III期EMERGENT-2试验结果:该试验达到了主要终点,到第5周时,KarXT组PANSS总分与基线相比平均下降了21.2分,而安慰剂组下降了11.6分,KarXT组比安慰剂组降低了9.6分(图10)。
第5周时,与安慰剂相比,KarXT组PANSS阳性分量表评分降低2.9分,PANSS负分量表降低1.8分评分和PANSS Marder阴性因素评分降低2.2分(图10)[13]。
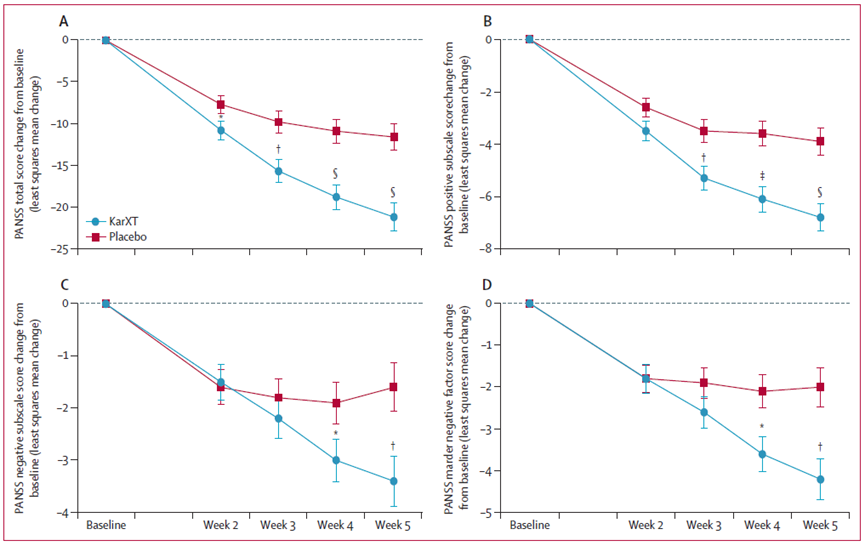
图10. EMERGENT-2试验结果
10、Dato-DXd Trop-2 ADC
Datopotamab Deruxtecan(Dato-DXd)是由第一三共和阿斯利康共同开发的一种人源化Trop-2 ADC,通过四肽的可裂解接头将抗体与拓扑异构酶1抑制剂连接而得。
不同于Trodelvy,阿斯利康/第一三共计划将晚期非小细胞肺癌作为Dato-DXd的首发适应症,将Dato-DXd转变为NSCLC治疗化疗的潜在替代品。
此前,用于评估Dato-DXd治疗NSCLC患者疗效的TROPION-Lung01和TROPION-Lung02试验都取得积极结果。TROPION-Lung02研究结果显示,Dato-DXd联合免疫治疗或Dato-DXd联合免疫治疗+化疗治疗晚期NSCLC患者ORR分别为38%和49%,疾病控制率(DCR)分别为84%和87%,中位PFS分别为8.3个月和7.3个月。
除此之外,第一三共/阿斯利康在临床上开展多项探索Dato-DXd新适应症的试验,包括乳腺癌、结直肠癌和尿路上皮癌等。
Dato-DXd联合Durvalumab一线治疗PD-L1阳性转移性三阴性乳腺癌的III期TROPION-Breast05临床试验已于2023年11月开启(图11)。
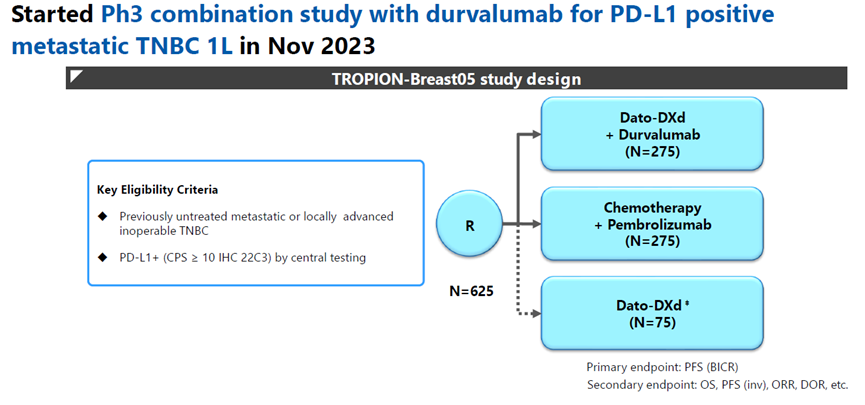
图11. TROPION-Breast05临床试验设计方案
近期,在第一三共公布的财报上也公布了Dato-DXd辅助治疗HR低、HER2低乳腺癌患者的III期临床方案,如图12所示。

图12. 辅助治疗HR低、HER2低乳腺癌患者的3期临床方案
2024年2月19日,阿斯利康/第一三共宣布Dato-DXd的BLA已被FDA接受,用于治疗既往接受过全身治疗的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)成人患者,FDA将PDUFA日期定在2024年第四个季度。
此次BLA是基于关键的III期TROPION-Lung01试验结果,在该试验中,Dato-DXd在局部晚期或转移性NSCLC患者中显示出统计学上的显著改善,与多西他赛(目前的标准治疗)相比,双重主要终点之一的无进展生存期(PFS)有统计学上的显著改善,另一主要终点总生存期(OS)在总体人群中,中期结果在数值上优于多西他赛,然而,在数据截止时,结果没有达到统计学意义。
总的来说,在非鳞状NSCLC患者中,Dato-DXd显示出具有临床意义的PFS获益和数值上有利的OS趋势。该试验正在进行中,OS将在最终分析时进行评估。
参考文献:
1.Stephen A. Harrison, Resmetirom for nonalcoholic fatty liver disease: a randomized, double-blind, placebo-controlled phase 3 trial, Nature Medicine | Volume 29 | November 2023 | 2919–2928
2.Stephen A. Harrison et.al, A Phase 3, Randomized, Controlled Trial of Resmetirom in NASH with Liver Fibrosis, N Engl J Med 2024; 390:497-509
3.Merck Receives Priority Review from FDA for New Biologics License Application for Sotatercept, an Activin Signaling Inhibitor to Treat Adults with Pulmonary Arterial Hypertension (PAH)
4.Role of Sotatercept in Management of Pulmonary Arterial Hypertension: The STELLAR Trial
5.Lindsay B. Kilburn et.al, The type II RAF inhibitor tovorafenib in relapsed/refractory pediatric low-grade glioma: the phase 2 FIREFLY-1 trial, Nature Medicine volume 30, pages207–217 (2024)
6.FY2023 Q3 Financial Results Presentation DAIICHI SANKYO CO., LTD.
7.FDA GRANTS PRIORITY REVIEW TO AMGEN'S TARLATAMAB APPLICATION FOR ADVANCED SMALL CELL LUNG CANCER
8.M.-J. Ahn et.al, Tarlatamab for Patients with Previously Treated Small-Cell Lung Cancer, N Engl J Med 2023;389:2063-75.
9.FDA Accepts Pfizer’s Application for Hemophilia B Gene Therapy Fidanacogene Elaparvovec
10.Danicopan as add-on to Ultomiris or Soliris improved haemoglobin levels and maintained disease control in patients with PNH experiencing signs or symptoms of clinically significant extravascular haemolysis
11.THE PHASE III, RANDOMIZED COMMODORE 2 TRIAL: RESULTS FROM A MULTICENTER STUDY OF CROVALIMAB VS ECULIZUMAB IN PAROXYSMAL NOCTURNAL HEMOGLOBINURIA PATIENTS NAIVE TO COMPLEMENT INHIBITORS
12.Karuna Therapeutics Announces U.S. Food and Drug Administration Accepts New Drug Application for KarXT for the Treatment of Schizophrenia
13.Inder Kaul, Sharon Sawchak, Christoph U Correll, Rishi Kakar, Alan Breier, Haiyuan Zhu, Andrew C Miller, Steven M Paul, Stephen K Brannan, Efficacy and safety of the muscarinic receptor agonist KarXT (xanomeline–trospium) in schizophrenia (EMERGENT-2) in the USA: results from a randomised, double-blind, placebocontrolled, flexible-dose phase 3 trial
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













不错,学习了。
17
#FDA#
17