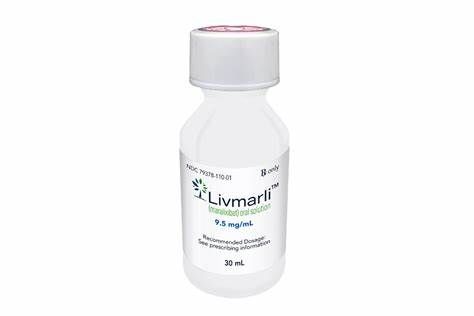
美国FDA批准Livmarli治疗Alagille综合征(ALGS)相关胆汁淤积性瘙痒的药物!
2023-07-09 生物谷 生物谷 发表于上海
Mirum Pharma是一家致力于开发创新疗法治疗罕见肝脏疾病的生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已批准Livmarli(maralixibat)口服液,该药每日口服一次

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











美国#FDA#批准#Livmarli#治疗#Alagille综合征#(ALGS)相关#胆汁淤积性瘙痒#的药物!
68