【Cancer】托珠单抗对CD19 CAR-T治疗B-ALL的影响:中国多中心回顾性研究
2024-04-11 聊聊血液 聊聊血液 发表于陕西省
国内学者开展一项多中心回顾性研究,分析了93例R/R B-ALL患者接受CD19 CAR-T细胞疗法的疗效和毒性数据,并探索托珠单抗的使用是否会影响CD19 CAR-T细胞疗法的疗效和/或增加副作用。
托珠单抗之于CAR-T
CAR-T细胞疗法从实验室进入临床后,显著改善了血液恶性肿瘤的治疗,包括复发/难治性急性B淋巴细胞白血病(R/R B‐ALL)。接受CAR-T治疗的R/R BALL患者可能发生潜在的危及生命的不良事件,如严重的细胞因子释放综合征(CRS)和免疫效应细胞相关的神经毒性综合征(ICANS),从而限制免疫治疗的适用性。
托珠单抗通常用于治疗嵌合抗原受体(CAR) T细胞疗法相关的细胞因子释放综合征(CRS),但其对CD19 CAR-T细胞的抗肿瘤效力可能有影响,然而目前缺乏描述托珠单抗治疗对CD19 CAR-T细胞疗法疗效和安全性影响的临床数据,因此托珠单抗及其剂量是否会影响CAR-T细胞疗法的疗效和安全性仍不清楚。
国内学者开展一项多中心回顾性研究,分析了93例R/R B-ALL患者接受CD19 CAR-T细胞疗法的疗效和毒性数据,并探索托珠单抗的使用是否会影响CD19 CAR-T细胞疗法的疗效和/或增加副作用。研究结果近日发表于《Cancer》,通讯作者为徐州医科大学附属医院徐开林教授和桑威教授。

研究结果
基线特征
该回顾性研究纳入国内4家中心接受CD19 CAR-T治疗的93例B-ALL患者。其中45例患者(48.4%)在CD19 CAR-T细胞输注后30天内接受托珠单抗治疗(托珠单抗组),48例患者(51.6%)未接受托珠单抗治疗(非托珠单抗组)(图1)。13例患者接受了1剂以上的托珠单抗治疗(8mg/kg的托珠单抗定义为1剂)。在托珠单抗组中,中位累积剂量为480mg。
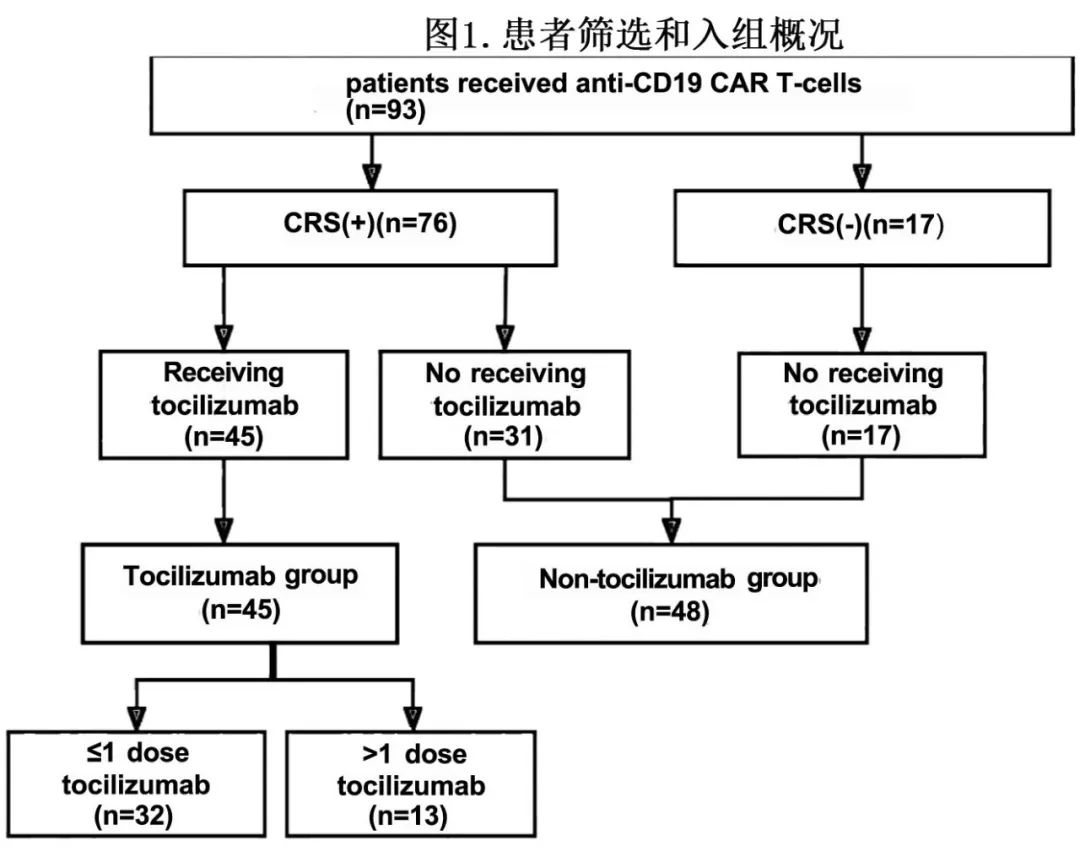
患者中位年龄33岁,66.7%(62/93)的患者年龄≥40岁;男47例,女46例。18例患者为费城染色体阳性,其中8例接受托珠单抗治疗。61例患者(65.6%)在CAR-T细胞治疗前骨髓原始细胞超过20%,其中32例患者在CAR-T细胞输注后接受托珠单抗治疗。接受CD19 CAR-T细胞治疗的患者既往接受的治疗线中位数为4线。在复发≥3次的11例患者中,3例接受托珠单抗治疗,12例原发性难治ALL患者中有7例未接受托珠单抗治疗。10例患者在CAR-T细胞治疗前有异基因造血干细胞移植史,其中3例接受托珠单抗治疗,但7例未接受(p=0.319)。托珠单抗组和非托珠单抗组的上述基线特征无显著差异(表1)。
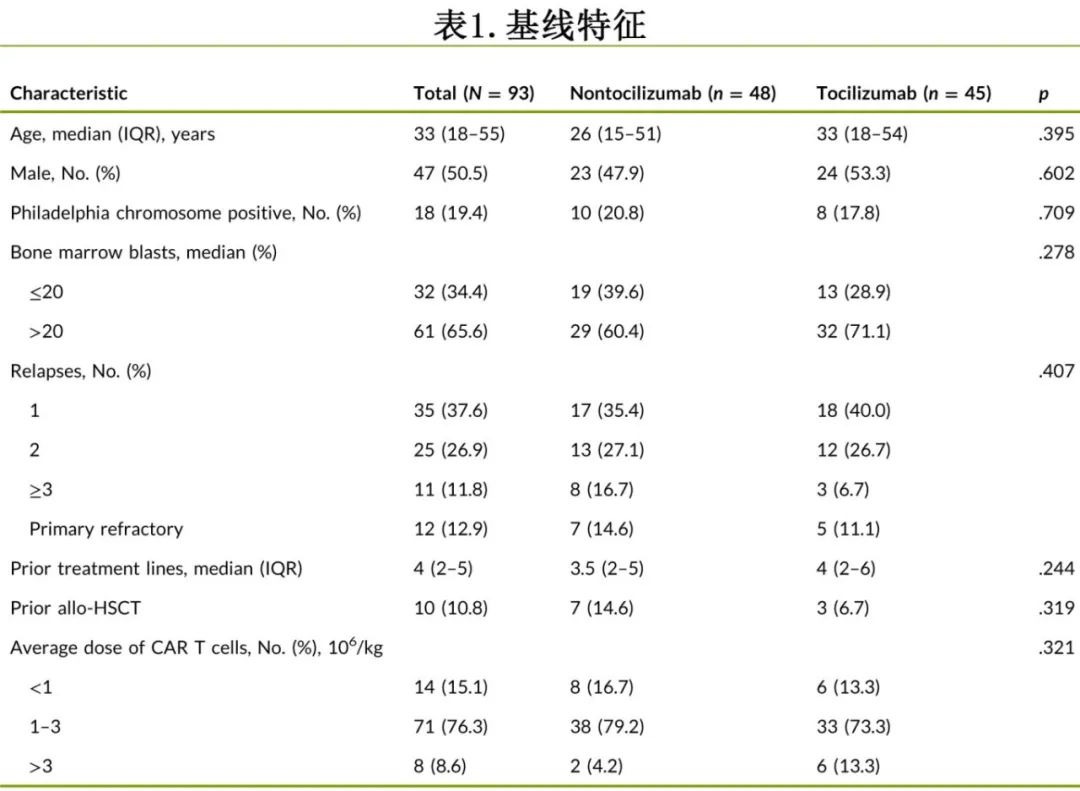
缓解率
在第30天评估时,93例患者中有86例(92.5%)达到CR。非托珠单抗组44例(91.7%)获得CR,包括36例(75%)MRD阴性CR;托珠单抗组42例(93.3%)达到CR, MRD阴性CR为84.4%(38/45)。两组的CR率无显著差异(图2A)。接受>1剂托珠单抗治疗的患者中,100% (13/13)达到CR、 92.3%(12/13)达到MRD阴性CR,与未接受或仅接受1剂托珠单抗治疗的患者中91.3%(73/80)达到CR、80%(64/80)达到MRD阴性CR;图2B)。
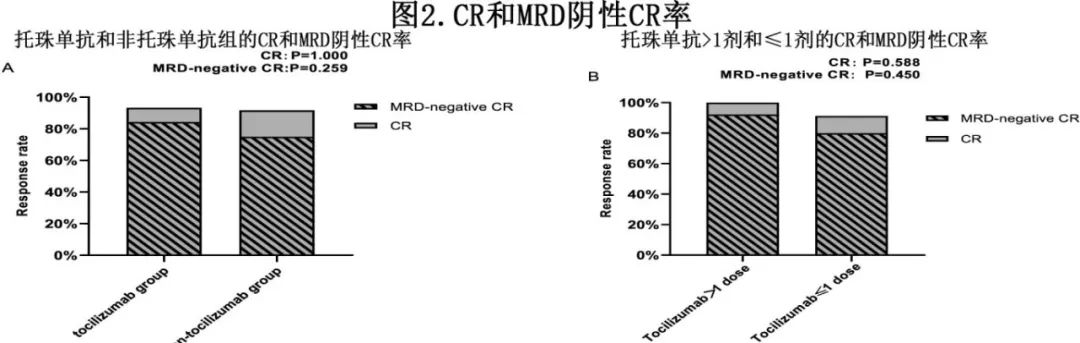
长期结局
中位随访38.3个月,所有患者的中位OS为20.7个月,3年OS率为38.6%;所有患者的中位EFS为10.2个月,3年EFS率为31.4% (图3A,B)。与非托珠单抗组相比,托珠单抗组的OS和EFS无显著差异(图3C、D)。与未接受或仅接受1剂托珠单抗的患者相比,使用>1剂托珠单抗不影响OS和EFS (OS和EFS分别为p=0.548和p=0.996;图3E、F)。
不良事件
93例患者中有76例(81.7%)发生CRS, 19例(20.4%)发生≥3级CRS。至发生≥3级及CRS的中位时间为5天,中位持续时间为10天。
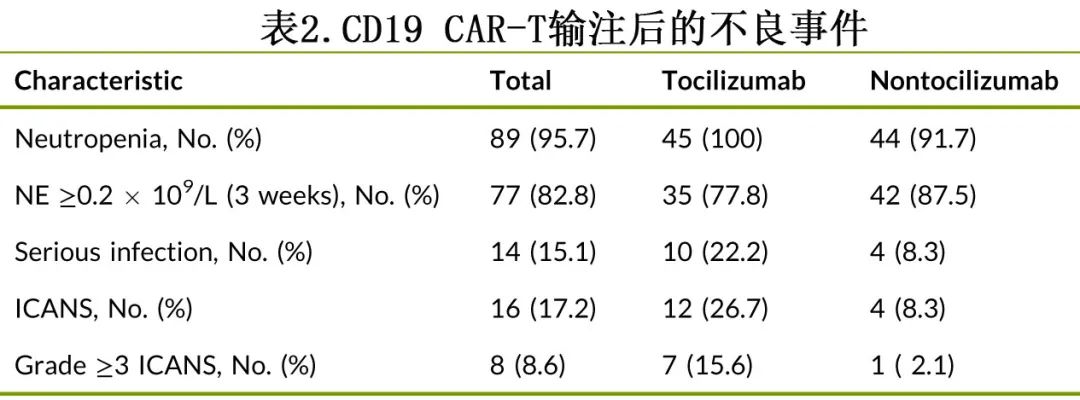
共16例患者发生ICANS,其中75%(12/16)在托珠单抗组,25%(4/16)在非托珠单抗组。ICANS的中位发作时间为CAR-T细胞输注后8天,中位持续时间为2天。15例ICANS患者合并CRS,其中1例发生于CRS前、10例发生于CRS期间、4例发生于CRS后。8例患者(8.6%)发生≥3级ICANS,中位持续时间为3.5天,且≥3级ICANS中87.5%(7/8)发生于托珠单抗组。托珠单抗组4例患者发生以惊厥性癫痫持续状态为特征的4级ICANS,皮质类固醇和支持治疗后达到CR。只有4例ICANS患者未接受托珠单抗治疗,其中3例为1级、1例为3级ICANS (表2)。
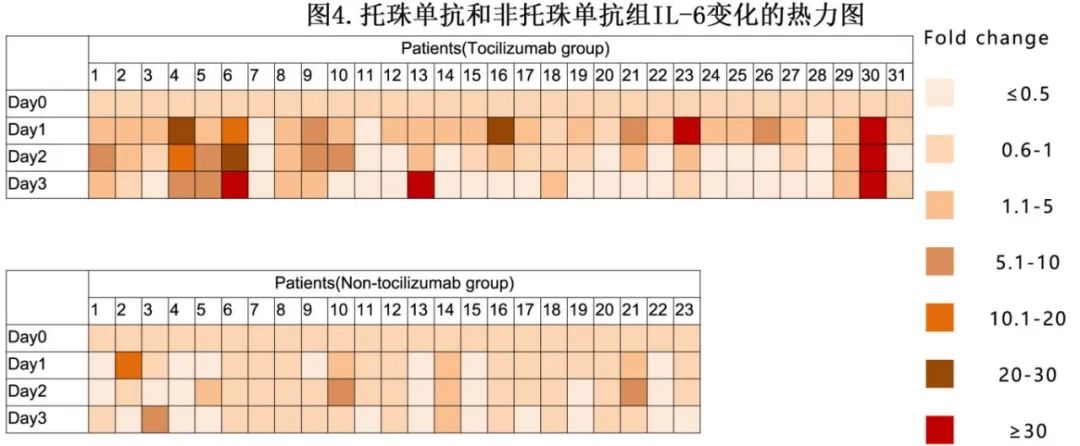
在托珠单抗组的31例可评估患者中,26例(83.9%)在接受托珠单抗治疗后3日内出现血浆IL-6浓度一过性升高,远高于非托珠单抗组的26.1%(6/23)。在接受托珠单抗治疗后3天内,同期内IL-6水平增加≥10倍的患者比例也显著较高(19.4%[6/31] vs 4.3%[1/23]) (图4)。
托珠单抗组和非托珠单抗组在中性粒细胞减少症的发生率没有显著差异(p=0.118)。此外,在CAR-T细胞输注后3周,托珠单抗并没有显著降低中性粒细胞≥0.2X109/L的患者比例(p=0.214)。托珠单抗组10例患者发生重度感染事件(22.2%),多为血流感染和肺部感染,而非托珠单抗组4例患者发生重度感染(8.3%;表2)。
CD19 CAR-T细胞动力学
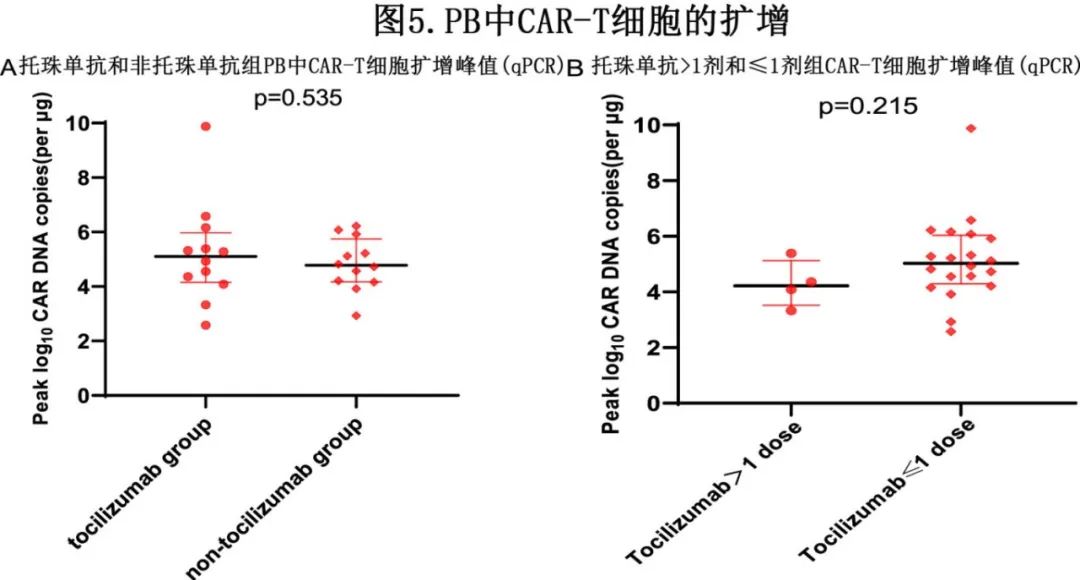
24例患者的外周血(PB)样本足以评估CAR-T细胞的扩增和持久性。托珠单抗治疗组外周血中CAR DNA拷贝的中位峰值数量与非托珠单抗组相当(p=0.535;图5A)。此外,与未接受或仅接受1剂托珠单抗的患者相比,使用>1剂托珠单抗似乎并未影响CAR-T细胞的扩增(p=0.215;图5B)。
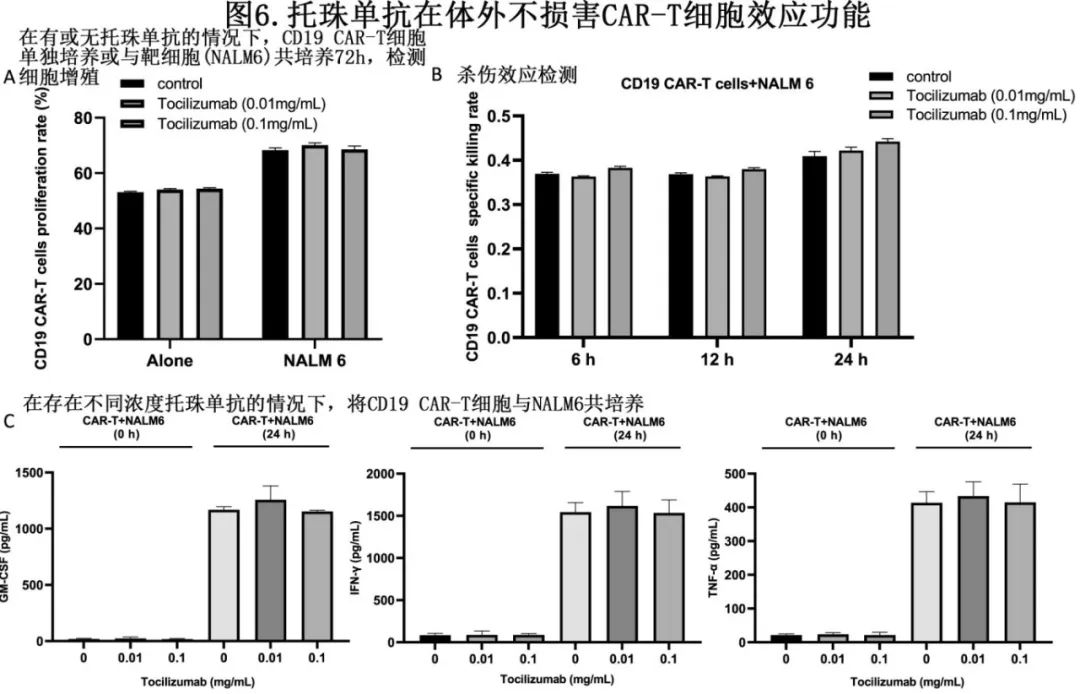
托珠单抗在体外对CD19 CAR-T细胞效应功能的影响
在有或无托珠单抗情况下,将CD19 CAR-T细胞与CD19þ ALL细胞系NALM6共培养。结果显示,在不同浓度(0、0.01或0.1 mg/mL)的托珠单抗下,CD19 CAR-T细胞单独培养或与NALM6细胞共培养时的增殖均无显著差异(图6A)。同样,在有或无不同浓度托珠单抗的情况下,CAR-T细胞对靶细胞的杀伤作用无显著差异(图6B)。为评估托珠单抗对CAR-T细胞分泌功能的影响,作者检测了共培养细胞上清液中GM‐CSF、TNF‐α和IFN‐γ的水平。与靶细胞NALM6共培养24h后,CAR-T细胞分泌的上述细胞因子水平均显著升高;低浓度(0.01 mg/mL)或高浓度(0.1 mg/mL)托珠单抗对CAR-T细胞分泌GM-CSF、TNF-α或IFN-γ均无影响(图6C)。
总结
该研究纳入93例接受人源化CD19 CAR-T细胞治疗的急性B淋巴细胞白血病患者,其中45例患者接受托珠单抗治疗(托珠单抗组),而48例患者未接受托珠单抗治疗(非托珠单抗组);13例患者接受>1剂托珠单抗治疗。与非托珠单抗组相比,托珠单抗组患者表现出相似的完全缓解率、总生存和无事件生存;与接受≤1剂托珠单抗治疗的患者相比,接受1剂>托珠单抗治疗不影响患者的CR率、OS和EFS。在托珠单抗组,所有患者均发生CRS, 26.7%发生ICANS;在非托珠单抗组中,64.6%的患者发生CRS, 8.3%发生ICANS。高达75%的ICANS和87.5%的≥3级ICANS发生于托珠单抗组。在体外评估中,托珠单抗不损害CAR-T细胞的增殖和杀伤作用。总的来说,托珠单抗不影响CAR-T细胞的疗效,但可能增加ICANS的可能性。
托珠单抗是一种临床可行的治疗CRS的药物,且不会减弱CAR-T细胞在B‐ALL患者中的抗肿瘤疗效。但对于具有ICANS潜在高风险的患者,应谨慎使用托珠单抗,尤其是IL-6水平迅速升高的患者。此外还需要更多的前瞻性研究来证实。
参考文献
Wang X, Zhang B, Zhang Q, et al.Impact of tocilizumab on anti‐CD19 chimeric antigen receptor T‐cell therapy in B‐cell acute lymphoblastic leukemia. Cancer.2024;1‐10. doi:10.1002/cncr.35316
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#托珠单抗# #CAR-T# #急性B淋巴细胞白血病#
141