好文推荐 | 刺槐素通过自噬调控ROS/NLRP3信号通路对脑缺血再灌注损伤发挥保护作用
2023-11-06 中风与神经疾病杂志 中风与神经疾病杂志 发表于上海
本研究建立小鼠小胶质细胞OGD模型,给予刺槐素进行干预,研究观察刺槐素对氧糖剥夺再灌注损伤后细胞的存活和死亡情况,为将来刺槐素发展成为理想的脑卒中治疗药物提供了实验依据和学术基础。
摘要
目的 基于自噬/ROS/NLRP3炎症小体信号通路,探讨刺槐素(Acacetin)对氧糖剥夺再灌注(OGD/R)损伤后的小胶质细胞保护作用机制。方法 培养小鼠小胶质细胞(BV2),分为正常对照组、OGD模型组和OGD+Acacetin组(10 μmol)。缺氧6 h复氧24 h后采用4-甲基偶氮唑蓝(MTT)检测BV2细胞活性; 乳酸脱氢酶(LDH)法检测细胞的死亡率;活性氧(ROS)试剂盒测定细胞内ROS水平;Western blot检测LC3-Ⅱ、LC3-Ⅱ/LC3-Ⅰ、beclin-1、NLRP3、caspase-1和IL-1β等蛋白的表达。结果 刺槐素能增加OGD/R损伤后小胶质细胞的存活率,减少LDH的释放,降低ROS的生成,增加LC3-Ⅱ和beclin-1蛋白的表达,进一步下调NLRP3、caspase-1和IL-1β的表达。结论 Acacetin能减轻OGD/R后小胶质细胞的损伤从而对脑缺血再灌注损伤发挥保护作用,其作用机制可能与抑制ROS的产生、激活自噬、抑制NLRP3炎症小体有关。
脑卒中是一种高发病率、高致残率和高致死率的疾病,并成为我国第一位致死病因。脑卒中分为缺血性卒中和出血性卒中,其中80%为缺血性卒中。目前缺血性卒中的策略是尽早再通血管,挽救缺血半暗带。循证医学最为有效的方式是重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)溶栓,但是由于其严格的时间窗,临床患者只有3%~5%能从中获益。也有报道称银杏黄酮苷元、丙泊酚和β-雌二醇等通过调节多种信号通路直接减轻卒中后的神经元损伤。因此,合理开发新的神经保护剂来减轻卒中引起的神经元损伤,可能会产生更好的治疗缺血性卒中的方法。
刺槐素(Acacetin)是一种可从雪莲等植物中提取获得的黄酮类化合物,具有抗氧化作用和抗炎症效应。我们前期研究发现刺槐素能抑制NLRP3的激活,对小鼠脑缺血再灌注损伤发挥保护作用。有研究表明自噬可负向调控NLRP3炎症小体,减轻炎症反应,刺槐素能否通过自噬调节ROS的释放进而调控NLRP3炎症小体的活化。
本研究建立小鼠小胶质细胞OGD模型,给予刺槐素进行干预,研究观察刺槐素对氧糖剥夺再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)损伤后细胞的存活和死亡情况,分析刺槐素对活性氧(reactive oxygen species,ROS)、自噬相关蛋白LC3、beclin-1和NLRP3信号通路的表达,阐明刺槐素是否通过自噬/ROS/NLRP3通路发挥保护作用,为将来刺槐素发展成为理想的脑卒中治疗药物提供了实验依据和学术基础。
1 材料与方法
1.1 材料 BV2细胞购于武汉普诺赛生命科技有限公司;DMEM-高糖培养基、DMEM-无糖培养基、胎牛血清购于GIBCO公司;MTT购于BIOFROX公司;LDH试剂盒购于南京建成生物工程研究所;DHE细胞ROS检测试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒购于碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养 BV2细胞在含10%FBS、青霉素、链霉素的DMEM高糖培养基中,置于37 ℃、5% CO2培养箱中培养。细胞的密度达到80%时,对细胞进行传代,取对数生长期状态良好的细胞进行试验。将细胞分为:正常对照组、OGD模型组和OGD+Acacetin组。刺槐素用含0.1%的二甲亚砜稀释(dimethyl sulfoxide,DMSO)。
1.2.2 OGD模型建立和药物干预 参照文献制备OGD模型。取对数生长期生长状态良好的BV2细胞,以5×10 5个/孔,接入6孔板,37 ℃培养过夜;将完全培养基换成无糖的DMEM培养基,置入参数预先设置好的三气培养箱(气体参数设置为:1% O2、94% N2、5%CO2),O2浓度降至1%时开始计时,稳定3 h后,将无糖的DMEM培养基换成含10% FBS DMEM高糖培养基,并置于正常(气体参数设置为:21% O2、74% N2、5%CO2)的细胞培养箱中继续培养24 h。药物干预组在OGD前30 min、OGD时以及OGD 后24 h在培养基中加入10 μmol/L刺槐素。
1.2.3 MTT检测 细胞培养所需时间后,加入5 mg/ml MTT溶液,37 ℃避光培养4 h,吸出培养基,加入150 μl DMSO震荡10 min,酶标仪测定各孔吸光值OD 568。细胞存活率=(测试组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.4 LDH检测 复氧24 h后收集细胞上清液,按LDH试剂盒说明书操作。波长450 nm,酶标仪测定各孔吸光度OD值。以对照组LDH漏出率为100%,计算各组LDH漏出的相对百分比。
1.2.5 ROS检测 用0.25%胰酶消化细胞,终止消化后收集,1000 rpm,5 min离心,去上清,加PBS重悬;用PBS将细胞润洗两次,1000 rpm,5 min离心;按照DHE细胞ROS检测试剂盒操作说明进行:去掉PBS后加入稀释好的DHE 1 ml; 37 ℃培养箱孵育20 min,每隔3 min混匀一次;用无血清培养基洗涤细胞3次;流式细胞仪上机检测。
1.2.6 Western blot检测 细胞样本弃细胞上清后六孔板每孔加入120 μl RIPA裂解液提取蛋白,采用BCA微量法测定蛋白浓度。按照体积比加入5x蛋白上样缓冲液,沸水中进行沸水浴10 min,取出后-80 ℃冰冻保存。取40 μg样品,SDS PAGE凝胶电泳。电泳条件:浓缩胶80 V,分离胶100 V。电泳结束后,将胶上蛋白质条带转移至PVDF 膜上。膜用5%牛血清白蛋白室温下封闭2 h,分别加入β-actin(1∶5000)、LC3 (1∶1000)、beclin-1 (1∶1000)、caspase-1(1∶1000)、IL-1β(1∶1000)、NLRP3(1∶1000)抗体,4 ℃孵育过夜。TBST洗涤10 min×3次,加入相应的二抗抗体(1∶5 000),室温下孵育2 h。TBST洗涤10 min×3次,将ECL试剂中增强液与稳定的过氧化物酶溶液按1∶1比例混匀,滴加工作液于PVDF膜上, X光胶片显影、定影,扫描胶片,用Band Scan分析胶片灰度值。以目的基因条带吸光度/β肌动蛋白条带吸光度比值计算相对表达量。
1.2.7 统计学分析 所有数据采用均值±标准差(x±s)表示,运用SPSS 22.0软件对各组数据进行统计学分析,多组间比较采用单因素方差分析,组间两两比较采用Tukey法。P<0.05为差异有统计学意义。
2 结果
2.1 刺槐素对OGD/R后小胶质细胞存活和死亡的影响 我们首先在体外验证刺槐素对OGD诱导的BV2细胞损伤的保护作用,检测了细胞的存活和乳酸脱氢酶的漏出情况。研究发现,与正常对照组相比,OGD模型组细胞存活率显著降低(P<0.001),LDH漏出率显著增加(P<0.01);给予刺槐素治疗后,细胞存活率显著升高(P<0.01),LDH漏出率显著降低(P<0.05)(见图1)。结果表明刺槐素具有神经保护作用。
2.2 刺槐素对OGD/R后小胶质细胞ROS生成的影响 与正常对照组相比,OGD模型组ROS释放显著增加(P<0.001),给予刺槐素治疗后,ROS释放显著降低(P<0.001)(见图2)。
2.3 刺槐素对OGD/R后小胶质细胞自噬相关蛋白beclin-1和LC3表达的影响 Western blot结果显示,与正常对照组相比,细胞中LC3-Ⅱ/LC3-Ⅰ和beclin-1(P<0.001)表达均增加;与OGD模型组相比,给予刺槐素治疗后,LC3-Ⅱ/LC3-Ⅰ(P<0.05)和bclin-1(P<0.001)表达均显著增加(见图3)。表明刺槐素能激活小胶质细胞OGD后的自噬。
2.4 刺槐素对OGD/R后小胶质细胞NLRP3炎症小体表达的影响 Western blot结果显示,各组间Pro-caspse-1和pro-IL-1β表达无显著差异;与正常对照组相比,OGD组NLRP3、caspase-1和IL-1β表达均显著增加(均P<0.001),给予刺槐素治疗后,NLRP3、caspase-1和IL-1β表达均显著降低(见图4)。表明刺槐素能抑制NLRP3炎症小体的活化。
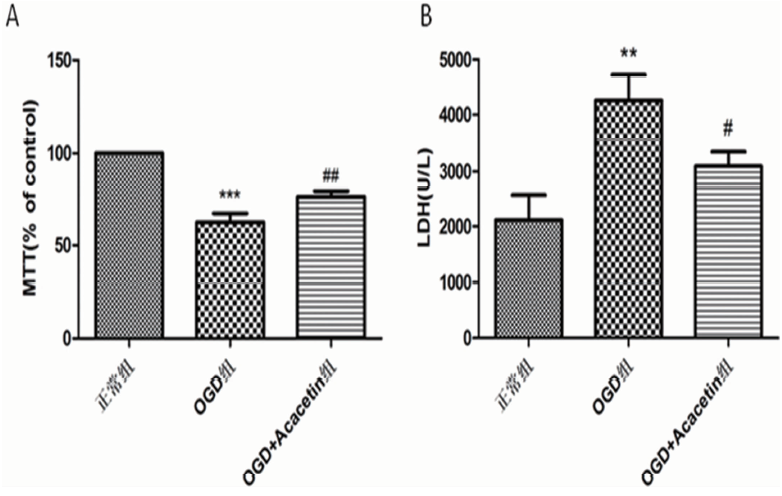
图1 各组细胞MTT和LDH的表达
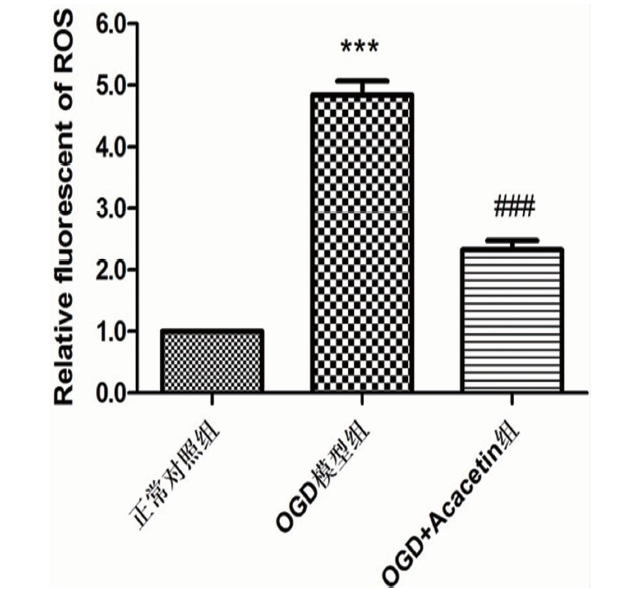
与正常对照组相比***P<0.001;与OGD模型组相比###P<0.001
图2 各组BV2细胞ROS生成测定(x±s,n=3)
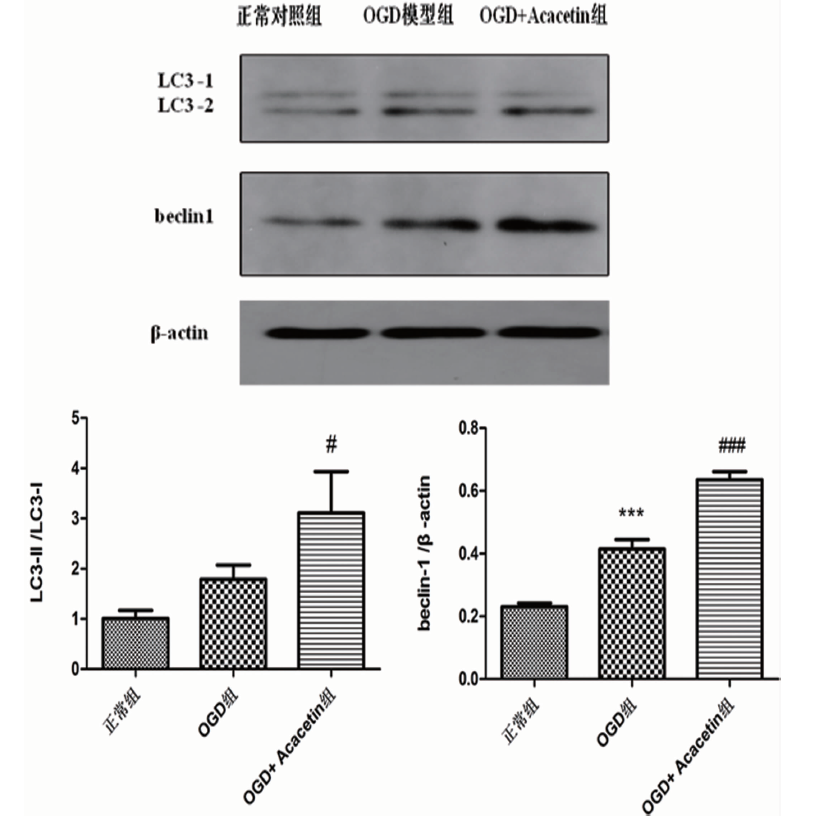
与正常对照组相比***P<0.001;与OGD模型组相比#P<0.05,###P<0.001
图3 各组细胞中LC3蛋白和beclin-1蛋白的表达(x±s,n=3)
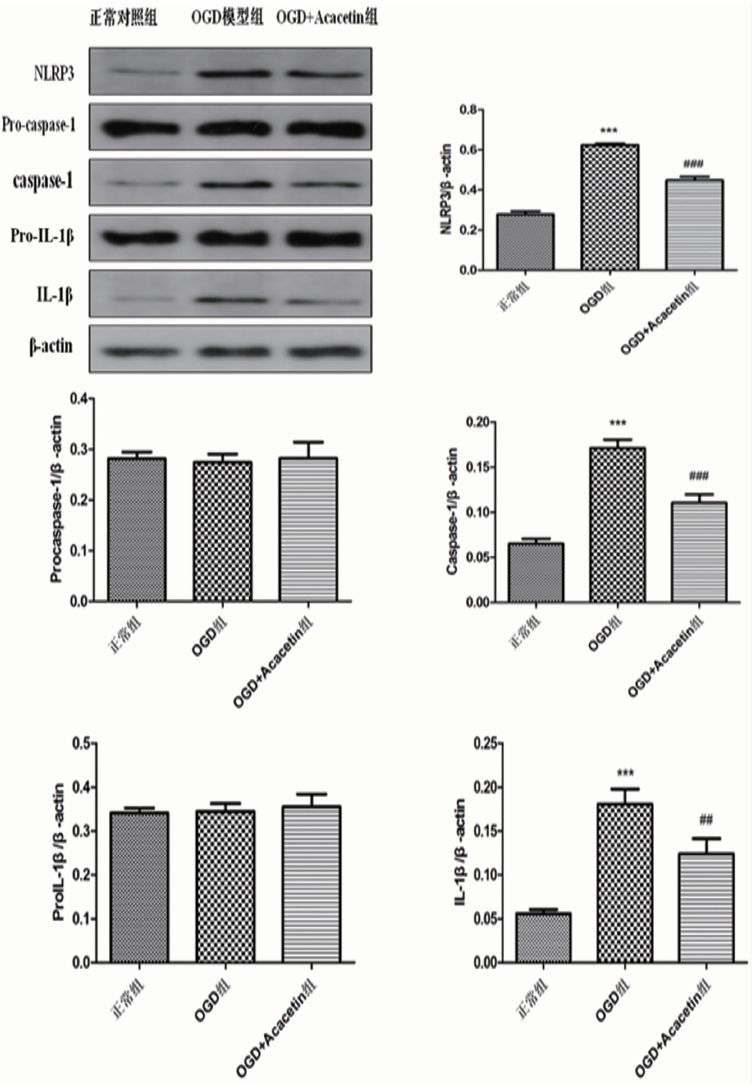
与正常对照组相比***P<0.001;与OGD模型组相比##P<0.01,###P<0.001
图4 各组细胞中NLRP3炎症小体相关蛋白的表达(x±s,n=3)
3 讨论
我们前期在动物实验上发现刺槐素能够减少小鼠梗死体积,改善神经功能评分。本研究利用小胶质细胞在体外建立OGD/R模型,发现刺槐素可以增加细胞存活率,降低细胞死亡率,体内外试验均证实刺槐素对脑缺血再灌注损伤具有保护作用。
多项研究表明NLRP3炎症小体参与了脑缺血再灌注损伤,Silverman等人证明抑制NLRP3炎症小体可以抑制对脑组织的缺血性损伤。Yang等人研究发现,NLRP3-/-小鼠脑缺血对血脑屏障的破坏较少,导致神经血管损伤减弱。静脉注射免疫球蛋白通过抑制NLRP3炎症体减少缺血诱导的神经元凋亡。所以,阻断或抑制 NLRP3的激活是治疗脑缺血再灌注损伤的有效策略。在本研究中,我们发现刺槐素可以抑制小胶质细胞OGD损伤后的NLRP3、caspase-1和IL-β的表达,说明刺槐素可以抑制OGD诱导的NLRP3炎症小体激活。
ROS是最早发现的触发NLRP3炎症小体激活事件之一,多个研究揭示抑制ROS能抑制NLRP3炎症小体活化,减轻脑缺血损伤。在本研究中,OGD损伤后,BV2细胞的ROS生成显著增加,而刺槐素可以抑制OGD损伤后ROS的生成。
越来越多的证据表明自噬和NLRP3炎症小体关系复杂,一方面,在NLRP3炎性小体激活过程中会促进自噬;另一方面,自噬的过度激活可以抑制NLRP3炎症体的激活。同时自噬在缺血再灌注损伤中发挥了重要作用。刺槐素是否通过调控自噬抑制NLRP3炎症小体激活,从而对脑缺血再灌注损伤发挥保护作用,目前尚未见相关报道。在本研究中,OGD损伤后,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ和beclin-1均增加,表明脑缺血再灌注损伤后自噬被激活,给予刺槐素处理后能激活自噬。
综上所述,本研究发现刺槐素可以通过抑制脑缺血再灌注损伤后ROS的生成,激活自噬,进而抑制NLRP3炎症小体的激活,对脑缺血再灌注损伤发挥保护作用。这些发现为刺槐素的深入研究和利用奠定了基础,同时也为缺血性卒中的临床治疗提供了一种新的有潜力的治疗途径。
参考文献
[1]王拥军,李子孝,谷鸿秋,等.中国卒中报告2019[J].中国卒中杂志,2020,15(10):1037-1043.
[2]Zi W,Qiu Z,Li F,et al.Effect of endovascular treatment alone vs intravenous alteplase plus endovascular treatment on functional independence in patients with acute ischemic stroke:the DEVT randomized clinical trial[J].JAMA,2021,325(3):234-243.
[3]Liu L,Yang J,Zu B,et al.Acacetin regulated the reciprocal differentiation of Th17 cells and Treg cells and mitigated the symptoms of collagen-induced arthritis in mice[J].Scand J Immunol,2018,8(4):e12712.
[4] Wu D,Wang Y,Zhang H,et al.Acacetin attenuates mice endotoxin-induced acute lung injury via augmentation of heme oxygenase-1 activity[J].Inflammopharmacology,2018,26(2):635-643.
[5]Sun F,Li D,Wang C,et al.Acacetin-induced cell apoptosis in head and neck squamous cell carcinoma cells:Evidence for the role of muscarinic M3 receptor[J].Phytother Res,2019,33(5):1551-1561.
[6]Bu J,Shi S,Wang HQ,et al.Acacetin protects against cerebral ischemia-reperfusion injury via the NLRP3 signaling pathway[J].Neural Regeneration Research,2019,14(4):605-612.
[7]Chen Y,MengJ,Xu Q,et al.Rapamycin improves the neuroprotection effect of inhibition of NLRP3 inflammasome activation after TBI[J].Brain Res,2019,1710:163-172.
[8]Fu C,Zhang X,LuY,et al.Geniposide inhibits NLRP3 inflammasome activation via autophagy in BV-2 microglial cells exposed to oxygen-glucose deprivation/reoxygenation[J].Int Immunopharmacol,2020,84:106547.
[9]Li H,Wang Y,Wang B,et al.Baicalin and geniposide inhibit polarization and inflammatory injury of OGD/R-treated microglia by suppressing the 5-LOX/LTB4 pathway[J].Neurochem Res,2021,46(7):1844-1858.
[10]补娟,赵宗峰,王慧琴,等.刺槐素的不同给药时间对小鼠局灶性脑缺血的影响[J].卒中与神经疾病,2016,8(4):263-266.
[11]Silverman WR,de Rivero Vaccari JP,Locovei S,et al.The pannexin 1 channel activates the inflammasome in neurons and astrocytes[J].J Biol Chem,2009,284(27):18143-18151.
[12]Yang F,Wang Z,Wei X,et al.NLRP3 deficiency ameliorates neurovascular damage in experimental ischemic stroke[J].Journal of Cerebral Blood Flow and Metabolism,2014,34(4):660-667.
[13]Fann DY,Lee SY,Manzanero S,et al.Intravenous immunoglobulin suppresses NLRP1 and NLRP3 inflammasome-mediated neuronal death in ischemic stroke[J].Cell Death Dis,2013,4:e790.
[14]Minutoli L,Puzzolo D,Rinaldi M,et al.ROS-mediated NLRP3 inflammasome activation in brain,heart,kidney,and testis ischemia/reperfusion injury[J].Oxid Med Cell Longev,2016,2016:2183026.
[15]Ishrat T,Mohamed IN,Pillai B,et al.Thioredoxin-interacting protein:a novel target for neuroprotection in experimental thromboembolic stroke in mice[J].Mol Neurobiol,2015,51(2):766-778.
[16]Hou Y,Wang Y,He Q,et al.Nrf2 inhibits NLRP3 inflammasome activation through regulating Trx1/TXNIP complex in cerebral ischemia reperfusion injury[J].Behav Brain Res,2017,336:32-39.
[17]Lin Y,HuangT,Shen,W,et al.TRPV1 Suppressed NLRP3 through regulating autophagy in microglia after ischemia-reperfusion injury[J].J Mol Neurosci,2022,72(4):792-801.
[18]Shao Z,Dou S,Zhu J,et al.The role of mitophagy in ischemic stroke[J].Front Neurol,2020,11:608610.
[19]He GQ,Chen Y,Liao HJ,et al.Associations between Huwe1 and autophagy in rat cerebral neuron oxygenglucose deprivation and reperfusion injury[J].Mol Med Rep,2020,22(6):5083-5094.
[20]Zhu J,Wang L,Zhang J.Galuteolin inhibited autophagy for neuroprotection against transient focal cerebral ischemia in rats[J].Neuromolecular Med,2020,12,22(4):493-502.
作者信息
基金项目: 新疆维吾尔自治区自然科学基金(No.2020D01C089);新疆维吾尔自治区人民医院院内项目(No.20190307)
作者单位: (1.新疆维吾尔自治区人民医院医学研究与转化中心,新疆 乌鲁木齐 830001;2.新疆维吾尔自治区人民医院全科医疗,新疆 乌鲁木齐 830001)
通讯作者: 牛晓珊,E-mail:470097414@qq.com
引证本文
补娟,纪国庆,叶勒丹·马汉,等.刺槐素通过自噬调控ROS/NLRP3信号通路对脑缺血再灌注损伤发挥保护作用[J].中风与神经疾病杂志,2023,40(2):99-102.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













学习新知,进一步提高自己的认知
33